一种耐低温α-乙酰乳酸脱羧酶在枯草芽孢杆菌中的高效表达
李静静, 徐美娟, 张 显, 饶志明
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
双乙酰(Diacetyl,DA)是一种重要的风味物质,可以使黄油、奶油、脱脂乳和许多新鲜发酵的乳制品具有特殊风味和香气[1]。DA含量也是判断啤酒成熟与否的重要指标,啤酒中DA的口味阈值较低,只有0.02~0.10 mg/L,当其含量超过阈值时就会给啤酒带来不愉快的味道[2]。α-乙酰乳酸脱羧酶 (αacetolactate decarboxylase,α-ALDC,EC.4.1.1.5)能催化DA的前体物α-乙酰乳酸快速脱羧形成乙偶姻,避免了DA的生成[3],它可以缩短啤酒熟化周期,提高生产效率,具有极大的经济价值。
ALDC于1952年首次从产气肠杆菌中分离得到,之后很多学者就该酶在生物界中的分布及基因克隆等展开了研究。Godtfredsen等[4]的研究表明,很多细菌具有ALDC活性,但目前在真菌、海藻和原生动物等真核生物中还未发现该酶的存在。酿酒酵母不含有ALDC基因,而细菌中天然存在的ALDC产量也很低,因此,要想将该酶应用于啤酒工业,研究ALDC的分子结构以及ALDC基因,进行基因的克隆和表达,提高酶的产量,是必然的选择。随着对ALDC分子水平研究的深入,ALDC基因已经从多种菌株中克隆得到[5-8],并在大肠杆菌、枯草芽孢杆菌和酵母中获得了不同程度的表达。高健等[9]从枯草芽孢杆菌BD-5克隆得到了ALDC基因,并在大肠杆菌中获得了表达,但是酶活不高。李联政等[8]从枯草芽孢杆菌168中扩增到ALDC基因,在大肠杆菌中表达酶活为0.11 U/mL。廖东庆等[10]将ALDC表达原件整合到枯草芽孢杆菌基因组中,得到的ALDC酶活为15.6 U/mL。有关酵母中整合表达的研究显示,ALDC表达的酶活较低。不同来源的ALDC的最适温度及稳定性等性质存在差异,已报道的ALDC最适作用温度集中在30~40℃,丹麦诺维信公司开发的ALDC酶制剂Maturex的最适作用温度也达到了35~40℃。而啤酒生产中正常的发酵温度只有10℃左右,在该温度下,ALDC酶活力只能达到其最高活力的15%~20%,这大大削弱了酶的作用效率,造成极大的浪费,同时也提高了生产成本。因此获得一种耐低温ALDC就具有了十分重要的意义。
作者所在实验室前期通过低温筛选得到一株ALDC活性较高的菌株Bacillus subtilis L5-20,获得的纯酶在啤酒发酵中进行了初步试验,能有效降低DA的含量,但原始菌ALDC的表达量偏低。本研究中以Bacillus subtilis L5-20为出发菌,克隆其ALDC基因,构建重组枯草芽孢杆菌。对重组ALDC进行Ni-NTA柱纯化,并进行了酶学性质分析,以及在5 L的发酵罐放大实验研究,以期获得高表达且更适用于啤酒发酵的ALDC,为其工业化应用奠定基础。
1 材料与方法
1.1 菌株与质粒
B.subtilis L5-20由作者所在实验室前期筛选获得,大肠杆菌Escherichia coli JM109和B.subtilis WB600由作者所在实验室保藏,克隆载体pMD18-T购自Takara公司,表达载体pMA5由作者所在实验室保藏。
1.2 主要试剂与培养基
工具酶、IPTG,购自TaKaRa公司;质粒小量抽提试剂盒、胶回收试剂盒、咪唑、抗生素、α-萘酚、肌酸、2-(N-马啉代)乙磺酸和 Brij35,购自上海Sangon公司;丙烯酰胺、甲叉双丙烯酰胺(American Promega Corporation)、广范围蛋白质分子量标准,购自Fermentas公司;2-乙酰基-2-甲基乙酰乙酸乙酯(ethyl-2-acetoxy-2-methylacetocetate),购自 Sigma Aldrich公司;PCR引物,由上海赛百盛基因技术有限公司合成;其他试剂均为国产试剂纯。
LB培养基:酵母粉0.5 g/dL,蛋白胨1 g/dL,NaCl 1 g/dL,pH 7.0。
发酵产酶培养基:大豆蛋白胨1 g/dL,葡萄糖4 g/dL, 玉米浆 1.5 g/dL, 尿素 0.3 g/dL,K2HPO4·3H2O 0.17 g/dL,KH2PO40.23 g/dL,MgSO4·7H2O 0.075 g/dL,NaCl 5 g/dL,pH 6.8~7.0。
1.3 主要试剂配制
酶活测定缓冲液 MES I(pH 6.0):0.05 mol/L 2-(N-马啉代) 乙磺酸、0.05 g/dL Brij35、0.6 mol/L NaCl,用 1 mol/L NaOH 调 pH。
底物缓冲液 MESⅡ (pH 6.0):0.05 mol/L 2-(N-马啉代)乙磺酸,用1 mol/L NaOH调pH至6.0。
显色剂:将质量分数5%α-萘酚(用正丙醇溶解)、质量分数10%NaOH、质量分数0.5%肌酸、蒸馏水按比例(1∶1∶1∶6.8)混合。 注意,显色剂要在用前配置,另外α-萘酚要避光保存。
底物:取100 μL 2-乙酰基-2-甲基乙酰乙酸乙酯,加入6 mL 0.5 mol/L NaOH,不停晃动20 min后,用0.5 mol/L HCl调pH 6.0,用MESⅡ缓冲液定容至50 mL。注意,该底物溶液需在使用前配制。
1.4 ALDC基因alsD的克隆及表达载体的构建
根据NCBI枯草芽孢杆菌的全基因组核酸序列中ALDC的基因序列,设计一对引物Forward/Reverse(见表1),在下游序列插入6个His编码基因(斜体部分),并在引物的5’端分别加上相应的酶切位点(下划线部分)。
提取B.subtilis L5-20染色体DNA为模板,以Forward/Reverse引物进行PCR扩增获得目的基因片段 alsD-His,PCR扩增条件为:94℃预变性1 min,然后 94℃变性 1 min;56℃退火 1 min,72℃延伸1 min 30 s,30个循环;72℃延伸10 min。所得基因片段经胶回收后与克隆载体pMD18-T连接,转化E.coli JM109,经过氨苄青霉素抗性平板筛选,挑取阳性转化子。提取质粒酶切鉴定,将重组质粒命名为T-alsD-His,DNA测序由上海Sangon公司完成。经测序验证正确的重组质粒T-alsD-His,用BamH I和Mlu I双酶切后连接到经相同酶切的pMA5上,构建表达载体pMA5-alsD-His。

表1 文中所涉及的引物Table 1 Primers used in this study
1.5 ALDC在枯草芽孢杆菌中的表达
将构建好的表达载体pMA5-alsD-His转化至B.subtilis WB600中,转化过程参照Spizizen所述的方法进行。在卡那霉素抗性平板上筛选阳性重组子,并经酶切验证。将经验证正确的重组菌pMA5-alsD-His/B.subtilis WB600接种至含有 50 μg/mL卡那霉素的LB液体培养基中37℃过夜培养,次日以1%的接种量转接至50 mL LB液体培养基中37℃培养16 h。将发酵液于10 000 r/min 4℃离心15 min,发酵液上清液用于重组菌胞外ALDC酶活的测定,收集菌体,用0质量分数.85%NaCl洗涤2次,然后悬浮于MES I(pH 6.0)缓冲液中。采用超声波细胞破碎法破碎细胞(300 W,工作2 s停5 s,工作时间 10 min),15 000 r/min 4 ℃离心 30 min,所得上清液用于重组菌胞内ALDC酶活的测定。
1.6 酶的Ni-NTA纯化
发酵后离心收集菌体,用pH 7.4的PBS缓冲液洗涤3次,重悬于McAc-0溶液 (20 mM Tris-HCl,500 mmol/L NaCl,质量分数 10% 甘油),采用超声破碎制得粗酶液,经0.45 μm滤膜过滤后,采用Ni-NTA蛋白纯化柱纯化目的蛋白质,经过两次上样,依靠蛋白末端6个His与Ni-NTA的金属离子进行螯合。洗脱过程首先用不含有咪唑的缓冲液洗柱,目的是洗脱未与Ni-NTA结合的细胞体杂蛋白,然后用不同浓度的咪唑(20~300 mmol/L)缓冲液进行梯度洗脱,根据蛋白质的大小与金属离子的结合牢固程度,在一定的咪唑浓度条件下,可以得到较纯的酶液。蛋白质含量采用Bradford法测定,以BSA为标准蛋白。
1.7 ALDC酶活力的测定
参照Garmyn[7],陈卿[11]等所述的方法并加以调整。
ALDC催化α-乙酰乳酸脱羧生成乙偶姻,乙偶姻在碱性条件下可以与肌酸和α-萘酚的混合物反应生成红色的物质,在一定的范围内生成的红色物质的吸光值与乙偶姻的含量成正比,根据这一原理,来测定ALDC的活性。一个单位酶活(U)定义为:在30℃,pH 6.0的反应条件下,1 min使a-乙酰乳酸脱羧形成1 μmol乙偶姻所需的酶量。
标准曲线的测定:取溶于MES I的乙偶姻各400 μL(乙偶姻的含量分别为 5、10、15、20、25 μg),加入显色剂4.6 mL,30℃水浴30 min显色后于520 nm处测吸光值,以400 μL MES I加4.6 mL显色剂作为空白对照。绘制得到的标准曲线用于下一步酶活的计算。
酶活的测定:200 μL酶液与200 μL底物混合,在30℃水浴反应10 min加入4.6 mL显色剂30℃水浴30 min显色,520 nm处测定吸光值。
1.8 酶学性质的研究方法
1.8.1 最适pH及pH稳定性 用底物缓冲液MESⅡ配制不同 pH(3.0~11.0)的底物溶液,将酶液用MES I稀释一定倍数,然后将不同pH的底物380 μL与稀释好的酶液20 μL反应,测定不同pH条件下ALDC的活性,考察pH值对其酶促反应的影响。配制不同pH(5.0~10.0)的酶活测定缓冲液MES I,用它们来稀释酶液得到不同pH的酶液。让酶处于不同pH环境中,每隔一定时间取样,测定酶的剩余活性;反应体系为:20 μL 酶液,180 μL MES I,200 μL底物。以蒸馏水代替酶液作为空白对照,考察该酶在不同pH条件下的稳定性。
1.8.2 最适温度及温度稳定性 在10~45℃设置8个反应温度 10、15、20、25、30、35、40、45 ℃,测定不同温度条件下ALDC的酶活力,确定其最适反应温度。 将适当稀释的酶液分别在–20、0、25、35、45、55、65、75℃保温,每隔2 h取样,测定不同温度下酶的剩余活力,从而研究该酶在不同温度下的稳定性。
1.8.3 不同金属离子以及EDTA对酶活的影响分别在反应体系中加入终浓度为1 mmol/L的Ca2+、Sn2+、Ni2+、Zn2+、Li+、Mn2+、K+、Na+、Mg2+、Cu2+、Fe3+离子以及EDTA,以不加金属离子的反应体系为对照,研究各金属离子对ALDC酶活的影响。
1.8.4 Km值及Vmax的测定 配置不同浓度的α-乙酰乳酸底物溶液,分别进行酶促反应,反应时间控制在2 min。采用 Lineweaver-Burk作图法确定ALDC的Km及Vmax值。
1.9 重组枯草芽孢杆菌的产酶发酵培养 重组枯
草芽孢杆菌pMA5-alsD-His/B.subtilis WB600经LB液体培养基活化后,按1%的接种量转接至50 mL发酵产酶培养基中,于37℃培养36 h,进行ALDC酶活测定。并在5 L的发酵罐上进行放大试验,装液量为2.5 L,接种量4%,转速 350 r/min,通气量 1 L/(L·min),37 ℃培养 48 h,发酵过程中跟踪检测菌体浓度、残糖含量及ALDC酶活力。
2 结果与分析
2.1 ALDC基因的克隆及表达载体的构建
提取B.subtilis L5-20全基因组DNA,用所设计的引物进行PCR扩增,得到长度为786 bp(其中包含18 bp的His编码序列)的基因片段(图1)。
将T-alsD-His用BamH I和Mlu I进行双酶切,将其与经相同酶切线性化的表达载体pMA5连接,转化至E.coli JM109感受态细胞中。获得的重组表达载体pMA5-alsD-His经BamH I和Mlu I双酶切验证(图2),得到约7 000 bp和780 bp大小的片段,分别对应线性pMA5和alsD-His的大小,表明外源基因alsD-His已经正确连接到表达载体pMA5上。

图1 alsD基因的PCR扩增Fig.1 PCR amplification of alsD gene
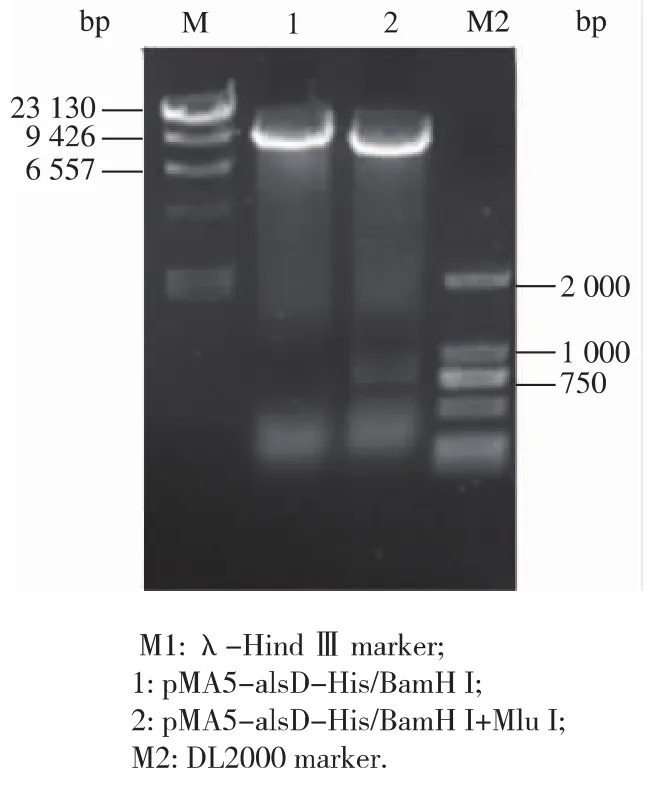
图2 重组质粒pMA5-alsD-His的酶切验证Fig.2 Identification of the recombinant plasmid pMA5-alsD-His by enzyme digestion
2.2 alsD基因在B.subtilis WB600中的表达及重组蛋白ALDC的纯化
将重组载体pMA5-alsD-His转化至B.subtilis WB600中,在卡那霉素抗性平板上筛选阳性重组子,即得重组菌株pMA5-alsD-His/B.subtilis WB600,将其接种于LB液体培养基培养16 h,收集菌体并洗涤,菌体用MES I缓冲液悬浮,采用超声波破碎细胞,破碎上清液SDS-PAGE分析结果显示,重组蛋白相对分子质量(Mr)约为 32×103,与预期分子量大小相符,表明ALDC在B.subtilis WB600成功获得了表达。同时测定粗酶液中的蛋白含量以及酶活力,得知其中蛋白含量为91.0 mg,总酶活为3 395.0 U,比酶活为37.3 U/mg。经Ni-NTA纯化后得到较纯的酶液,测得其中蛋白含量为11.2 mg,总酶活为3 050.0 U,比酶活为272.3 U/mg,纯化后的比酶活是纯化前的7.3倍,酶活回收率为89.8%。SDS-PAGE结果(图3)看出经过纯化得到较纯的重组ALDC蛋白,纯化效果见表2。

图3 重组枯草芽孢杆菌ALDC表达与纯化的SDS-PAGE分析Fig.3 SDS-PAGE analysis of expressed and purified recombinant ALDC

表2 重组蛋白ALDC纯化情况Table 2 Purification of recombinant ALDC
2.3 重组ALDC的酶学性质
2.3.1 最适pH值及pH稳定性 配置pH 3.0~11.0的反应缓冲液,分别测定不同pH下ALDC的酶活力,结果见图 4。 由图 4(a)可知,ALDC 在 pH 5.0~7.0范围内均具有较高的活力,最适pH为6.0。当pH大于7.0时酶活力迅速下降,pH 8.0和pH 9.0条件下的酶活力约为最大酶活的34%,在pH 3.0~4.0及pH 11.0条件下酶活几乎为零。


图4 α-乙酰乳酸脱羧酶的最适pH及其pH稳定性Fig.4 Optimal pH and pH stability of ALDC
将ALDC分别在pH 5.0~10.0条件下处理,测定酶活性。从图4(b)中可以看出,ALDC在pH 6.0~9.0环境中较稳定,在pH 6.0和pH 7.0条件下处理10 h后,剩余酶活仍在90%以上;在pH 8.0和pH 9.0条件下处理10 h后,剩余酶活也在70%以上。在pH 5.0与pH 10.0环境下,该酶的活性在2.5 h内迅速下降,并且在10 h后活性完全消失。表明该重组ALDC较适应中性范围的环境,对酸性及强碱性环境敏感。
2.3.2 最适温度及热稳定性 在10~45℃范围内,进行ALDC的酶促反应,结果如图5(a)所示,随着温度的升高,ALDC酶活呈上升的趋势,在25℃时达到最大值,此后开始呈下降趋势,在20~35℃范围内,ALDC显示较高的活力,最适反应温度为25℃。
将重组 ALDC 分别在-20、0、25、35、45、55、65、75℃条件下保存一定的时间后,测定酶活力大小。结果如图5(b)显示,在25℃以下,该酶非常稳定,保温10 h后剩余酶活仍有95%左右。在35℃和45℃环境下保存10 h后剩余酶活分别在60%和70%以上。55℃时保温10 h后剩余酶活力不足20%。而当温度升高到65℃时,保存4 h即接近完全失活。

图5 α-乙酰乳酸脱羧酶的最适反应温度及其热稳定性Fig.5 Optimal temperature and thermal stability of ALDC
2.3.3 金属离子以及EDTA对酶的影响 通过单独添加相同终浓度(1 mmol/L)的不同金属离子以及EDTA,研究它们对ALDC酶活力的影响,结果如表3所示。 Ni2+对 ALDC 有一定的激活作用,Ca2+、Cu2+、Mn2+、Sn2+、Zn2+、Na+、K+、Li+、EDTA 对其活性有不同程度的抑制作用,其中Ca2+的抑制作用最小,Cu2+、Mn2+、Sn2+、Zn2+次之,Na+、K+、Li+、EDTA 的抑制作用较为强烈,而Fe3+使ALDC活性完全丧失,Mg2+对ALDC既没有激活也没有抑制作用。

表3 金属离子及EDTA对ALDC的影响Table 3 Effect of ions and EDTA on ALDC
2.3.4 Km值及Vmax的测定 根据不同底物浓度与酶促反应的关系,按照米氏方程,采用Lineweaver-Burk作图法,计算得出重组ALDC的Km及Vmax值。如图 6 所示,ALDC 的Km值为 29.04 μmol/L,Vmax为2.82 mmol/(L·min)。

图6 ALDC的Lineweaver-Burk作图Fig.6 Lineweaver-Burk plot of recombinant ALDC
2.4 重组枯草芽孢杆菌ALDC的表达
将pMA5-alsD-His/B.subtilis WB600接种至LB液体培养基中37℃培养16 h。经测定,胞外ALDC酶活为4.9 U/mL,胞内ALDC酶活为22.1 U/mL,总酶活为 27.0 U/mL,约为出发菌B.subtilis L5-20 ALDC总酶活的70倍。
2.5 重组枯草芽孢杆菌pMA5-alsD-His/B.subtilis WB600的发酵产酶研究
重组枯草芽孢杆菌经LB液体培养基活化后,按1%的接种量转接至50 mL发酵产酶培养基,于37℃培养36 h,ALDC酶活测定结果显示,胞外ALDC酶活为22.6 U/mL,胞内酶活为43.2 U/mL,总酶活为65.8 U/mL。
将重组菌在5 L的发酵罐中进行放大试验,结果见图7。随着发酵的进行,菌体量在前期呈现不断上升的趋势,36 h时达到最大值,此后进入平衡期并开始缓慢下降;ALDC酶活的变化与菌体量呈现相似的趋势,在36 h达到最大,约75.9 U/mL,其中胞内、胞外ALDC酶活分别为46.6 U/mL和29.3 U/mL。
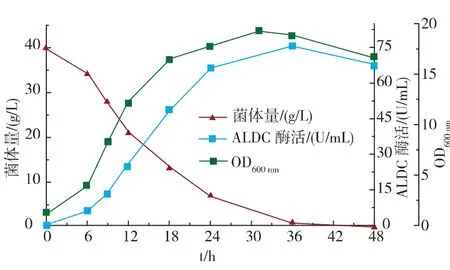
图7 重组枯草芽孢杆菌pMA5-alsD-His/B.subtilis WB600 5 L罐发酵结果Fig.7 Fermentation results of pMA5-alsD-His/B.subtilis WB600 in 5 L bioreactor
3 结语
从一株耐低温B.subtilis L5-20中克隆得到alsD基因,将其连接到表达载体pMA5上,并转化B.subtilis WB600,构建重组菌pMA5-alsD-His/B.subtilis WB600。选用Ni柱亲和层析纯化重组ALDC,纯化后比酶活达272.3 U/mg,回收率为89.8%,纯化倍数为7.3,并用所得的纯酶进行了酶学性质的研究。这是B.subtilis ALDC首次在枯草芽孢杆菌中的游离表达和纯化。
已报道的ALDC最适作用温度都在40℃左右。Rasmussen等[12]从干酪乳杆菌中纯化出的ALDC的最适温度为40℃。Ohshiro等[13]研究了乙酰短杆菌的ALDC,最适反应温度也为40℃,60℃以上迅速失活。尹东等[14]的研究显示,产气肠杆菌ALDC的适合温度为35~45℃。郑华军等[15]研究的地衣芽孢杆菌ALDC最适温度为40℃,且对热(40℃以上)敏感。作者研究获得的重组ALDC最适温度为25℃,在20~35℃范围内均表现出较高的活性,该酶显示出一定的耐低温特性,在15℃酶活力还保留在最高活力的70%左右,10℃时酶活力仍保留在最高活力40%以上,这一优异的特性使它更加适合啤酒生产的条件,极大地提高了酶的催化效率,降低了生产成本。
本研究小组前期将B.subtilis L5-20的alsD基因在大肠杆菌中表达,ALDC酶活为10.3 U/mL,虽然酶活比之前的报道有较大提高,但利用大肠杆菌表达系统表达来源于枯草芽孢杆菌的ALDC效果并不理想。且考虑到大肠杆菌属于潜在致病菌,不适用于食品添加剂用酶的工业化应用;并且目前利用大肠杆菌表达系统表达的蛋白质多为胞内表达,后期提取工艺较复杂,因此从安全性和操作成本上分析,选择一种高效胞外表达枯草芽孢杆菌基因的宿主是非常必要的。ALDC作为食品工业酶制剂,对其安全无毒害的要求较为严格,而枯草芽孢杆菌有长期制备发酵食品的历史,不产内毒素和致热敏蛋白质,是一种公认安全的微生物,无论是作为出发菌还是宿主菌都具有很强的可行性。虽然原始菌B.subtilis L5-20具有ALDC活性,但是其表达量对于工业酶制剂生产来说还远远不够。鉴于以上因素,作者采用基因工程手段,选择枯草芽孢杆菌作为表达的宿主菌,将alsD基因在B.subtilis WB600中获得高效表达,重组菌经LB培养后ALDC酶活达27.0 U/mL,约为出发菌酶活的70倍。而经发酵培养基培养,ALDC酶活高达65.8 U/mL,再经5 L的发酵罐放大试验,ALDC酶活达75.9 U/mL(其中胞内胞外ALDC酶活分别为46.6 U/mL和29.3 U/mL),较出发菌得到了极大地提升,较先前在大肠杆菌中表达的酶活也提高了很多,与已报道的重组菌酶活相比有很大的优势,该重组菌具有很好的开发潜力。
[1]Curic M,Stuer-Lauridsen B,Renault P,et al.A general method for selection of α -acetolactate decarboxylase-deficient Lactococcus lactis mutants to improve diacetyl formation[J].Appl Environ Microbiol,1999,65:1202-1206.
[2]韦函忠,马少敏,韦朝英.啤酒发酵中双乙酰的产生和α-乙酰乳酸脱羧酶的应用[J].广西轻工业,2011(8):17-19.WEI Han-zhong,MA Shao-min,WEI Chao-ying.Diacetyl generation and the application of α-acetolactate decarboxylase in beer fermentation[J].Guangxi Journal of Light Industry,2011(8):17-19.(in Chinese)
[3]Suihko M L,Blomqvist K,Penttila M,et al.Recombinant brewer's yeast strains suitable for accelerated brewing[J].J Biotechnol,1990,14:85-300.
[4]Godtfredsen S E,Lorck H,Sigsgaard P.On the occurrence of α-acetolactate decarboxylases among microorganisms[J].Carlsberg Res Commun,1983,48:239-247.
[5]Repizo G D,Mortera P,Magni C.Disruption of the alsSD operon of Enterococcus faecalis impairs growth on pyruvate at low pH[J].Microbiology-Sgm,2011,157:2708-2719.
[6]张燎原,孙建安,魏东芝,等.粘质沙雷氏菌中乙偶姻合成途径基因克隆、序列分析及表达[J].江西农业大学学报,2011,33(5):0987-0992.ZHANG Liao-yuan,SUN Jian-an,WEI Dong-zhi,et al.Cloning,sequence analysis and heterogenous expression of the genes involved in acetoin pathway from Serratia marcescens H30[J].Acta Agricultural Universitatis Jiangxiensis,2011,33(5):0987-0992.(in Chinese)
[7]Garmyn D,Monnet C,Martineau B,et al.Cloning and sequencing of the gene encoding α-acetolactate decarboxylase from Leuconostoc oenos[J].FEMS Microbiol Lett,1996,145:445-450.
[8]李联政,张惟材,汪建华,等.α-乙酰乳酸脱羧酶在大肠杆菌中的克隆表达[J].生物技术通讯,2005,16(6):618-620.LI Lian-zheng,ZHANG Wei-cai,WANG Jian-hua,et al.Cloning and expression of α-acetolactate decarboxylase gene in E.coli[J].Lett Biotechnol,2005,16(6):618-620.(in Chinese)
[9]高健,铁翠娟,王忠彦,等.枯草芽孢杆菌α-乙酰乳酸脱羧酶基因的克隆及表达[J].微生物学通报,1998,25(6):336-339.GAO Jian,TIE Cui-juan,WANG Zhong-yan,et al.Cloning and expression of α-acetolactate decaroboxylase gene of Bacillus subtilis[J].Microbiology,1998,25(6):336-339.(in Chinese)
[10]廖东庆,陈发忠,岳田芳,等.α-乙酰乳酸脱羧酶基因在枯草芽孢杆菌中的整合型表达[J].基因组学与应用生物学,2010,29(5):843-848.LIAO Dong-qing,CHEN Fa-zhong,YUE Tian-fang,et al.Integrative expression of α -acetolactate decaroboxylase gene in Bacillus subtilis[J].Geno Appl Biol,2010,29(5):843-848.(in Chinese)
[11]陈卿,蔡国林,陆健.树脂固定化α-乙酰乳酸脱羧酶的初步研究[J].食品工业科技,2011,32(2):154-158.CHEN Qing,CAI Guo-lin,LU Jian.Preliminary study on immobilization of α-acetolactate decaroboxylase by resin[J].Science and Technology of Food Industry,2011,32(2):154-158.(in Chinese)
[12]Rasmussen A M,Gibson R M,Godtfredsen S E,et al.Purification of α-acetolactate decarboxylase from Lactobacillus casei DSM 2547[J].Carlsberg Res Commun,1985,50:73-82.
[13]Ohshiro J,Aisaka K,Uwajima T.Purification and chareterization of α-acetolactate decarboxylase from Brevibacterium acetylicum[J].Agric Biol Chem,1989,53(7):1913-1918.
[14]尹东,曾庆华,卢大宁,等.产产气肠杆菌α-乙酰乳酸脱羧酶基因的克隆和表达及影响重组酶活性的因素[J].生物工程学报,1999,15(4):44-49.YIN Dong,ZENG Qing-hua,LU Da-ning,et al.Cloning and expression of α-acetolactate decarboxylase gene for Enterobacter aerogenes and factors influencing the activity of the recombinant enzyme[J].Chin J Biotech,1999,15(4):44-49.(in Chinese)
[15]郑华军,鲍晓明,侯爱华,等.地衣芽孢杆菌α-乙酰乳酸脱羧酶的纯化及酶学性质[J].山东大学学报,2002,37(2):180-183.ZHENG Hua-jun,BAO Xiao-ming,HOU Ai-hua,et al.Purification and properties of α-acetolactate decarboxulase from Bacillus licheniformis[J].Journal of Shandong University,2002,37(2):180-183.(in Chinese)

