葡萄籽中多酚类化合物对口腔致病菌的抑制作用
张 卉, 吴大茹, 尤晓娟, 陈莉娜*
(1.西安交通大学 医学院,陕西 西安 710061;2.美国伊利诺伊大学 芝加哥分校牙科医学院,芝加哥60612)
葡萄籽提取物(Grape seed extract,GSE)是目前风靡世界的一种食品添加剂和保健品。在美国、日本和欧洲,GSE成为人们日常生活中最常使用的天然保健品,是目前美国天然植物提取物10大畅销品种之一。在日本的年销量达到每年100 000 kg[1],具有巨大的市场潜力和开发价值。GSE的最大功用在于其中富含多酚类化合物,其中花青素类是目前为止发现的最高效的氧自由基清除剂,具有极强的抗氧化作用,其抗氧化活性为维生素E的50倍、维生素C的20倍,它能有效清除人体内多余的自由基,具有超强的延缓衰老和增强免疫力的作用,被广泛应用于治疗心血管疾病、癌症、眼科疾病以及化妆品等领域[2-6]。然而对于其中多酚类化合物(包括原花青素以及其它多酚)的抗菌作用的研究报道较少,特别是应用于口腔健康领域的研究并不多见。但是已有研究表明,GSE中的多酚类成分具有抑制口腔致病菌的作用,法国的Bonnaure-Mallet Martine等发明了以原花青素低聚体或单体为活性成分(≥1%)治疗牙周病的制剂[7],并获得了专利保护。因此,在美国伊利诺伊大学芝加哥分校牙科医学院的资助下,作者进行了GSE中多酚类化合物对口腔致病菌的抑制作用的研究。
1 材料与方法
1.1 葡萄籽提取物
实验中使用的葡萄籽提取物来源于美国Polyphenolics公司(Madera,CA 93639,USA)。
1.2 微生物及培养条件
实验中使用的口腔致病菌包括致龋病菌变异链球菌 Streptococcus mutans(ATCC 10449)和戈登链球菌(Streptococcus gordonii challis)以及牙周病菌具 核 梭 杆 菌 Fusobacterium nucleatum(ATCC 10953),这些菌种均保存于美国伊利诺伊大学芝加哥分校牙科医学院的菌种库中。实验中使用的培养基包括脑心浸液培养基(Difco,Sparks,MD) 和厌氧培 养 基 (Oxoid Ltd,Basingstoke,Hampshire,England)。培养条件为37℃,于普通培养箱(对于变异链球菌和戈登链球菌)或厌氧培养箱(对于具核梭杆菌)中培育 24~48 h。
1.3 试剂
实验中使用的色谱填料有:大孔树脂HP-20,购 于 Supelco 公 司 (Bellefonte,PA,USA);Sephadex LH-20,购于GE Healthcare公司。其它化学试剂均购于 Fisher公司(Fair Lawn,NJ,USA)。
1.4 仪器
光密度测试使用Power Wave 200微板扫描分光光度仪 (Bio-Tek Instruments Inc.,Winooski,VT,USA)。
1.5 最小抑制浓度法(MIC Assay)
在96孔微量滴定板中加入待测试的样品溶液和相应的培养基。取相应的测试菌株进行复苏培养(12 h)后,将培养液离心(10 000 r/min,10 min),吸取上层清液并用0.05 mol/L磷酸盐缓冲液(PBS,pH 6.8)洗涤两次,而后将菌落混悬于PBS中。测试菌落混悬液的光密度值(OD),并对其进行相应的稀释,将混悬液加入已经准备好的96孔微量滴定板中,使其终浓度达到5×105(变异链球菌和戈登链球菌)或5×106(具核梭杆菌)CFU/mL。阴性对照组加入与测试样品溶液等体积的生理盐水,阳性对照组加入葡萄糖酸洗必泰溶液 (chlorhexidine gluconate,CHX),其对于3种细菌的MIC值分别为1.25 μg/mL(变异链球菌)、2.5 μg/mL(戈登链球菌)和 2.5 μg/mL(具核梭杆菌)。所有的培养平板均置于37℃相应的培养箱(普通培养箱用于培养变异链球菌和戈登链球菌,厌氧培养箱用于培养具核梭杆菌)中,培养24~48h。而后将培养平板置于光密度测试仪上读取培养液的OD值。通过比较OD值的大小判断微生物的生长情况,OD越大说明微生物生长越多,从而推测被测组分的最小抑制浓度。
1.6 GSE的分离
将60 g葡萄籽提取物溶解于300 mL蒸馏水中,加样于大孔吸附树脂柱,分别以水、20%,40%,60%,80%系列体积分数的甲醇/水和纯甲醇依次洗脱,分为6个组分,分别记为PA-1~PA-6。对这些组分的MIC进行测试后发现PA-1的最小抑制浓度较其它各组分为低,因而对其采用Sephadex LH-20柱色谱进行了进一步的分离,分别以10%,15%,20%,30%,50%,80%,90%系列体积分数甲醇/水和纯甲醇进行洗脱,获得13个组分,分别标记为PA-1-1~PA-1-13。继续采用MIC进行活性追踪,对PA-1-7采用硅胶柱色谱分离,以V(甲苯)∶V(丙酮)∶V(乙酸)=5∶1∶0.1 和 3∶1∶0.1 作为流动相,获得化合物1(没食子酸);对PA-1-10采用硅胶柱色谱分离,以 V(甲苯)∶V(丙酮)∶V(乙酸)=3∶1∶0.1 和 3∶3∶0.1作为流动相,获得化合物3(原儿茶酸);对PA-1-11采用Sephadex LH-20柱色谱进行分离,以体积分数75%、80%甲醇/水及纯甲醇为流动相,获得化合物2(邻苯三酚);对PA-1-12采用硅胶柱色谱分离,以V(甲苯)∶V(丙酮)∶V(乙酸)=3∶1∶0.1,3∶3∶0.1,3∶5∶0.1和 3∶7∶0.1作为流动相,获得化合物 4(表儿茶素)。
2 结果与讨论
2.1 活性追踪分离获得的4种多酚类化合物结构确证
化合物 1:白色针晶(丙酮),1H NMR (360 MHz,DMSO-d6) δH 6.95 (2H,s,H-2 及 H-6);13C NMR(80 MHz,DMSO-d6)δc109.6 (C-2 及 C-6),121.4(C-1),138.9(C-4),146.4(C-3 及 C-5),168.5(C-7);HR-ESIMS:m/z 169.0139 [M-H]-(C7H6O5,calcd 169.014 2)。通过波谱解析并与文献对比[8],确定其为没食子酸。
化合物 2:白色针晶(丙酮),1H NMR(360 MHz,DMSO-d6) δH6.27 (2H,d,J=7.2 Hz,H-4 及 H-6),6.45(1H,dd,J=8.5,8.5 Hz,H-5);13C NMR(80 MHz,DMSO-d6) δc108.0 (C-4 及 C-6),119.4 (C-5),134.0 (C-2),147.2 (C-1 及 C-3);HR-ESIMS:m/z 125.0238[M-H]-(C6H6O3,calcd 125.022 6)。 通过波谱解析并与文献对比[8],确定其为邻苯三酚。
化合物 3:白色针晶(丙酮),1H NMR(360 MHz,acetone-d6) δH6.89 (1H,d,J=8.2 Hz,H-5),7.47(1H,dd,J=8.2,2.0 Hz,H-6),7.52 (1H,d,J=2.0 Hz,H-2);13C NMR (80 MHz,acetone-d6) δc115.3 (C-5),117.1(C-2),123.2(C-6),124.5(C-1),141.6(C-3),146.5 (C-4),159.7 (C-7);HR-ESIMS:m/z 153.0185[M-H]-(C7H6O4,calcd 153.017 2)。 通过波谱解析并与文献对比[8],确定其为原儿茶酸。
化合物 4:白色粉末(甲醇),1H NMR(360 MHz,acetone-d6) δH2.49 (1H,dd,J=16.1,8.7 Hz,H-4axi),2.89 (1H,dd,J=16.1,5.6 Hz,H-4eq),3.96(1H,m,H-3),4.51 (1H,d,J=7.9 Hz,H-2),5.85(1H,d,J=2.3 Hz,H-8),6.00(1H,d,J=3.2 Hz,H-6),6.72(1H,dd,J=8.1,1.9 Hz,H-6’),6.78(1H,d,J=8.1 Hz,H-5’),6.88 (1H,d,J=1.9 Hz,H-2’);13CNMR (80 MHz,acetone-d6) δc27.8 (C-4),67.2(C-3),81.6(C-2),94.1(C-8),95.0(C-6),99.4(C-4a),114.2(C-2’),114.5(C-5’),118.8(C-6’),130.8(C-1’),144.6(C-3’),144.7(C-4’),155.7(C-8a),156.2(C-5),156.7(C-7);ESIMS m/z 288[M-H]-。通过波谱解析并与文献对比[9],确定其为表儿茶素。
如图1所示。

图1 葡萄籽提取物经活性追踪分离获得的4种多酚类化合物结构Fig.1 Chemicalstructures of the 4 polyphenol compounds isolated from GSE with bioactivity guide
2.2 葡萄籽提取物不同极性部分的抑菌活性
葡萄籽提取物经大孔吸附树脂柱分离后,水洗部分(PA-1)对所测试的3个菌种的最小抑制质量浓度分别为0.5 mg/mL(变异链球菌)、2 mg/mL(戈登链球菌)和0.25 mg/mL(具核链球菌),相对于其它醇洗部分具有较好的抑菌活性(见表1)。由此可以推测葡萄籽提取物中的极性较大,在大孔吸附树脂柱上容易被水洗脱的化合物(初步推断为多酚类化合物)具有良好的抑制致龋病菌和牙周病菌的作用。
2.3 大极性部分中不同分子量部分的抑菌活性
将PA-1部分于葡聚糖凝胶色谱柱上进行进一步的分离后,对所获得的组分进行了抑菌活性测定。结果表明,洗脱流分PA-1-11对所测试的3个菌种具有较好的抑制活性,最小抑制质量浓度分别为 0.125 mg/mL(变异链球菌)、0.25 mg/mL(戈登链球菌)和 0.031 25 mg/mL(具核梭杆菌)(见表 2)。 由于葡聚糖凝胶色谱柱主要是依照分子量大小进行分离的,因此可以推测产生较好抑菌效果的并非具有较大分子量的花青素类化合物,而是一些小分子多酚类化合物,这也与法国学者的研究结果相一致[7]。

表1 PA-1~PA-6对3种口腔致病菌的最小抑制浓度 mg/mLTable 1 MIC of fraction PA-1 to PA-6 against 3 kinds of periodontitis or cariogenic bacterial
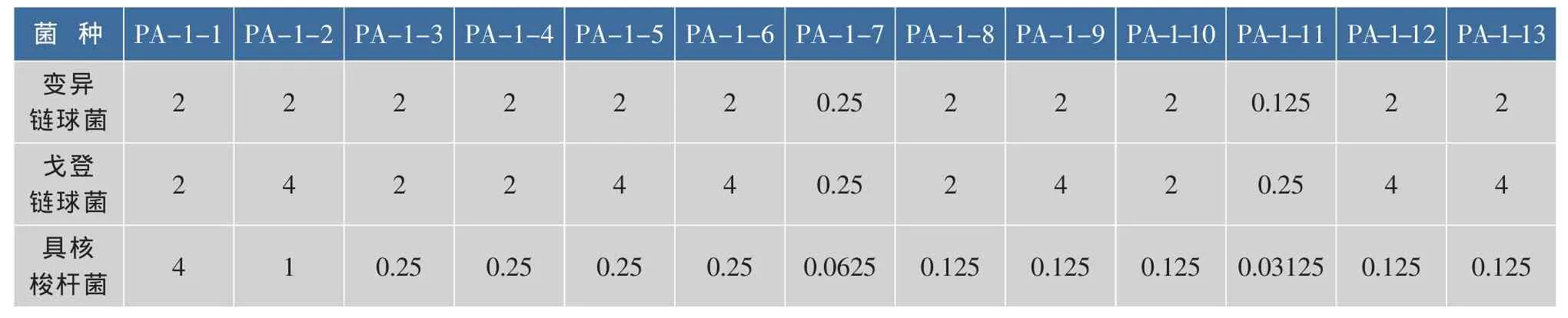
表2 PA-1-1~PA-1-13对三种口腔致病菌的最小抑制浓度 mg/mLTable 2 MIC of fraction PA-1-1 to PA-1-13 against 3 kinds of periodontitis or cariogenic bacterial
2.4 几种小分子多酚类化合物的抑菌活性
根据上述活性测试的结果,对抑菌活性较强的PA-1-7、PA-1-10、PA-1-11 和 PA-1-12 进行了进一步硅胶柱色谱的分离,获得化合物1~4,并测定了它们对致龋病菌和牙周病菌的最小抑制质量浓度(表3)。由结果可知,化合物2,即邻苯三酚,对致龋病菌和牙周病菌的抑制作用最强,其次是化合物1(没食子酸)。这两个化合物均含有3个邻位酚羟基,提示这一结构对于口腔致病菌的抑制作用最强,而羧基的引入(化合物1)不仅没有增加抑菌活性,反而有所减弱。化合物3仅含有2个邻位酚羟基,并具有羧基,其抑菌作用大大降低。化合物4(表儿茶素)作为花青素类化合物的基本结构单元,对牙周病菌具有一定的抑制活性,但对致龋病菌作用较弱,进一步证实了花青素类成分抗菌活性较差的推断。

表3 化合物1~4对三种口腔致病菌的最小抑制浓度Table 3 MIC (mg/mL) of comp.1-4 against 3 kinds of periodontitis or cariogenic bacterial mg/mL
3 结语
综上所述,可以推断葡萄籽提取物对于保护口腔健康是非常有利的,而其中能够抑制致龋病菌和牙周病菌的化学成分并非抗氧化活性较好的且具有较高聚合度的花青素类化合物,而是其低聚物、单体或分子量更小的多酚类化合物,其中以含有邻苯三酚结构的化合物抑菌活性最佳,当酚羟基减少或结构中增加羧基时,抑菌活性降低,其中酚羟基数目的影响大于羧基的影响。
[1]Market view.Antioxidant foodstuffs[J].Nikkei Bio-business,2001(11):129-130.
[2]Ammar E M,Said S A,El-Damarawy S L,et al.Cardioprotective effect of grape-seed proanthocyanidins on doxorubicin-induced cardiac toxicity in rats[J].Pharm Biol,2013,51:339-344.
[3]Gollucke A P B,Aguiar O,Barbisan L F,et al.Use of grape polyphenols against carcinogenesis:putative molecular mechanisms of action using in vitro and in vivo test systems[J].J Med Food,2013,16:199-205.
[4]Yamakoshi J,Saito M,Kataoka S,et al.Procyanidin-rich extract from grape seeds prevents cataract formation in hereditary cataractous (ICR/f) rats[J].J Agric Food Chem,2002,50:4983-4988.
[5]吴嘉慧,袁春龙,宋洋波.葡萄籽功能性成分及其应用[J].日用化学工业,2011,41:216-228.WU Jia-hui,YUAN Chun-long,SONG Yang-bo.Functional components of grape seed and its application[J].China Surfactant Detergent&Cosmetics,2011,41:216-228.(in Chinese)
[6]彭亮,傅伟忠,姚思宇,等.葡萄籽粉对自然衰老大鼠的抗氧化作用研究[J].中国卫生检验杂志,2012,22:2376-2378.PENG Liang,FU Wei-zhong,YAO Si-yu,et al.Study on the antioxidant effect of grape seed powder in natural aging rats[J].Chinese Journal of Health Laboratory Technology,2012,22:2376-2378.(in Chinese)
[7]Jolivet-Gougeon A,Sixou Jean-Louis,Tamanai-Shacoori Z,et al.Antimicrobial treatment of capnocytophaga infections[J].International Journal of Antimicrobial Agents,2007,29:367-73.
[8]Haddock E A,Gupta R K,Al-Shafi S M K,et al.The metabolism of gallic acid and hexahydroxydiphenic acid in plants:biogenetic and molecular taxonomic considerations[J].Phytochemistry,1982(5):1049-1062.
[9]Richard F C,Goupy P M,Nicolas J J,et al.Cysteine as an inhibitor of enzymatic browning 1 Isolation and characterization of addition-compounds formed during oxidation of phenolics by apple polyphenol oxidase[J].J Agric Food Chem,1991,39:841-847.

