皮下注射标准化屋尘螨变应原疫苗治疗支气管哮喘和(或)变应性鼻炎的速发不良反应
曾雪妮,李 靖,鲜 墨,黄夏飞,潘 瑶,符始艳
(呼吸疾病国家重点实验室 广州医科大学附属第一医院变态反应科,510120)
支气管哮喘和变应性鼻炎是呼吸系统的特应性疾病,Li等[1]调查我国4个地区哮喘和(或)鼻炎的变态反应情况显示,50%以上哮喘和鼻炎患者有明确变应原,其中以屋尘螨和粉尘螨最多见。对于变态反应性疾病的治疗,避免接触变应原是最有效的方法[2];然而,要完全避免室内变应原如尘螨常难以做到。虽然药物治疗能有效控制呼吸系统变态反应性疾病的症状,但停药后易复发。
变应原特异性免疫治疗(allergen specific immunotherapy,ASIT)是目前唯一能改变变态反应性疾病自然病程的疗法[3]。国内外均有报道证实,ASIT对变应原为屋尘螨、粉尘螨的哮喘及变应性鼻炎患者有效[4-5]。但是,在应用皮下注射变应原提取液进行ASIT时,可能发生严重变态反应。Bernstein等[6]于2004年发表的回顾性分析显示,1990至2001年SCIT致命性不良反应发生率为1/250万针次,平均每年死亡人数为3.4人。ASIT的安全性医务人员及患者首要考虑的问题。我国关于应用标准化屋尘螨提取液免疫治疗不良反应的报道虽不少见,但涉及较大样本量及较全面分析因素的并不多见。本文通过分析广州医科大学附属第一医院患者在接受屋尘螨皮下特异性免疫治疗(subcutaneous specific immunotherapy,SCIT)过程中发生的不良反应及影响因素探讨SCIT不良反应的发生规律,以避免严重不良反应。
对象和方法
对象
收集2004年11月至2012年5月广州医科大学附属第一医院变态反应科接受标准化屋尘螨SCIT者,所有患者均符合支气管哮喘和(或)变应性鼻炎诊断标准[7-8],均为轻中度哮喘和(或)中重度变应性鼻炎,正在接受规范化药物治疗且病情稳定。所有患者经过变应原皮肤点刺试验和血清特异性IgE(specific IgE,sIgE)检测确诊屋尘螨为变应原。血清sIgE分级标准:0级为<0.35 kUA/L,1级为0.35~0.7 kUA/L,2级为0.7~3.5 kUA/L,3级为3.5~17.5 kUA/L,4级为17.5~50 kUA/L,5级为50~100 kUA/L,6级为>100 kUA/L。总IgE正常参考值为<113 kUA/L。
所有患者在接受SCIT前均已签署知情同意书。
方法
标准化屋尘螨变应原疫苗为丹麦ALK公司生产,治疗剂量方案见参考文献[9]。即应用标准化屋尘螨变应原提取液在上臂远端1/3外侧行皮下注射,左右上臂轮流注射,注射剂量从20 U起始,初始治疗阶段按以下方案每周递增剂量:20、40、80、200、400、800、2 000、4 000、8 000、10 000、20 000、40 000、60 000、80 000、100 000 U,共计15周15次注射。达到高峰维持剂量即100 000 U,之后每隔2、4、6周各注射1次,然后进行维持剂量注射,维持剂量每6周注射1次,每次注射100 000 U。注射剂量分为3个阶段:低剂量上升阶段(20~800 SQU),剂量快速上升阶段(2000~80000 SQU),维持阶段(100000 SQU)。
不良反应记录
每次皮下注射前,护士对患者进行病情评估,详细询问前次注射后反应及近3d的身体状况,确定患者最高呼气峰流速值(peak expiratory flow,PEF)(80%最佳值后再行皮下注射。注射后30 min内密切观察患者情况,及时记录其出现的局部(注射部位红晕、肿胀、硬结、风团等)与全身不良反应(远离注射部位的皮肤反应、哮喘和鼻炎症状的发作、心血管系统及胃肠道反应等)。全身不良反应分级由护士及医师依据欧洲变态反应和临床免疫学会(European Academy of Allergy and Clinical Immunology,EAACI)标准评估后共同决定。
不良反应评定标准
速发不良反应包括速发局部不良反应和速发全身不良反应,速发局部不良反应指皮下注射变应原疫苗后30 min内在注射部位出现的红晕、瘙痒、肿胀等;速发全身不良反应指皮下注射变应原疫苗后30 min内在远离注射部位出现的不良反应[10]。
按照EAACI标准[11],速发全身不良反应分为4级,即Ⅰ级(轻度全身不良反应):局部荨麻疹、鼻炎或轻度哮喘(PEF自基线下降<20%);Ⅱ级(中度全身不良反应):发生缓慢(>15 min)的泛发荨麻疹和(或)中度哮喘(PEF自基线下降<40%);Ⅲ级(重度非致命性全身不良反应):快速发生(<15 min)的泛发荨麻疹、血管性水肿或严重哮喘(PEF自基线下降>40%);Ⅳ级(过敏性休克):立刻发生的瘙痒、潮红、红斑、泛发性荨麻疹,喘鸣(血管性水肿),速发型哮喘,低血压等。
统计学处理
应用SPSS 13.0软件进行数据处理和统计分析。组间总IgE比较采用t检验,不良反应发生率比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
基本情况
共纳入患者462例,共接受皮下注射15645次。其中男283例,女179例,中位年龄为13岁。儿童(≤14岁)246例,成人(>14岁)216例(表1)。
速发不良反应发生情况
452例(452/462,97.8%)发生了8523次(8523/15645,54.5%)速发局部不良反应,153例(153/462,33.1%)发生397次(397/15645,2.5%)速发全身不良反应。速发全身不良反应中Ⅰ级142例(142/153,92.8%)343针次(343/397,86.4%),Ⅱ级31例(31/153,20.3%)44针次(44/397,11.1%),Ⅲ级10例(10/153,6.5%)10针次(10/397,2.5%),无Ⅳ级速发全身不良反应发生。10例患者发生的10针次Ⅲ级速发全身不良反应均在对症处理后很快缓解。
速发局部不良反应以红晕、肿胀、硬结和风团为主,发生率分别为38.4%、13.9%、0.8%和28.9%。速发全身不良反应主要表现为哮喘发作(喘息、咳嗽、胸闷气短或咽喉不适),发生率为1.6%;其次为鼻、眼结膜症状(喷嚏、流涕、眼红、流泪等),发生率为0.2%;再次为皮疹及皮肤瘙痒等,发生率为0.3%;仅表现为PEF下降而无任何症状的发生率为0.1%。
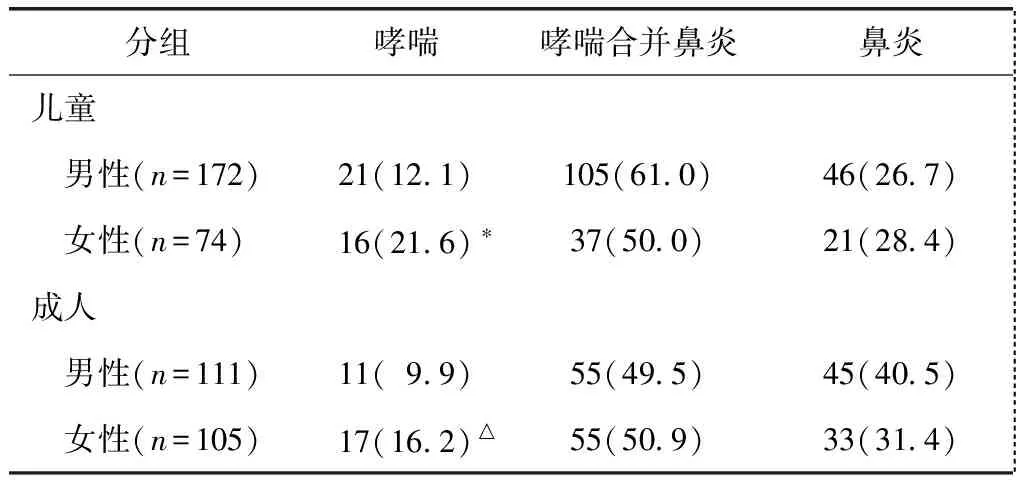
表1 患者基本情况Table 1 Basic condition of the patients [n(%)]
与男性儿童哮喘患者比较,*P=0.123;与男性成人哮喘患者比较,△P=0.227
注射剂量与速发不良反应
各次注射剂量不良反应发生分布情况:速发局部不良反应发生率随剂量增高而增加,速发全身不良反应在各注射剂量组中均出现,主要出现在剂量快速上升阶段(图1)。速发全身不良反应以Ⅰ级为主,Ⅱ级及以上主要出现在20000 SQU以上高剂量阶段,而在维持剂量阶段有所下降(图2)。
低剂量上升阶段、剂量快速上升阶段、维持阶段速发局部不良反应率分别为18.3%、54.9%、67.6%(χ2=2012.57,P<0.001),速发全身不良反应率分别为0.4%、3.9%、1.8%(χ2=113.75,P<0.001)。
疾病种类与速发不良反应
全部246例儿童患者共注射8355针次,其中哮喘37例(15.1%)共注射1311针次(15.7%),鼻炎67例(27.2%)共注射2030针次(24.3%),哮喘合并鼻炎142例(57.7%)共注射5014针次(60%)。按注射针次比较,哮喘合并鼻炎患儿速发局部不良反应发生率高于单纯哮喘和单纯鼻炎患儿(均P<0.001),速发全身不良反应发生率则只有哮喘合并鼻炎患儿与单纯鼻炎患儿比较差异有统计学意义(P=0.002)(表2)。
全部216例成人患者共注射7290针次,哮喘28例(13.0%)共注射1080针次(14.8%),鼻炎78例(36.1%)共注射2458针次(33.7%),哮喘合并鼻炎110例(50.9%)共注射3752针次(51.5%)。按注射针次比较,单纯哮喘、单纯鼻炎及哮喘合并鼻炎患者间速发局部不良反应发生率差异均有统计学意义(均P<0.001)且以单纯哮喘患者最高,三者速发全身不良反应发生率差异亦均有统计学意义(均P<0.001)且以单纯哮喘最高、鼻炎最低(表2)。
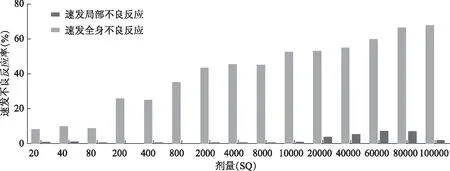
图1 速发不良反应在各剂量组分布Fig 1 Immediate adverse reactions in different dose groups
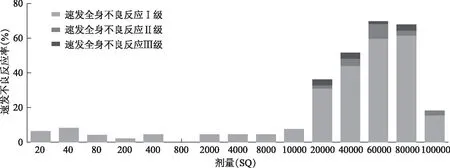
图2 速发全身不良反应不同级别在各剂量组分布Fig 2 Immediate adverse reactions in different dose groups
性别与速发不良反应
全部283例男性患者共注射9400针次,其中儿童172例共注射5888针次,成人111例共注射3512针次;179例女性共注射6245针次,其中儿童74例共注射2467针次,成人105次共注射3778次。儿童患者中,男性速发局部不良反应率(以针次计算)及速发全身不良反应率(以病例数和针次计算)均高于女性(均P<0.01)。成人患者中,女性速发局部不良反应率(以针次计算)还是速发全身不良反应率(以病例数和针次计算)均高于男性(均P<0.01)。不分年龄比较,女性患者速发局部不良反应率(以针次计算)高于男性(P<0.01)(表3)。
屋尘螨sIgE与速发不良反应
2~6级屋尘螨sIgE的速发局部不良反应发生率(以针次计算)分别为35.9%、43.9%、56.4%、62.9%、60.2%(χ2=330.24,P<0.001);
速发全身不良反应的发生率(以针次计算)分别为0.3%、1.3%、1.5%、2.4%、4.0%(χ2=75.36,P<0.001)
治疗前总IgE与速发全身不良反应
出现速发全身不良反应者治疗前总IgE值为(634.24±883.91) U/ml,未出现速发全身不良反应者治疗前总IgE值为(416.60±438.59) U/ml,两者差异有统计学意义(t=2.008,P=0.048)
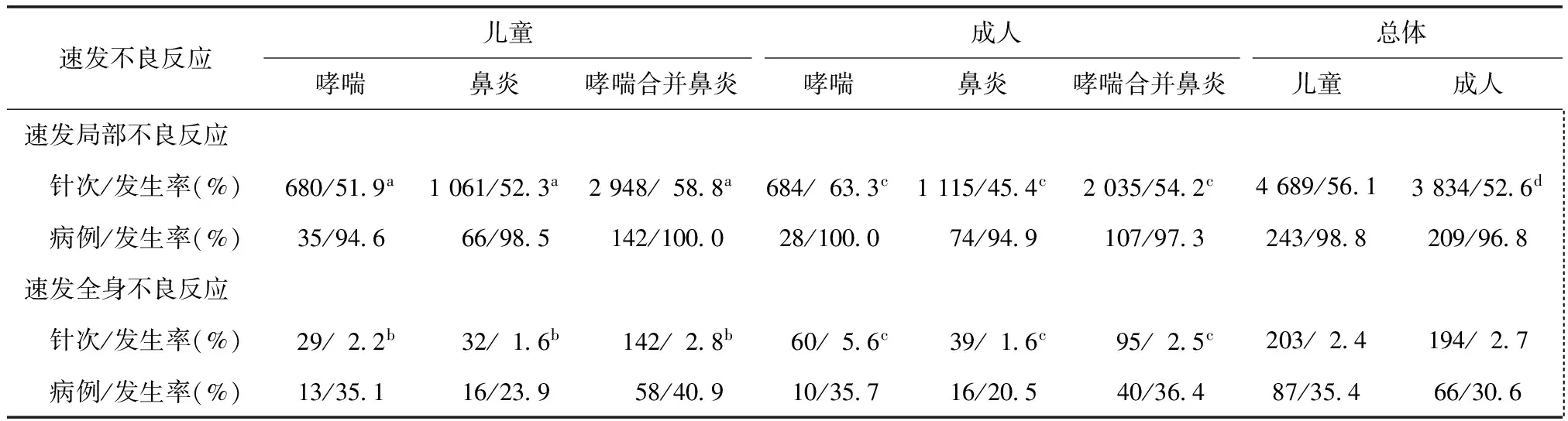
表2 疾病种类与速发不良反应的相关性Table 2 The relationship between diagnoses and immediate adverse reactions
a三者比较P<0.001;b三者比较P<0.01;c三者比较P<0.001;与儿童患者比较,dP<0.001
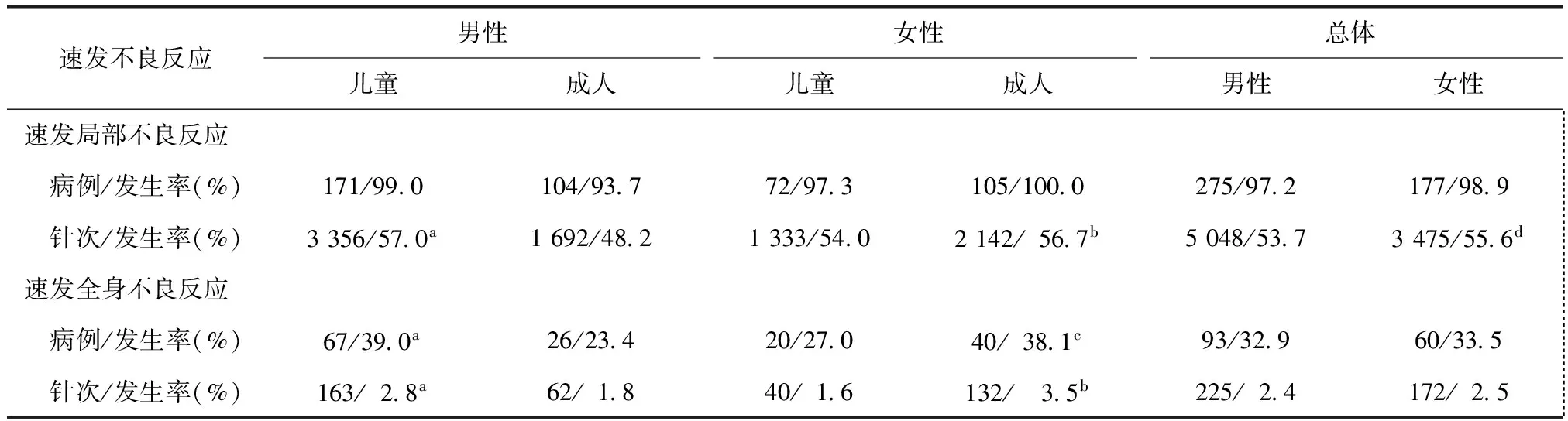
表3 性别与速发不良反应的相关性Table 3 The relationship between gender and immediate adverse reactions
与女性儿童患者比较,aP<0.01;与男性成人患者比较,bP<0.001;与男性成人患者比较,cP<0.01;与总体男性患者比较,dP<0.01
讨 论
国内已有应用标准化屋尘螨变应原疫苗(安脱达)治疗哮喘和变应性鼻炎的不良反应相关研究,谢青和吴宇霖[12]及邱晓梅等[13]都曾报道局部不良反应率(以病例数计算)高达100%。邱晓梅等[13]认为,轻度局部不良反应是皮下注射的必然结果。上述两项研究的速发全身不良反应率(以病例数计算)分别为15.3%、18.64%,均低于本文研究结果。郝创利等[9]报道的总体不良反应率不到70%,局部不良反应率(以针次计算)仅为12.48%;而其速发全身不良反应率(以针次计算)却高于本文结果,为3.39%。这可能与患者的选择和不良反应记录的方法有关,邱晓梅等[13]和郝创利等[9]收入患者皆为儿童,且郝创利等[9]的纳入标准中第1秒用力呼出量(forced expiratory volume in one second,FEV1)占预计值百分比(FEV1%)必须达80%以上,谢青和吴宇霖[11]的研究中记录不良反应发生率不仅由安脱达引起,还包括阿罗格引起的不良反应。
在进行不同疾病的速发不良反应比较时,为了避免年龄和病程等因素的干扰,本研究将儿童和成人患者分别比较,结果提示单纯哮喘或鼻炎合并哮喘的速发不良反应率更高,这与国内外报道一致[14-15]。在分析性别对速发不良反应的影响时,发现总体上只表现出女性的速发局部不良反应的针次率稍高;将儿童及成人患者分别比较后提示,年龄间的差异只表现为局部不良反应的轻微差异,而在性别间的差异表现得非常明显,即男性患儿无论是速发局部不良反应还是速发全身不良反应都显著高于女性患儿,成人患者则表现为女性速发局部不良反应和全身不良反应显著高于男性。这可能与不同年龄的疾病特别是哮喘在性别间分布有关。从患者的基本情况可以看到,虽然儿童患者及成人患者疾病在性别间分布差异无统计学意义,但男性患儿哮喘合并鼻炎发生率(61.0%)明显高于女性(50.0%);而在成人患者中,女性哮喘及哮喘合并鼻炎发生率(16.2%、50.9%)高于男性(9.9%、49.5%)。已有研究证实,哮喘是引起特异性免疫治疗不良反应发生率增高的独立危险因素[16],且儿童在存在鼻炎的情况下,哮喘症状会更严重[17]。
本研究同时分析了治疗前屋尘螨sIgE及总IgE水平对速发不良反应的影响,发现速发局部不良反应和全身不良反应发生率均随着屋尘螨sIgE级别增高呈整体上升趋势。另外,在注射过程中发生速发全身不良反应者治疗前总IgE水平明显高于未发生速发全身不良反应者,提示总IgE对速发全身不良反应的发生亦有影响。邱晓梅等[13]也报道了相似的结果,体内试验(皮肤点刺试验)可反应机体的免疫状态强度,且与sIgE呈正相关[18],而屋尘螨变应原皮肤反应指数程度与哮喘的严重程度相关[1],可能是导致屋尘螨sIgE高水平时更易引起不良反应的原因。总IgE水平虽不能直接反应sIgE水平,但随着总IgE水平的增高,sIgE水平也有增高的趋势[19],且本试验纳入患者大部分存在多种环境吸入性变应原过敏,变应原间存在广泛的交叉反应,这可能是总IgE在较高水平时更易引起速发不良反应的原因。另外,各剂量间不良反应发生率的分布提示,速发局部不良反应随剂量增加而增多,维持剂量时发生率最高;速发全身不良发应在最低剂量时存在发生可能,并也随剂量增高出现增多趋势,但其最高发生率出现在剂量快速递增阶段,这结果与郝创利等[9]的分析一致。因此,在进行皮下特异性免疫治疗的过程中,即使使用最低剂量也要密切注意患者情况。
对变应原为屋尘螨的哮喘和(或)变应性鼻炎患者进行标准化屋尘螨变应原特异性免疫治疗时,速发局部不良反应常见,而速发全身不良反应少见。单纯哮喘和鼻炎合并哮喘、男性患儿、成年女性及屋尘螨sIgE和总IgE水平较高者时,速发不良反应发生率增高,且随注射变应原剂量递增其存在增高趋势,在剂量快速上升阶段应警惕严重不良反应的发生。
[1]Li J, Sun B, Huang Y, et al. A multicenter study assessing the prevalence of sensitizations in patients with asthma and/or rninitis in China[J].Allergy, 2009, 64:1083-1092.
[2]Chan-Yeung M, Dimich-Wand H, Becker A. Atopy in early life and effect of a primary prevention program for asthma in a high risk cohort[J].J Allergy Clin Immunol, 2007, 120:1221-1223.
[3]WHO. Position Paper Allergen immunotherapy:therapeutic vaccines for allergic diseases, Geneva:January 27-29 1997[J].Allergy, 1998, 53:1-42.
[4]Zuberbier T, Bachert C, Bousquet PJ, et al. GA2LEN/EAACI pocket guide for allergen-specific immunotherapy for allergic rhinitis and asthma[J].Allergy, 2010, 65:1525-1530.
[5]Wang H, Lin X, Hao C, et al. A double-blind,placebo-controlled study of house dust mite in Chinese asthmatic patients[J].Allergy, 2006, 61:191-197.
[6]Bernstein DI, Wanner M, Borish L, et al. Twelve-year survey of fatal reactions to allergen injections and skin testing:1990-2001[J].J Allergy Clin Immunol, 2004, 113:1129-1136.
[7]中华医学会呼吸病学会哮喘分组. 支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗及教育和管理方案)[J].中华结核和呼吸杂志, 2003, 26:132-201.
[8]中华耳鼻咽喉头颈外科杂志编辑委员会, 中华医学会耳鼻咽喉科分会. 变应性鼻炎的诊治原则和推荐方案(2004年,兰州)[J].中华耳鼻咽喉头颈外科杂志, 2005, 40:166-167.
[9]郝创利, 陶慧, 沈美菊, 等. 标准化屋尘螨提取液治疗儿童支气管哮喘的安全性研究[J].国际呼吸杂志, 2008, 28:1413-1416.
[10] Cox L,Nelson H, Lockey R, et al. Allergen immunotherapy:A practice parameter third update[J].J Allergy Clin Immunol,2011,127:1-55.
[11] Alvarez-Cuesta E, Bousquet J, Canonica GW, et al. Standards for practical allergen-specific immunotherapy[J].Allergy, 2006, 61:1-20.
[12] 谢青, 吴宇霖. 健康教育在特异性免疫治疗提高安全性和依从性的运用[J].实用临床医药杂志, 2011, 15:51-52.
[13] 邱晓梅, 罗芳, 李孟荣, 等. 哮喘、变应性鼻炎59例对哮喘变应原特异性免疫治疗的耐受性和不良反应[J].实用儿科临床杂志, 2008, 23:657-659.
[14] Copenhaver CC, Parker A, Patch S. Systemic reaction with aeroallergen cluster immunotherapy in a clinical practice[J].Ann Allergy Asthma Immunol, 2011, 107:441-447.
[15] 王成硕, 张罗, 韩德民, 等. 标准化尘螨变应原疫苗治疗变应性鼻炎一年的疗效和安全性研究[J].中国耳鼻喉头颈外科杂志, 2007, 14:003-007.
[16] lglesias-Cadarso A, Hernández-Weigand P. Risk factors for systemic reactions to allergen immunotherapy[J].Curr Opin Allergy Clin Immunol, 2011, 11:579-585.
[17] Ruokonen M, Kaila M, Haataja R, et al. Allergic rhinitis in school-aged children with asthma-still under-dignosed and undertreated? A retrospective study in a children’s hospital[J].Pediatr Allergy Immunol, 2010, 21:149-154.
[18] 谢庆玲, 甄宏, 胡琼燕, 等. 变应性疾病患儿皮肤变应原试验与血清尘螨特异性IgE及IgG4水平的关系[J].实用儿科临床杂志, 2010, 25:240-242.
[19] 孙宝清, 韦妮莉, 王红玉, 等. 呼吸道过敏性疾病患者血清总抗体E检测及意义[J].中国公共卫生, 2008, 24:103-104.

