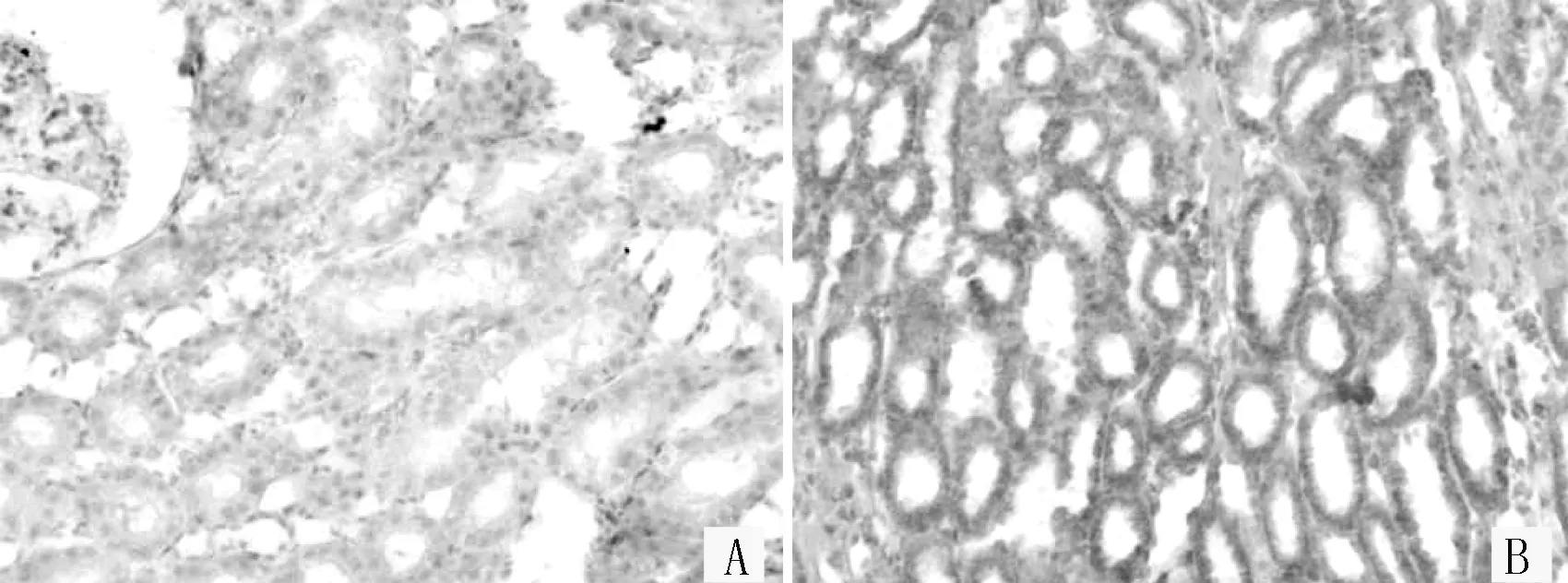
单核细胞趋化蛋白-1和转化生长因子β1及结缔组织生长因子在2型糖尿病肾病大鼠肾组织中的表达
张亚莉,冯 婕,姜莎莎,李 燕,孙吉平,王慧芳,于琳华,郭尚武
糖尿病是最常见的慢性病之一,已成为严重的公共卫生问题[1]。随着社会经济的持续发展和人口的老龄化,我国糖尿病患病率近年来呈急剧升高趋势,已成为糖尿病第一大国,且发病年龄趋于年轻化[2]。糖尿病肾病是糖尿病的严重慢性并发症之一,严重危害着人类的健康及生命。最近有学者提出把糖尿病肾病看作是一种由代谢和免疫联系起来的炎症性疾病,在其发病过程中有很多细胞因子及炎性因子参与。笔者前期研究发现,环磷酰胺能够减轻2型糖尿病肾病大鼠的蛋白尿及肾功能损害,并能使病理改变减轻,对糖尿病肾病具有保护作用[3]。本研究通过观察单核细胞趋化因子-1(MCP-1)、转化生长因子β1(TGF-β1)及结缔组织生长因子(CTGF)在2型糖尿病肾病大鼠肾组织中的表达,了解早期糖尿病肾病发病过程中的炎症反应及纤维化情况。
1 材料与方法
1.1实验动物及试剂刚断乳的3周龄SD雄性SPF级大鼠35只,体质量35~55 g,由西安交通大学医学院动物实验中心提供。链脲佐菌素(STZ)由美国Sigma化学公司生产,兔抗大鼠MCP-1、TGF-β1、CTGF由武汉博士德生物工程有限公司生产,二步法免疫组化检测试剂由北京中杉金桥生物技术有限公司生产。各项实验室指标的检测均由我院中心实验室完成。
1.2分组将35只大鼠适应性喂养1周,监测血糖均正常。采用随机数字表法将大鼠分为对照组14只和糖尿病肾病组21只。对照组大鼠体质量为(45.5±6.1)g,糖尿病肾病组为(49.0±4.8)g,差异无统计学意义(t=-1.550,P>0.05)。
1.3糖尿病肾病动物模型的建立对照组大鼠每日给予常规饲料,糖尿病肾病组大鼠每日给予高脂饲料,两组大鼠自由进食和饮水。8周后,采用单纯随机抽样方法从两组中各抽取6只大鼠,进行葡萄糖耐量试验(OGTT)和同步胰岛素释放试验,计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=空腹血糖(FBG)×对应的空腹胰岛素(FINS)/22.5[4]。第10周末,证实糖尿病肾病组大鼠存在胰岛素抵抗后,两组大鼠禁食不禁水12 h,糖尿病肾病组大鼠一次性腹腔注射STZ,35 mg/kg,对照组大鼠腹腔注射等量柠檬酸-柠檬酸钠缓冲液[5-6]。给予STZ后3 d、7 d、14 d分别行尾静脉采血检测随机血糖,以随机血糖>15.7 mmol/L为糖尿病模型制备成功[6]。糖尿病肾病组中共18只大鼠成模,3只未成模者舍弃。第12周末,将两组大鼠分别置于代谢笼中,收集尿液,检测24 h尿蛋白定量,经统计学分析证明糖尿病肾病组大鼠24 h尿蛋白定量较对照组高,且注射STZ后较注射前高,说明糖尿病肾病动物模型制备成功(糖尿病肾病模型组共制备成功18只大鼠),之后两组大鼠均常规饲料喂养。
1.4标本收集第17周末,将两组大鼠分别放入代谢笼中,收集24 h尿液并检测24 h尿蛋白定量。大鼠称体质量后,腹腔注射10%水合氯醛(0.3 ml/100 g)麻醉,心尖部取血,离心分离血清,检测尿素氮(BUN)、血肌酐(Scr)水平。4 ℃的0.9%氯化钠溶液原位灌洗后迅速摘除左侧肾脏,去除包膜,0.9%氯化钠溶液冲洗后称肾重,将肾标本切成1.0 cm×0.5 cm×0.5 cm大小组织块,10%甲醛固定,石蜡包埋,常规连续切片,进行普通肾脏病理学染色,采用免疫组织化学法检测肾组织中MCP-1、TGF-β1、CTGF的表达,采用Image-Pro Plus Version 6.0彩色图像分析处理软件进行图像半定量分析,计算平均吸光度,平均吸光度=各视野下阳性吸光度(IA)/阳性面积(Area)。
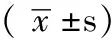
2 结果
2.1HOMA-IR对照组HOMA-IR为(4.75±1.00),糖尿病肾病组为(6.18±0.82),差异有统计学意义(t=-2.698,P<0.05)。两组大鼠0 min、30 min、60 min、120 min血糖水平比较,差异均无统计学意义(P>0.05);0 min、30 min、60 min、120 min胰岛素水平比较,差异均有统计学意义(P<0.05,见表1)。
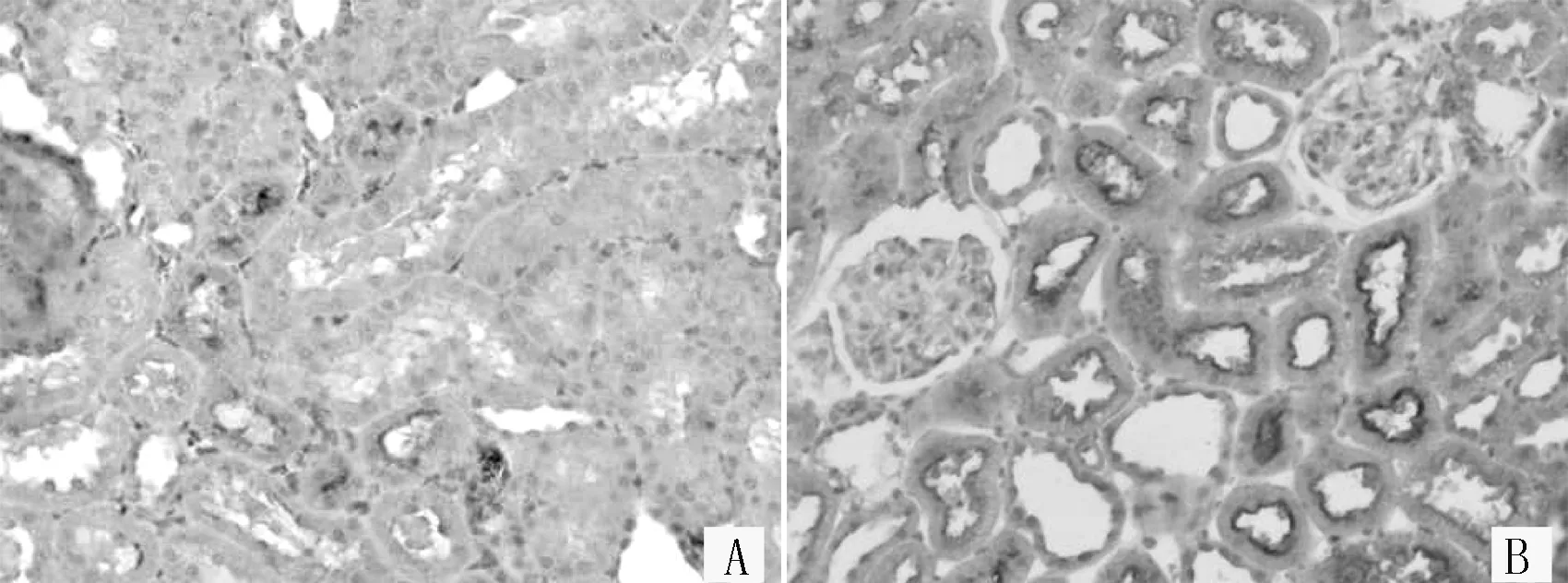
2.224 h尿蛋白定量及血糖两组大鼠注射STZ前24 h尿蛋白定量比较,差异无统计学意义(P>0.05),注射第14天比较,差异有统计学意义(P<0.01)。重复测量的方差分析结果显示,注射STZ后3、7、14 d两组血糖水平比较,差异有统计学意义(P<0.01,见表2)。
2.3免疫组织化学对照组大鼠肾小管可见少量MCP-1表达,着色较浅(见图1A);糖尿病肾病组大鼠肾皮质近端肾小管刷状缘可见MCP-1表达,着色较深(见图1B)。对照组大鼠未见TGF-β1表达(见图2A);糖尿病肾病组大鼠集合管、远端小管、近端小管细胞质TGF-β1表达明显增强(见图2B)。对照组大鼠集合管、远端小管、近端小管细胞质表达少量CTGF,着色较浅(见图3A);糖尿病肾病组大鼠上述部位CTGF表明显增强,着色较深(图3B)。
注:A为对照组,B为糖尿病肾病组

图1 两组大鼠肾组织MCP-1的表达(免疫组织化学法,×400)
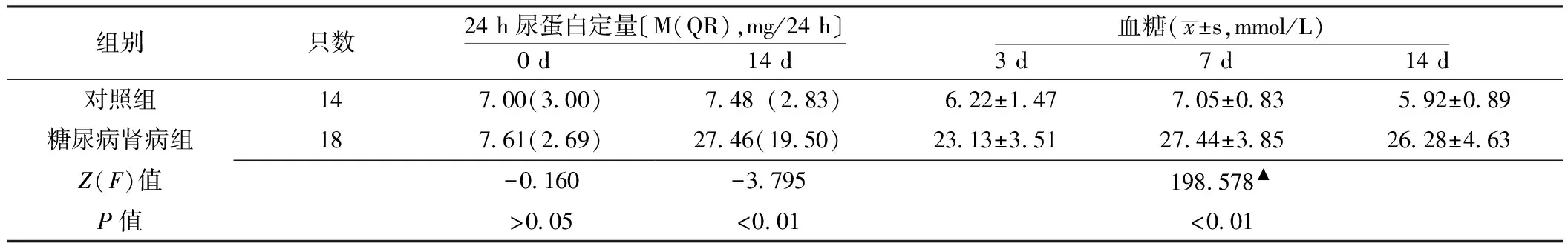
表2 两组大鼠24 h尿蛋白定量和血糖比较
注:▲为F值
注:A为对照组,B为糖尿病肾病组
图2两组大鼠肾组织TGF-β1的表达(免疫组织化学法,×400)
Figure2Expression of TGF-β1in renal tissue of the two groups
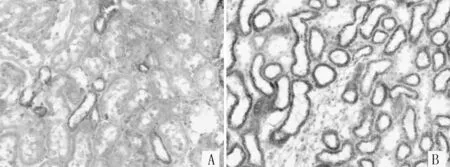
注:A为对照组,B为糖尿病肾病组
图3两组大鼠肾组织CTGF的表达(免疫组织化学法,×400)
Figure3Expression of CTGF in renal tissue of the two groups
2.4半定量分析两组大鼠肾组织MCP-1、TGF-β1、CTGF平均吸光度比较,差异均有统计学意义(P<0.05,见表3)。

Table3Comparison of mean absorbance of MCP-1,TGF-β1and CTGF in renal tissue between the two groups
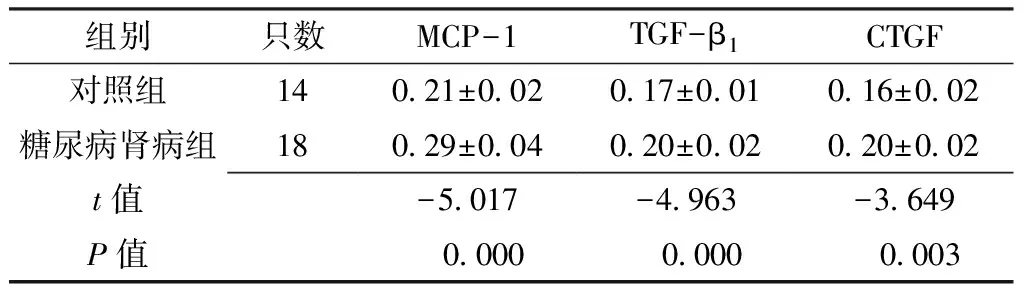
组别只数MCP-1TGF-β1CTGF对照组14021±002017±001016±002糖尿病肾病组18029±004020±002020±002t值-5017-4963-3649P值 0000 0000 0003
注:MCP-1=单核细胞趋化蛋白-1,TGF-β1=转化生长因子β1,CTGF=结缔组织生长因子
3 讨论
糖尿病是一种全球性疾病,其发病率呈现显著上升趋势[7-8],中国已经成为全球糖尿病第一大国[1]。糖尿病是一种严重的慢性、进展性疾病,严重地危害着人类的健康。糖尿病肾病已成为终末期肾病的主要原因,中国人群终末期肾病发生率高[8-9]。糖尿病肾病的发病机制比较复杂,近几年炎症学说备受关注,已经证明糖基化作用、生长因子/细胞因子、血流动力学改变等均参与糖尿病肾病的发病[10-12],有学者提出把糖尿病肾病看作是一种由代谢和免疫联系起来的炎症性疾病。细胞因子MCP-1、TGF-β1、CTGF与人类很多疾病的发生有关,特别是免疫相关性疾病,但有关其在肾脏组织中表达部位及强度的研究报道较少。
单核细胞趋化蛋白(MCPs)是一系列结构相似、具有趋化功能的细胞因子,属于趋化因子的CC亚族(β亚族)。MCP-1是CC亚族趋化性细胞因子中的重要成员。单核-巨噬细胞、成纤维细胞、肾小管上皮细胞均能产生和分泌MCP-1,MCP-1能够吸附、趋化单核细胞而对中性粒细胞无作用[13],同时可活化并促使肾小球上皮细胞、血管平滑肌细胞产生炎性因子,进一步放大肾间质炎症反应[14]。MCP-1与CCR2在炎症反应、新生血管生成、损伤修复中均有重要作用,MCP-1对CCR2的高亲和力可用于检测亚急性和慢性炎症损害[13-15]。
TGF-β1首次于1972年被报道,目前报道有6种TGF-β分子,其中TGF-β1是目前研究最多的与疾病相关的分子,其具有广泛的功能,在肿瘤[16]、脏器纤维化、创伤修复、炎症性疾病及自身免疫性疾病[17]等的发生中具有重要意义,是重要的介导细胞对组织损伤的强效的致纤维化因子。在病理情况下,TGF-β1通过其免疫抑制机制,损伤机体的免疫监督机制,使机体失去对自我抗原、外来抗原的正常免疫应答,从而导致疾病的发生[18-20]。研究表明,TGF-β1可以诱导肾小管上皮细胞的自我吞噬并促进肾小管上皮细胞的凋亡,进而引起肾小管损伤[21-22]。
CTGF是一种富含半胱氨酸的分泌性多肽,是CCN家族成员之一,可能是TGF-β1下游信号递质,能刺激细胞增殖和细胞外基质的形成,并在组织纤维化中起重要作用[23-24]。
本研究采用STZ诱发2型糖尿病肾病大鼠模型,造模成功后处死大鼠,解剖大鼠进行肾脏病理学染色,并用免疫组织化学的方法检测其肾组织中MCP-1、TGF-β1、CTGF的表达。在光镜下可观察到3种因子在糖尿病肾病组大鼠的肾小管上皮细胞的胞质中均有较强的表达,肾小球内无表达,而对照组无表达或有极少量的表达,与文献报道一致[25]。分析其原因可能与这3个细胞因子主要的功能是参与肾脏的纤维化、肾脏间质较肾小球易出现纤维化有关,但本研究观察时间较短,大鼠模型尚属糖尿病肾病早期,典型的肾脏病理改变即K-W结节未观察到。用Image-Pro Plus Version 6.0彩色图像分析处理软件对肾组织中MCP-1、TGF-β1、CTGF的表达进行图像半定量分析,结果显示,糖尿病肾病组大鼠MCP-1、TGF-β1、CTGF平均吸光度均高于对照组,提示MCP-1、TGF-β1、CTGF参与了糖尿病肾病的发病过程。在2型糖尿病肾病的早期,肾脏中存在着细胞因子的参与,肾组织纤维化细胞因子表达增强,早期糖尿病肾病肾组织中就存在纤维化。笔者进行的前期实验结果显示:在光镜下(HE染色、Masson染色、PAS染色)对照组大鼠肾组织结构正常,毛细血管袢开放良好,基底膜无增厚,系膜基质无增多;糖尿病肾病组大鼠可见肾小球系膜细胞增生,肾小球基膜增厚,足细胞增生,间质有炎性细胞浸润、间质纤维化严重,肾小球系膜区PAS阳性物质沉积,呈不均匀的红染;Masson染色肾小管内可见颗粒沉积及空泡变性,肾间质增多;而经环磷酰胺治疗的大鼠病理改变明显减轻[3]。
综上所述,细胞因子及炎性因子参与了2型糖尿病肾病的发病,糖尿病肾病早期就存在着纤维化改变,为今后采用免疫抑制剂治疗2型糖尿病肾病提供了线索和依据,而细胞毒类药物如环磷酰胺等能够降低2型糖尿病肾病的蛋白尿、肾功能损害及病理改变。但由于本研究观察时间较短,典型的K-W结节未能观察到,仍需在今后的研究中进一步延长观察时间,深入探讨各种细胞因子在2型糖尿病肾病不同阶段的表达情况。
1薄虹,黄颂敏,吴蔚华,等.糖尿病肾病的现状及对策[J].中华肾脏病杂志,2011,27(6):464-465.
2马青云.糖尿病肾病遗传学研究现状[J].中华糖尿病杂志,2012,4(1):7-8.
3张亚莉,姜莎莎,李燕,等.CTX对2型糖尿病肾病的治疗作用[J].山西医科大学学报,2012,43(8):571-575,636-637.
4李玉山,刘丽秋.实验性2型糖尿病肾病大鼠模型研究[J].中国实验诊断学,2009,13(5):574-577.
5罗志峰,牟娇,齐伟,等.4-苯基丁酸对糖尿病肾病大鼠的作用[J].中华肾脏病杂志,2012,26(5):358-362.
6Tesch GH,Allen TJ.Rodent models of streptozotocin induced diabetic nephropathy[J].Nephrology(Carlton),2007,12(3):261-266.
7胡承,虞伟慧,贾伟平.中国人2型糖尿病遗传学研究的现状—兼谈中西方人群差异[J].中华糖尿病杂志,2012,4(1):4-6.
8张路霞,王海燕.从流行病学的角度探讨我国糖尿病肾病的发病趋势及对策[J].中华内科杂志,2010,49(9):804-805.
9吕庆国,童南伟.糖尿病重要临床进展回顾[J].中华内分泌代谢杂志,2012,28(4):271-275.
10刘艳春,刘佳.糖尿病肾病的发病机制及治疗[J].国际内分泌代谢杂志,2011,31(2):84-86.
11Yeo ES,Hwang JY,Park JE,et al.Tumor necrosis factor(TNF-α)and C-reactive protein(CRP)are positively associated with the risk of chronic kidney disease with type 2 diabetes[J].Yonsei Med J,2010,51(4):519-525.
12刘海霞,刘奔,刘丹丹,等.慢性炎症标志物检测对于2型糖尿病早期肾脏病诊断的临床意义[J].中国糖尿病杂志,2012,20(2):108-110.
13鲍荣辉,刘先哲.单核细胞趋化蛋白研究进展[J].医学研究杂志,2006,35(4):58-60.
14Luther SA,Cyster JG.Chemokines as regulators of T cell differentiation[J].Nat Immunol,2001,2(2):102-107.
15杨立明,许丹,马威,等.急性冠脉综合征患者血浆单核细胞趋化因子-1水平的相关研究[J].中国全科医学,2010,13(3):925.
16马洪波,黄涛,韩风,等.转化生长因子β1和Smad4蛋白在肝癌组织中的表达及其意义[J].中国全科医学,2012,15(8):2780.
17闫慧明,丁利芳,刘媛,等.转化生长因子-β1与结缔组织生长因子在类风湿关节炎合并肺间质病变患者血清中的表达水平及临床意义[J].中国全科医学,2012,15(10):3268.
18高春芳.TGFβ1基因变异与疾病相关性研究进展[J].世界华人消化杂志,2007,15(28):2961-2965.
19Qi MY,Kai-Chen,Liu HR,et al.Protective effect of lcariin on the early stage of experimental diabetic nephropathy induced by streptozotocin via modulating transforming growth factor β1and type Ⅳ collagen expression in rats[J].J Ethnopharmacol,2011,138(3):731-736.
20马洪亮,王英,付建峰,等.先天性心脏病伴肺动脉高压患儿血清中血管内皮生长因子与转化生长因子-b1的变化研究[J].疑难病杂志,2011,10(2):89.
21Xu Y,Yang S,Huang J,et al.Tgf-β1induces autophagy and promotes apoptosis in renal tubular epithelial cells[J].Int Mol Med,2012,29(5):781-790.
22陈娟娟.血清转化生长因子-β1和层黏连蛋白在2型糖尿病肾病早期诊断中的应用价值[J].中国全科医学,2010,13(6):1989.
23李勤操,郑喜邦,王晓辉,等.结缔组织生长因子小干扰RNA的构建及其干扰效果的检测[J].生物技术通讯,2008,19(3):347-349.
24赵慧娟,李晓东,孙东立,等.原发性肾小球肾炎患者尿中结缔组织生长因子的检测及其临床意义[J].中国全科医学,2010,13(4):1079.
25马丽娟,杜国利,吕文魁,等.氯沙坦钾对 2型糖尿病肾病大鼠肾脏TGF-β1、CD68和MCP-1表达的影响[J].中国病理生理杂志,2012,28(5):947-950.

