回流法提取栾树果皮中总黄酮的正交实验研究
袁 琦,蒲晓辉,詹慕欧洋,李 哲,竟香艳,陈毛芬,周云丰,崔丽丽
(河南大学 药学院,河南 开封 475004)
栾树属(Koereuteria)是无患子科落叶乔木。中国产有三个种,一个变种,分别为栾树(K.henryi)、台湾栾树(K.paniculata)、复羽叶栾树(K.bipinnata),变种为全缘叶栾树(K.bipinnata var.integrifoliola)。我们主要研究回流提取方法对栾树黄酮提取的最佳条件,为更好地利用栾树资源提供依据[1-7]。
1 材料和仪器
1.1 材料
栾树果壳于2012年3 月采自河南大学金明校区,自然风干,粉碎,装袋备用。
1.2 仪器与药品
紫外可见分光光度计UV-1600(北京瑞丽有限公司);SHB-III循环水式真空泵(郑州长城科工贸有限公司);芦丁标准品(中国药品生物制品检定所);乙醇,硝酸铝,亚硝酸钠,氢氧化钠,三氯化铝均为分析纯。
2 实验方法
2.1 对照品溶液的配制
称取芦丁对照品0.01051g,用体积分数70%乙醇定容于50mL容量瓶中,配制成为0.2102g/L芦丁乙醇溶液,作为对照品溶液。
2.2 栾树黄酮类化合物的提取
分别准确称取已粉碎的栾树果皮10.0g,置磨口锥形瓶中,加入一定量不同浓度的乙醇为提取剂。在不同温度、时间、料液比等条件下回流提取,确定正交实验提取因素的数值。在此基础上,设计正交法进一步确定提取的最佳条件。
2.3 供试品溶液的制备以及含量测定
栾树果皮提取液过滤后的滤液,用相应浓度的乙醇定容于500mL容量瓶。吸取1mL置10mL容量瓶中,加50g/L NaNO2溶液0.3mL,振荡摇匀,放置6min 后,加100g/L Al(NO3)3溶液0.3mL,振荡摇匀,放置6min 后,再加40g/L NaOH 溶液4mL,振荡摇匀,用体积分数为30%乙醇定容至刻度,振荡摇匀,放置1.5h 后,于510nm 测量吸光度[8-9]。
2.4 标准曲线的制备
精密称取0.01051g芦丁,用体积分数为70%乙醇溶解后,定容于50 mL 容量瓶中,得0.2102g/L 芦丁的标准溶液。精密吸取芦丁对照液0.5、1.0、1.5、2.0、2.5mL 分别置10mL 容量瓶中,按照“2.3”项下制备方法制备溶液,放置1.5h后,采用紫外分光光度法,在510nm 处测定吸光度。以对照品浓度(g/L)为横坐标,吸光度为纵坐标,求得回归方程:Y=0.1159 X-0.00914(r=0.9997),线性范围(1.051~7.357)×10-2g/L。
2.5 精密度实验
精密吸取芦丁标准品溶液5mL 置10mL 容量瓶中,加入体积分数为30%乙醇定容。从中吸取3mL 置10mL 容量瓶中,按照“2.3”项下配制溶液后,测其吸光度,重复测定5次,测定结果的RSD为0.19%,说明采用该方法测量黄酮含量时仪器误差较小。
2.6 重复性实验
分别精密称取栾树果皮10.0g,称取5 份,按“2.2”项下制备待测液,从中吸取1mL,按“2.3”项下配制溶液,在510nm 处测吸光度,重复测量3次,结果的RSD为0.665%,说明方法的重复性较好。
3 结果与分析
3.1 提取条件的确定
3.1.1 提取剂浓度的选择 黄酮类化合物无论是游离的黄酮苷元还是黄酮苷都易溶于甲醇、乙醇、丙酮,根据溶剂的市场价格以及毒性,采用乙醇进行提取。在提取温度80℃、时间2h的条件下,采用不同浓度的乙醇溶剂进行提取。按“2.3”项下方法测定提取液的吸光度,其结果见表1。
由表1可以看出,乙醇浓度在体积分数为50%以下时,提取率随着浓度的增大而增大,当乙醇的浓度在体积分数为50%时,效果最好。但是,随着浓度增加,提取率反而降低,主要是因为乙醇浓度不同,极性也不同。随着乙醇浓度的升高,一些脂溶性物质的溶出增加,影响了黄酮类物质的浸出。而体积分数为50%的乙醇极性与黄酮类物质的极性相似,所以提取率最高。
3.1.2 提取时间的选择 在体积分数为50%乙醇、提取温度80℃、料液比1∶15的条件下,改变提取时间,进行提取。按“2.3”项下方法测定提取液的吸光度,结果见表2。

表1 乙醇浓度实验结果数据统计

表2 回流提取时间数据统计
由表2 可知,120 min前,黄酮类物质还未充分溶出,提取率随提取时间的延长而增加,但120 min后变化不大。因为这时栾树果皮内的黄酮类物质溶出已达到平衡,延长时间只能降低效率,因此,提取时间以120min为宜。
3.1.3 料液比选择 在其他情况相同条件下,不同料液比对提取效果有一定的影响。体积分数为50%乙醇、提取温度80℃、提取时间2h、改变料液比,提取黄酮,结果见表3。
由表3可知,随着料液比的减小,提取率增加。但当料液比小于1∶25以后,随料液比的减小,提取率改变不大。从提取效果、减少溶剂用量和降低浓缩负荷等方面综合考虑,选用1∶25的料液比较合适。
3.2 正交实验设计
在以上单因素实验的基础上,确定每个因素的3个水平(见表4),因此,选用L9(33)正交表进行实验[10-11],以栾树果皮总黄酮的提取率为考察指标。结果见表5、表6。
3.3 最佳工艺验证实验
由表7可知,测定的结果相比较于正交实验表中的最佳组合(3.223%)低0.186%,但是从节约溶剂、时间上来看,时间120 min,料液比1∶30 是比较合适的。

表3 固液比实验数据统计

表4 因素水平设计
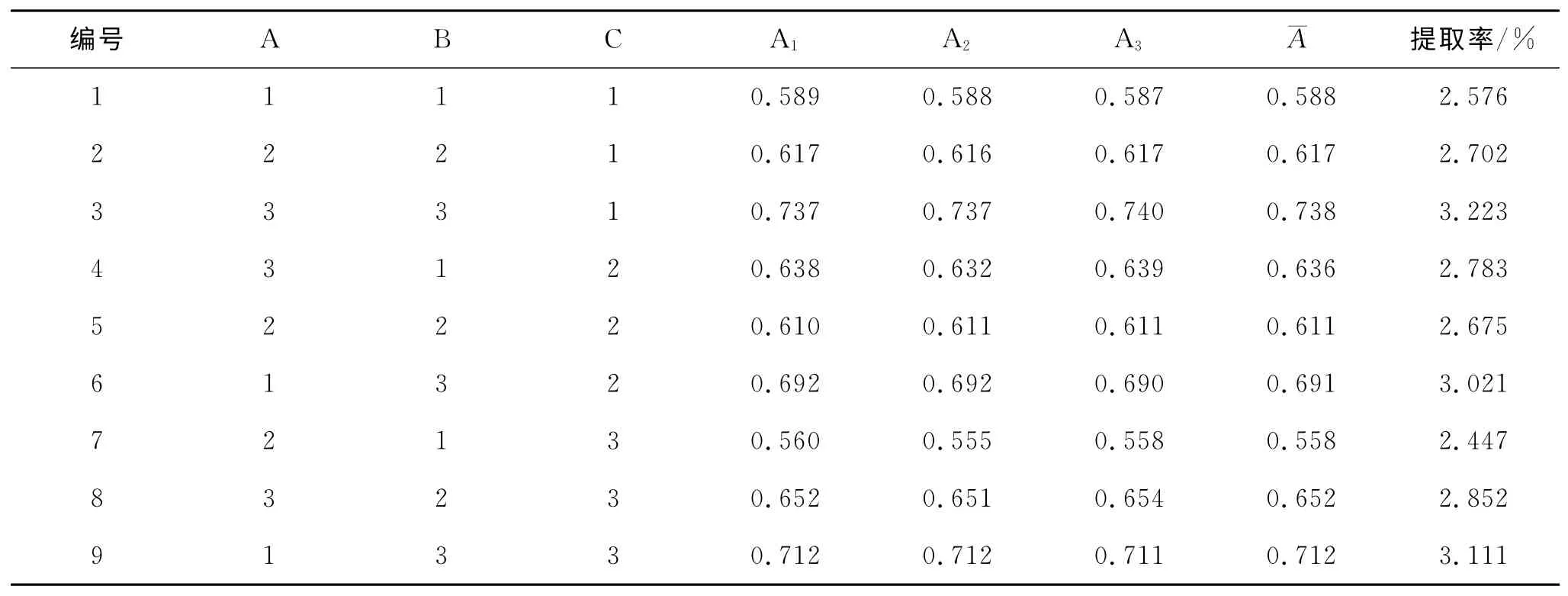
表5 L9(33)正交实验表

表6 方差分析表(%)

表7 最佳工艺的验证实验(%)
3.4 实验结论
比较表6中R的大小,可知RB最大,故因素B对实验结果影响最大,其次是A和C。比较各个因素不同水平的综合平均值,可知最优条件是A3B3C1,RA、RC比较小,因此因素A、C 对结果影响不大。考虑到成本问题,可以选择体积分数为40%的乙醇进行提取,回流时间120 min。因此最佳方案为A2B3C3,即体积分数为40%乙醇、时间120min、料液比1∶30。
[1]杨小凤,付宏征,雷海民,等.栾树的化学成分[J].药学学报,1999,34(6):457-462.
[2]雷海民,李强,毕葳,等.栾树-新皂苷类化学成分的研究[J].药学学报,2007,42(2):171-173.
[3]马广恩,申雅维,鲁学照,等.栗树抗菌有效成分的研究[J].中草药,1998,29(2):84-85.
[4]丁圣彦,冯贵香,李黎.河南大学校园植物区系初步分析[J].河南大学学报:自然科学版,2002,32(3):51-54.
[5]丁利君,吴振辉,蔡创海,等.菊花中黄酮类物质提取方法的研究[J].研究与探讨,2002,23(2):20-22.
[6]龚叶南.分光光度法测定蜂花粉中的总黄酮[J].河南大学学报:医学版,2009,28(2):121-124.
[7]赵排风.软蒺藜中总黄酮的含量测定及其提取工艺的优化[J].河南大学学报:医学版,2009,28(2):115-117.
[8]李勉,刘广河,王雁,等.分光光度法测定开封培育菊花中总黄酮含量[J].河南大 学学报:医学版,2011,30(3):174-176.
[9]冯海燕,李向军,胡瑞省,等.超声法提取萹蓄总黄酮的正交实验研究[J].河北科技大学学报,2011,12(6):611-614.
[10]袁敏,刘道芳.正交实验优选滁菊总黄酮的提取工艺[J].安徽医药,2006,10(8):569-570.
[11]李荣,李小平,于生兰,等.超声法提取蜘蛛香中总黄酮的正交试验研究[J].安徽农业科学,2008,36(25):10933-10944.

