锌(Ⅱ)-色氨酸-邻菲咯啉配合物的合成及其与DNA的作用和生物毒性研究
刘向伟,袁永安,张前前,李 苓,牛淑妍
(1.中国海洋大学化学化工学院,山东青岛266100;2.青岛科技大学化学与分子工程学院,山东青岛266042)
锌(Ⅱ)-色氨酸-邻菲咯啉配合物的合成及其与DNA的作用和生物毒性研究
刘向伟1,袁永安1,张前前1,李 苓1,牛淑妍2
(1.中国海洋大学化学化工学院,山东青岛266100;2.青岛科技大学化学与分子工程学院,山东青岛266042)
合成了一种新的锌(Ⅱ)-色氨酸-邻菲咯啉配合物[Zn(Trp)(phen)2]Cl·7H2O(Ⅰ)(Trp为L-色氨酸离子,phen为邻菲咯啉)。通过元素分析、红外光谱及热重-差热分析对其进行了结构表征,采用电子吸收光谱法、荧光光谱法及琼脂糖凝胶电泳法考察了其与DNA的作用,研究了配合物对斑马鱼胚胎的生物毒性,并与2种已知结构的锌-邻菲咯啉配合物[Zn(phen)2]Cl2·5H2O(Ⅱ)和[Zn(phen)]Cl2(Ⅲ)进行了比较。结果表明,配合物与鲑鱼精DNA作用大小顺序为配合物Ⅰ>配合物Ⅱ>配合物Ⅲ,但作用方式不同;在抗坏血酸存在下,配合物Ⅰ对pBR322 DNA的切割作用最强;配合物对斑马鱼胚胎毒性作用大小顺序为配合物Ⅱ>配合物Ⅰ>配合物Ⅲ。
锌(Ⅱ)-色氨酸-邻菲咯啉配合物;鲑鱼精DNA;琼脂糖凝胶电泳;斑马鱼胚胎
近年来,新型过渡金属配合物的合成及其性能一直是生化领域研究的重要课题[1-3],尢其是其与DNA的作用研究及生物活性研究更是其中的重点[4,5]。锌是生命体必需的微量元素之一,因此,对金属锌配合物的研究意义重大。同时,现有研究很少涉及这些具有潜在生物活性的配合物的生物毒性。斑马鱼是经济合作与发展组织(OECD)的指导手册规定的实验标准鱼类[6,7],作为模式生物广泛应用于发育生物学和遗传学研究及毒性评价中[8-10],却极少用于金属配合物生物毒性的检测。鉴于此,作者设计合成了一种未见文献报道的锌(Ⅱ)-色氨酸-邻菲咯啉配合物,对其结构进行了表征,考察了其与DNA的作用方式及其对DNA的切割活性,选用斑马鱼胚胎为模式生物研究其生物毒性,并与2种已知的锌-邻菲咯啉配合物进行了比较。
1 实验
1.1 试剂与仪器
溴化乙锭(EB,生化试剂),Amresco公司;L-色氨酸(生化试剂,层析纯),中科院上海生物化学研究所;琼脂糖凝胶(Biowest agrose),基因科技有限公司分装;抗坏血酸(分析纯)、鲑鱼精DNA(生化试剂),美国Sigma公司,鲑鱼精DNA纯度用UV谱检测,其A260/ A280>1.8,浓度用在260 nm处摩尔消光值检测(ε= 6600 mol-1·cm-1);p BR322 DNA(生化试剂),东盛生物科技有限公司;三羟基氨基甲烷及其它试剂为国产分析纯;Tris-HCl缓冲溶液(p H值7.40,p H值7.60);分析实验用水为二次水。斑马鱼饲养用水为充氧饱和、保持恒定温度(25±1)℃的自来水。
Vario ELⅢ型元素分析仪;岛津UV-2550型紫外可见分光光度计;ZRY-2P型差热分析仪,升温速率10℃·min-1;Nicolet 380 FTIR型傅立叶变换红外光谱仪,KBr压片;日立F-4600型荧光光谱仪,其激发波长为525 nm,发射光谱扫描速度为15 nm·s-1,狭缝宽度均为5 nm;北京六一DDY-8C型电泳仪及WD-9413B型凝胶成像分析仪。
1.2 配合物的合成
将ZnCl2(1 mmol,136 mg)、邻菲咯啉(2 mmol, 396 mg)分别溶于10 m L蒸馏水-乙醇(1∶1,体积比)混合液中,得无色透明溶液;将L-色氨酸(2 mmol, 408 mg)溶于10 m L蒸馏水中,滴加2 mol·L-1NaOH溶液至完全溶解,用1.5 mol·L-1HCl溶液调p H值为10。室温下,将邻菲咯啉溶液滴加至ZnCl2溶液中,80℃水浴加热,搅拌,回流2 h,溶液呈浅黄色。将L-色氨酸溶液滴加至上述溶液中,继续回流4 h得浅棕黄溶液,静置约7 d后析出黄色晶体,过滤后依次用少量蒸馏水、乙醇洗涤,即得锌(Ⅱ)-色氨酸-邻菲咯啉配合物[Zn(Trp)(phen)2]Cl·7H2O(Ⅰ),产量426 mg,收率25.8%。对配合物Ⅰ进行表征。
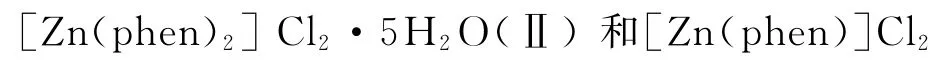
(Ⅲ)根据文献[11,12]合成。
1.3 配合物对DNA作用的电子吸收光谱及其对EBDNA体系作用的荧光光谱测定
在Tris-HCl缓冲溶液(p H值7.40)中加入8.86 ×10-3mol·L-1鲑鱼精DNA和不同浓度的配合物溶液,以相应浓度的配合物溶液为参比,于190~600 nm测其电子吸收光谱。
在Tris-HCl缓冲溶液(p H值7.40)中分别加入不同浓度梯度的配合物、1.0×10-6mol·L-1EB和1.7×10-5mol·L-1鲑鱼精DNA,于550~710 nm测其发射荧光光谱。
1.4 琼脂糖凝胶电泳分析
在不同浓度配合物溶液中加入50倍于配合物浓度的抗坏血酸,再分别加入125 ng pBR322 DNA,用Tris-HCl缓冲溶液(p H值7.60)定容至5μL,恒温37℃下反应一定时间后,加入2~3μL 6×loading buffer终止反应。在SBA电泳液(1 mol·L-1氢氧化钠,45 mol·L-1硼酸,p H值8.45)和0.8%的琼脂糖凝胶中电泳(电压220 V)一定时间,以2~3μL Gold View作为凝胶着色剂,用凝胶成像分析仪观察并拍照。
1.5 配合物对斑马鱼胚胎的毒性实验
斑马鱼胚胎的孵化参照文献[13]。
在24孔细胞培养板中依次加入一定浓度梯度的配合物溶液2 m L,每个浓度做8个平行。将培养板放入27~28℃的恒温水浴中,待温度恒定后,取目测健康的囊胚期斑马鱼胚胎即5 hpf(Hours post fertilization)放入培养板溶液中,5粒·孔-1,以溶剂空白作对照。每2 h去除1次坏死的斑马鱼胚胎,观察并记录24 hpf的胚胎死亡数和72 hpf的胚胎孵化数。
2 结果与讨论
2.1 配合物Ⅰ的结构和性质表征
[Zn(Trp)(phen)2]Cl·7 H2O(Ⅰ),分子量789,熔点173℃;元素分析实测值(计算值):C 52.96(53. 23),H 10.67(10.65),N 5.19(5.19);溶于水、无水乙醇、无水甲醇和DMSO,难溶于丙酮和乙酸乙酯;配体和配合物Ⅰ的红外光谱数据见表1。

表1 配体和配合物Ⅰ的红外光谱数据/cm-1Tab.1 IR Data of the ligands and complexⅠ/cm-1
由表1可知,与配体Trp和phen比较,配合物[Zn(Trp)(phen)2]Cl·7 H2O的配位发生在Trp的—COO—和phen的N上。Trp的—COO—基团的反对称伸缩振动和对称伸缩振动分别出现在1667 cm-1和1415 cm-1,配合物的—COO—基团的反对称伸缩振动峰红移至1651 cm-1,其对称伸缩振动峰移至1426 cm-1,Δν(-COO-)由252 cm-1变为225 cm-1, N—H变形振动配位相对不变,表明Trp以羧基氧参与配位;phen的C=N伸缩振动峰由1643 cm-1移至1622 cm-1,环特征吸收峰νRing由1556 cm-1移至1518 cm-1,即发生红移,且吸收强度改变,表明phen中2个氮原子参与配位[14]。由此推测该配合物中Zn(Ⅱ)的配位数为5,为四方锥构型。
热重-差热分析结果显示,在0~700℃范围内,配合物Ⅰ有3次失重,其DTA曲线上有1个吸热峰、2个分解放热峰,所对应的峰顶温度依次为87.2℃、385.8℃、574.0℃,分别对应配合物的7个结晶水分子、1个L-色氨酸离子、2个邻菲咯啉和1个氯离子,与元素分析及红外光谱分析结果一致。
25℃下,测得配合物Ⅰ在甲醇中的摩尔电导率为74 S·cm2·mol-1,由此推测该配合物为电解质[15]。
2.2 配合物与DNA作用的电子吸收光谱
分析电子吸收光谱的变化可以粗略判断某种化合物是否与DNA发生了作用[16]。图1为3种配合物对鲑鱼精DNA电子吸收光谱的影响。
由图1可知,加入3种配合物后,DNA的吸收峰位置均发生移动,吸收强度明显降低。配合物Ⅰ、Ⅱ、Ⅲ与鲑鱼精DNA浓度比为0.4时,在201 nm处的吸收峰分别红移8 nm、7 nm、5 nm,减色率[17]分别为62%、46%、32%;在258 nm处的吸收峰分别紫移4 nm、5 nm、4 nm,减色率分别为45%、44%、28%。根据DNA电子吸收光谱吸收峰位置及强度变化,可知3种配合物与DNA作用方式相似,但作用强度大小为:配合物Ⅰ>配合物Ⅱ>配合物Ⅲ。

图1 3种配合物对鲑鱼精DNA电子吸收光谱的影响Fig.1 Effect of three complexes on the electronic absorption spectra of sperm DNA
2.3 配合物与EB-DNA体系竞争的荧光光谱
EB可作为研究配合物和DNA作用模式的荧光探针[18]。配合物Ⅰ加入EB-DNA体系前后荧光强度变化不明显,说明配合物Ⅰ与DNA作用的主要模式不是与EB相似的嵌插作用,而是静电作用或沟面结合作用。
不同浓度配合物Ⅱ或Ⅲ存在下,EB-DNA体系的荧光强度见图2。

图2 不同浓度配合物存在下,EB-DNA体系的荧光光谱Fig.2 Fluorescence spectra of EB-DNA system in the presence of different concentrations of complexes
由图2可知,配合物与鲑鱼精DNA浓度比较低时,加入配合物Ⅲ对EB-DNA体系荧光强度的影响不明显,而加入配合物Ⅱ对EB-DNA体系的荧光强度影响很显著。由图2还可知,随着配合物浓度的增大, EB-DNA体系的荧光逐步猝灭,由此可认为配合物分子与EB发生了竞争反应。采用Stern-Volmer方程求得配合物取代EB与DNA作用的猝灭常数Ksq[19]:

式中:I和I0分别为配合物存在和不存在时体系的荧光强度;r为配合物与鲑鱼精DNA浓度比。以I0/I对r作图得一直线(图2中插图),直线斜率即Ksq值。配合物Ⅱ和Ⅲ的Ksq值分别为3.65和1.81,说明配合物与DNA作用大小为配合物Ⅱ>配合物Ⅲ。
2.4 配合物对DNA的切割作用
通常完整的p BR322 DNA呈超螺旋型(FormⅠ),当其中1条DNA链断裂时即变为开环缺刻型(FormⅡ);当2条DNA链在相同位置都发生断裂时,即变为线型(FormⅢ)。3种形式的p BR322 DNA在电泳上的迁移率完全不同,据此可研究物质对DNA的断裂作用[20]。不同浓度配合物对p BR322 DNA(125 ng)的切割作用见图3。
由图3可知,3种配合物均可将超螺旋型(FormⅠ)的pBR322DNA的共价闭环切割成开环缺刻型(FormⅡ),其中配合物Ⅱ甚至切割出线型(FormⅢ),且配合物浓度越大,其对DNA的切割活性越强。配合物Ⅰ与p BR322 DNA作用10 min时已经表现出强烈的切割活性;配合物Ⅱ或配合物Ⅲ与pBR322 DNA作用10 min时,均对p BR322 DNA无显著作用。这表明配合物Ⅰ的切割活性较配合物Ⅱ、Ⅲ更强。当浓度为2.5μmol·L-1时,配合物Ⅱ将约50%超螺旋型DNA转变为缺刻型DNA,而在配合物Ⅲ体系中,DNA仍主要以超螺旋型存在;当浓度提高至10 μmol·L-1时,配合物Ⅱ将超螺旋型DNA完全转变为缺刻型DNA,并且切割出线型DNA,配合物Ⅲ也将超螺旋型DNA完全转变为缺刻型DNA,但未切割出线型DNA,这说明配合物Ⅱ切割活性较配合物Ⅲ强。综上所述,三者对pBR322 DNA切割活性大小为:配合物Ⅰ>配合物Ⅱ>配合物Ⅲ。
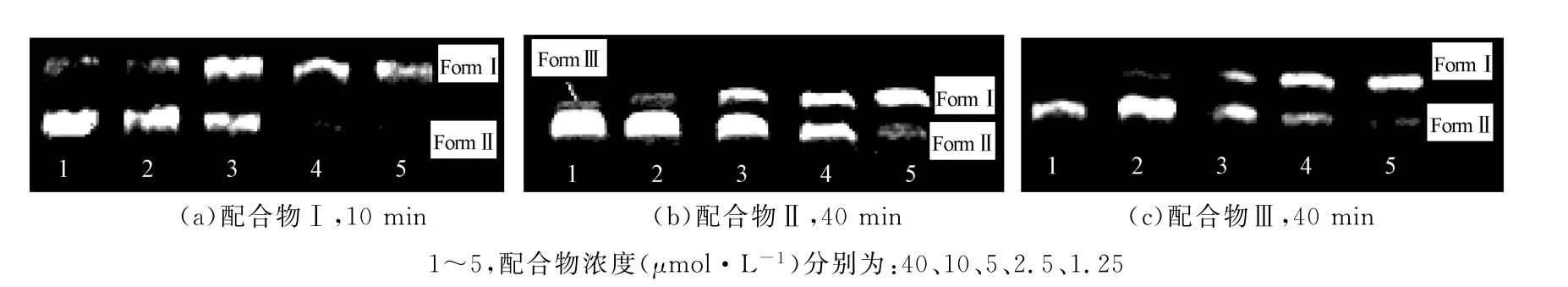
图3 不同浓度配合物对pBR322 DNA的切割作用Fig.3 Agarose gel eletrophorograms for the cleavage of pBR322 DNA by different concentrations of complexes
2.5 配合物对斑马鱼胚胎的毒性
配合物浓度对斑马鱼胚胎(24 hpf)死亡率的影响见图4。
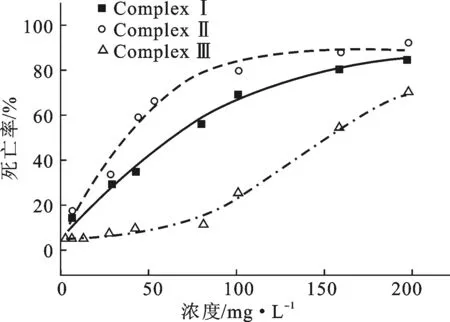
图4 配合物浓度对斑马鱼胚胎(24 hpf)死亡率的影响Fig.4 Effect of complex concentration on mortality rate of zebrafish embryos
由图4可知,3种配合物中配合物Ⅲ对斑马鱼胚胎(24 hpf)死亡率的影响最小,其浓度小于100 mg·L-1时作用可忽略,且配合物Ⅱ的影响明显高于配合物Ⅰ。
配合物浓度对斑马鱼胚胎(72 hpf)孵化率的影响见图5。
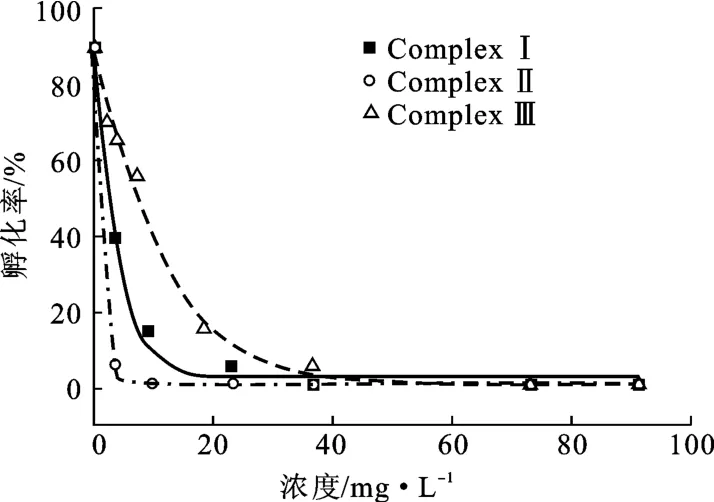
图5 配合物浓度对斑马鱼胚胎(72 hpf)孵化率的影响Fig.5 Effect of complex concentration on hatching rate of zebrafish embryos
由图5可知,随着配合物浓度的增大,斑马鱼胚胎孵化率迅速降低,三者对胚胎孵化率影响大小依次为配合物Ⅱ>配合物Ⅰ>配合物Ⅲ。配合物Ⅱ在低浓度(3 mg·L-1)时的孵化率<5%。与配合物Ⅰ、Ⅱ、Ⅲ作用的斑马鱼胚胎在72 hpf时的半致死浓度分别为26.0 mg·L-1、19.5 mg·L-1、28.8 mg·L-1。
综上所述,3种配合物对斑马鱼胚胎毒性大小依次为:配合物Ⅱ>配合物Ⅰ>配合物Ⅲ,据此推测相对于配合物Ⅱ,配合物Ⅰ可能因引入一个L-色氨酸离子配位,生物毒性明显降低。
3 结论
合成并表征了一个新的锌(Ⅱ)-色氨酸-邻菲咯啉配合物[Zn(Trp)(phen)2]Cl·7 H2O(Ⅰ),将其与2种锌-邻菲咯啉配合物[Zn(phen)2]Cl2·5H2O(Ⅱ)和[Zn(phen)]Cl2(Ⅲ)进行比较研究,结果表明,L-色氨酸离子的配位明显增强了配合物Ⅰ与DNA的相互作用,而其毒性较单纯以phen配位的配合物Ⅱ要低,这对高效低毒药物研发具有一定的参考意义。
[1] Efthimiadou E K,Katsarou M E,Karaliota A,et al.Copper(Ⅱ) complexes with sparfloxacin and nitrogen-donor heterocyclic ligands:Structure-activity relationship[J].Journal of Inorganic Biochemistry,2008,102(4):910-920.
[2] Li Y H,Wang B D,Yang Z Y.Infrared and DNA-binding on ultraviolet and fluorescence spectra of new copper and zinc complexes with a naringenin Schiff-base ligand[J].Spectrochimica Acta:Part A,2007,67(2):395-401.
[3] 李明田,黄俊,周璇,等.两种有机磺酸配合物的合成、表征及与DNA键合性质[J].无机化学学报,2008,24(11):1794-1802.
[4] 古琴,任祥祥,乐学义.咪唑并[5,6-f][1,10]邻菲咯啉-铜(Ⅱ)-L-亮氨酸(L-酪氨酸)配合物与DNA的作用[J].化学通报,2009, (9):809-814.
[5] 张芳,张前前,陆小兰,等.铜(Ⅱ)-天冬氨酸-咪唑类配合物的合成及其与DNA作用的光谱研究与比较[J].光谱学与光谱分析,2007,27(2):302-305.
[6] Ensenbach U,Nagel R.Toxicity of complex chemical mixtures.A-cute and long term effects on different life stages of zebrafish (Brachydanio rerio)[J].Ecotoxicology and Environmental Safety,1995,30(2):151-157.
[7] Clark K J,Urban M D,Skuster K J,et al.Transgenic zebrafish using transposable elements[J].Methods Cell Biol,2011,104:137-149.
[8] Kienle C,Köhler H R,Filser J,et al.Effects of nickel chloride and oxygen depletion on behaviour and vitality of zebrafish(Danio rerio,Hamilton,1822)(Pisces,Cypriniformes)embryos and larvae [J].Environmental Pollution,2008,152(3):612-620.
[9] 王佳佳,徐超,屠云杰,等.斑马鱼及其胚胎在毒理学中的实验研究与应用进展[J].生态毒理学报,2007,2(2):123-135.
[10] Zhang L,An J,Zhou Q X.Single and joint effects of HHCB and cadmium on zebrafish(Danio rerio)in feculent water containing bedloads[J].Front Environ Sci Eng,2012,6(3):360-372.
[11] Crosby G A,Highland R G,Truesdell K A.Spectroscopic properties of(Nd)10transition metal complexes[J].Coordination Chemistry Reviews,1985,64:41-52.
[12] 胡瑞定,朱伟琴.锌(Ⅱ)配合物与DNA作用的研究[J].浙江师范大学学报,2003,26(4):379-383.
[13] 付怀洲,刘向伟,张前前,等.两种铜(Ⅱ)-司帕沙星配合物与DNA作用及生物毒性比较[J].中国海洋大学学报,2011,41(7/ 8):144-148.
[14] Abuhijleh A L,Woods C.Mononuclear copper(Ⅱ)salicylate imidazole complexes derived from copper(Ⅱ)aspirinate.Crystallographic determination of three copper geometries in a unit cell [J].Inorganic Chemistry Communications,2001,4(3):119-123.
[15] Geary W J.The use of conductivity measurements in organic solvents for the characterization of coordination compounds[J].Coordination Chemistry Reviews,1971,7(1):81-122.
[16] 汪中明,周志芬,林华宽,等.2,9-二甲基-1,10-菲咯琳的DL-丙氨酸衍生物的合成表征及其镧配合物与DNA作用光谱研究[J].无机化学学报,2000,16(3):503-509.
[17] 赵琳,吴宝燕,高丽华,等.一种含吲哚咪唑基Ru(Ⅱ)配合物的酸碱性质和与DNA相互作用的研究[J].化学学报,2006,64 (13):1402-1406.
[18] 胡敏,张镇西,沈国励,等.阿克拉霉素A与DNA作用的光谱学研究[J].光谱学与光谱分析,2006,26(9):1668-1671.
[19] Lakowicz J R,Weber G.Quenching of fluorescence by oxygen.A probe for structural fluctuations in macromolecules[J].Biochemistry,1973,12(21):4161-4170.
[20] Wang X L,Chao H,Li H,et al.Synthesis,crystal structure and DNA cleavage activities of copper(Ⅱ)complexes with asymmetric tridentate ligands[J].Journal of Inorganic Biochemistry, 2004,98(3):423-429.
Studies on Synthesis,DNA Binding Action and Bio-Toxicity of Zn(Ⅱ)-Trp-Phen Complex
LIU Xiang-wei1,YUAN Yong-an1,ZHANG Qian-qian1,LI Ling1,NIU Shu-yan2
(1.College of Chemistry and Chemical Engineering,Ocean University of China, Qingdao 266100,China;2.College of Chemistry and Molecular Engineering,Qingdao University of Science and Technology,Qingdao 266042,China)
A novel complex of[Zn(Trp)(phen)2]Cl·7H2O(Ⅰ)(Trp=ion of L-tryptophan,phen= phenanthroline)was synthesized and characterized by elemental analysis,IR spectroscopy and TG-DTA.The interaction of the complex with DNA was investigated by electric absorption spectroscopy,ethidium bromide(EB) fluorescence spectroscopy and agarose gel electrophoresis.The bio-toxicity of the complex on zebrafish embryos was determined.Two known complexes[Zn(phen)2]Cl2·5 H2O(Ⅱ)and[Zn(phen)Cl2](Ⅲ)were chosen to study as comparison reference.The results indicated that the three complexes bond to sperm DNA by different modes,and clove pBR322 DNA in the presence of vitamin C as a reducing regent with the order of the binding ability and cleavage activity:complexⅠ>complexⅡ>complexⅢ.The bio-toxicity of the complexes on zebrafish embryos increased in the order:complexⅡ>complexⅠ>complexⅢ.
Zn(Ⅱ)-Trp-phen complex;sperm DNA;agarose gel electrophoresis;zebrafish embryo
O 614.2
A
1672-5425(2013)03-0031-05
10.3969/j.issn.1672-5425.2013.03.008
国家自然科学基金资助项目(21075073),中国海洋大学实验室研究基金资助项目(SYS200905)
2012-12-17
刘向伟(1984-),女,山东青岛人,硕士研究生,研究方向:生物无机化学,E-mail:lianbiner@163.com;通讯作者:张前前,教授,E-mail:qqzhang@ouc.edu.cn。

