产抗生素南极海洋放线菌的筛选及培养条件优化
彭 彬,孙 超
(潍坊科技学院化工与环境学院,山东寿光262700)
产抗生素南极海洋放线菌的筛选及培养条件优化
彭 彬,孙 超
(潍坊科技学院化工与环境学院,山东寿光262700)
对32株南极海洋放线菌进行抑菌活性实验,筛选出3株具有一定抑菌活性的放线菌,分别命名为GD-F1、GD-F2和GD-F3,其中GD-F2的抑菌活性较高;探讨了碳源、氮源、p H值等条件对GD-F2产抗生素的影响,确定GD-F2产抗生素的最佳培养条件为:碳源为可溶性淀粉、氮源为大豆粉或酵母膏、用天然海水和蒸馏水各一半配制培养基、无机盐浓度为改良高氏一号培养基的一半、p H值为7.0,为南极海洋放线菌的机理研究和应用奠定了基础。
南极海洋放线菌;抗生素;分离筛选
自1988年Dvide等首次从南极土壤中分离出具有溶菌能力、溶琼脂能力的嗜冷型粘细菌开始,科研工作者已经将筛选新的抗肿瘤的活性物质的目标转向了极地海洋微生物。从极地海洋环境中筛选放线菌及其产生的新型抗生素不仅具有较高的学术价值,同时具有良好的社会和经济效益[1-5]。
作者对中国第十九次南极科学考察采集的32株南极海洋放线菌进行了抑菌活性的筛选,获得具有一定抑菌活性的3株放线菌,探讨了高产抗生素菌株的最优培养条件,为南极海洋放线菌的机理研究和应用奠定了基础。
1 实验
1.1 菌株、试剂与仪器
南极海洋放线菌,于中国第十九次南极科学考察采集样品中分离获得。金黄色葡萄球菌、大肠杆菌、沙堡菌、枯草芽孢杆菌,自行保藏。
葡萄糖,乳糖,蔗糖,可溶性淀粉,玉米粉,大豆粉,酵母膏,蛋白胨,硫酸铵,MgSO4·7H2O,K2HPO4, KNO3,FeSO4·7 H2O,盐酸,氢氧化钠,乙酸乙酯(分析纯);TE缓冲溶液(p H值8.0):10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA;10%(质量浓度) CTAB(十六烷基三乙基溴化铵)溶液:在80 m L双蒸水中溶解4.1 g氯化钠,缓慢加入10 g CTAB,同时加热至65℃并搅拌,定容终体积至100 m L;缓冲溶液: 0.25%溴酚蓝,40%(质量浓度)蔗糖水溶液。
高速离心机,真空泵,恒温水浴,电动旋转仪, PTC-100型PCR仪(M J Research),荧光显微镜。
1.2 培养基
(1)分离培养基采用葡萄糖、天冬素琼脂和营养琼脂,加0.5%甘油、3 mg·m L-1链霉素和100 mg· m L-1制霉菌素。
(2)改良高氏一号培养基(基础培养基):KNO31 g,K2HPO40.5 g,FeSO4·7 H2O 0.01 g,MgSO4· 7H2O 0.5 g,可溶性淀粉20 g,大豆粉(酵母膏)20 g,琼脂20 g,陈海水500 m L,蒸馏水500 m L。调节p H值7.4~7.6,121℃下高压蒸汽灭菌20 min。
(3)液体发酵培养基:甘油3%,葡萄糖0.2%,土豆淀粉0.2%,黄豆饼粉2.0%,全血胨0.3%,干酵母0.5%,陈海水配制。
(4)沙氏培养基:蛋白胨1%,葡萄糖4%,琼脂1.6%,陈海水配制。
1.3 方法
1.3.1 南极海洋放线菌的分离
(1)取1 m L底泥,加4 m L无菌天然海水,55℃保温6 min,涂平板。
(2)取10 m L底泥样品铺于无菌培养皿内,真空干燥约24 h,磨细成粉末;或者将底泥样品铺于无菌培养皿内,25~28℃自然干燥5~7 d,磨碎,80℃或120℃干热处理60 min。用无菌天然海水提取菌体并稀释,涂平板。
1.3.2 产抗生素南极海洋放线菌的筛选
(1)种子液的制备:向改良高氏一号培养基中加入重铬酸钾至50 mg·kg-1,用平板稀释涂抹法分离目的菌株。15℃培养14 d,根据菌落形态选取不同菌株,经纯化后转接至改良高氏一号斜面上,15℃培养7 d。
(2)琼脂挖块接种于装有50 m L种子培养液的250 m L三角瓶中,于15℃旋转摇床上培养48 h作为种子,以10%接种量种入两个分别装有250 m L发酵培养基的500 m L三角瓶中,于15℃往复式摇床上培养7 d后,收集发酵液。
1.3.3 抑菌活性测定
(1)将滤纸片分别放入两个平板培养皿中,110℃高压灭菌20 min,制成无菌滤纸片;
(2)将浓缩液1与浓缩液2分别倒入两个培养皿中,充分浸泡无菌滤纸片,37℃烘干;
(3)将金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙堡菌菌液稀释至1×108个·m L-1,取15 m L稀释菌液加入到50℃左右的琼脂培养基中混匀,然后倒平板备用;
(4)将无菌滤纸片置于涂布有各靶标菌的平板培养基中,每平板内对称放置4片,28℃恒温培养3 d后观察,筛选具有抑菌活性的放线菌。
1.3.4 GD-F2培养条件的优化
选择抑菌活性最高的菌株,考察不同碳源、氮源、盐浓度、无机盐浓度、p H值对其产抗生素的影响,优化培养条件。
2 结果与讨论
2.1 菌株筛选
二是,引入“中国梦”宣传教育可以提高大学生的历史责任感〔3〕。现阶段,随着人们生活水平的提高,部分大学生已经养成了浪费的习惯,且缺乏历史责任感,不能正确认识自身肩上所承担的历史责任。面对此种情况,各个大学就需要积极引入“中国梦”宣传教育,通过此项工作,让大学生可以正式自身历史使命,主动承担民族建设责任,从而为“中国梦”的实现贡献出自身力量。
活性实验结果表明,有3株南极海洋放线菌具有一定的抑菌活性,分别命名为GD-F1、GD-F2和GDF3,如表1所示。

表1 南极海洋放线菌GD-F1、GD-F2、GD-F3的抑菌活性Tab.1 The antibiotic activity of GD-F1,GD-F2,GD-F3
由表1可知,GD-F1和GD-F3对金黄色葡萄球菌具有一定的抑制作用,但活性不高;GD-F2对大肠杆菌和枯草芽孢杆菌具有较好的抑制作用。因此,选择GD-F2进行培养条件的优化。
2.2 GD-F2培养条件的优化
2.2.1 不同碳源对菌株GD-F2产抗生素的影响
分别以1%的葡萄糖、乳糖、蔗糖、可溶性淀粉代替基础培养基中的碳源,测GD-F2发酵液抑菌活性,结果见表2。

表2 不同碳源对菌株GD-F2产抗生素的影响Tab.2 Effect of different carbon sources on the antibiotic activity of GD-F2
由表2可知,4种碳源差异不大,均能有效合成抗生素。考虑到可溶性淀粉价廉易得,因此,选择碳源为可溶性淀粉。
2.2.2 不同氮源对菌株GD-F2产抗生素的影响
分别以1%的大豆粉、酵母膏、蛋白胨和(NH4)2SO4代替基础培养基中的氮源,测GD-F2发酵液抑菌活性,结果见表3。

表3 不同氮源对菌株GD-F2产抗生素的影响Tab.3 Effect of different nitrogen sources on the antibiotic activity of GD-F2
由表3可知,以大豆粉、酵母膏作氮源效果较好,均能有效合成抗菌活性物质。因此,选择氮源为大豆粉或酵母膏。
2.2.3 盐浓度对菌株GD-F2产抗生素的影响
以实验室所取天然海水盐浓度为标准(20℃时测定其密度为1.017 g·cm-3,设为1),考察盐浓度对GD-F2产抗生素的影响,结果见图1。
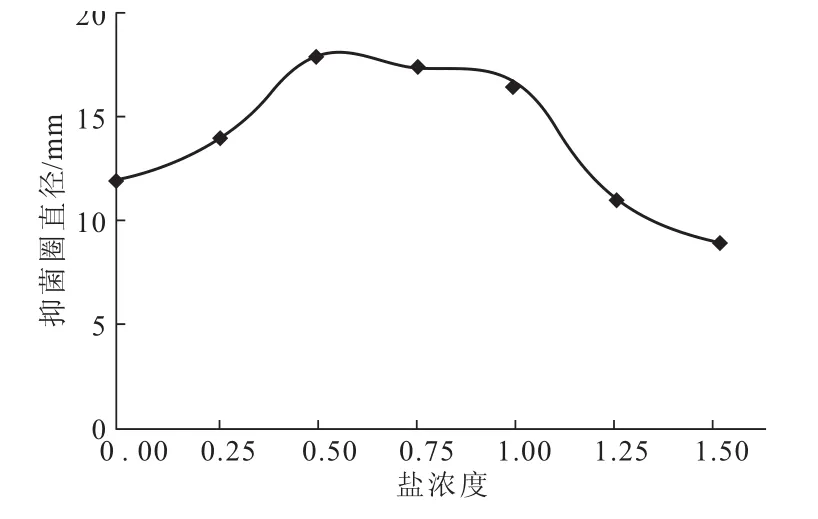
图1 盐浓度对菌株GD-F2产抗生素的影响Fig.1 Effect of salinity on the antibiotic activity of GD-F2
由图1可知,当培养基盐浓度为天然海水的50%~100%时,抑菌圈直径变化不明显,表明GD-F2均能有效合成抗生素。因此,选用天然海水与蒸馏水各一半配制培养基。
2.2.4 无机盐浓度对菌株GD-F2产抗生素的影响
将改良高氏一号培养基的无机盐浓度设为1,考察无机盐浓度对菌株GD-F2产抗生素的影响,结果见图2。
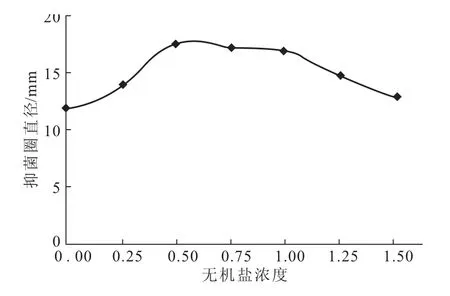
图2 无机盐浓度对菌株GD-F2产抗生素的影响Fig.2 Effect of inorganic salt concentration on the antibiotic activity of GD-F2
由图2可知,当无机盐浓度为改良高氏一号培养基的50%~100%时,抑菌圈直径变化不明显。因此,选用50%的无机盐浓度,即MgSO4·7 H2O 0.025%, K2HPO40.025%,KNO30.05%,FeSO4·7H2O 0.0005%。
2.2.5 p H值对菌株GD-F2产抗生素的影响
采用优化碳源、氮源、天然海水与蒸馏水各一半配制配养基,用1 mol·L-1HCl或NaOH调节培养基初始p H值分别为4.0、5.0、6.0、7.0、8.0和9.0,检测GD-F2发酵6 d的抑菌圈直径,结果见图3。
由图3可知,p H值>8.0或p H值<6.0时,抑菌圈直径直线下降;培养基初始p H值接近中性时(p H值6.0~8.0)抑菌圈直径较大。因此,配制培养基时选取p H值为7.0。

图3 p H值对菌株GD-F2产抗生素的影响Fig.3 Effect of p H value on the antibiotic activity of GD-F2
3 结论
从32株南极海洋放线菌中,成功筛选出3株抗生素产生菌GD-F1、GD-F2、GD-F3,其中GD-F2抑菌活性较高,进一步确定GD-F2产抗生素的最佳培养条件为:碳源为可溶性淀粉、氮源为大豆粉或酵母膏、用天然海水和蒸馏水各一半配制培养基、无机盐浓度为改良高氏一号培养基的一半、p H值为7.0,为南极海洋放线菌的机理研究和应用奠定了基础。
[1] 李勇,李铭刚.放线菌YIM31249发酵液萃取物的抗菌活性初步研究[J].化工时刊,2004,18(5):45-47.
[2] Watve M G,Tickoo R,Jog M M,et al.How many antibiotics are produced by the genus Streptomyces[J].Arch Microbiol,2001, 176(5):386-390.
[3] Gushterova1 A,Vasileva-Tonkova E,Dimova E,et al.Keratinase production by newly isolated Antarctic actinomycete strains[J]. Micro&Biotech,2005,21(4):831-834.
[4] 胡继兰,张春颖,娜仁,等.产生抗肿瘤抗生素Sandramycin的南极放线菌C3905[J].微生物学报,2000,40(6):646-649.
[5] 朱跃进,龙中儿,黄运红,等.一株稀有放线菌发酵产抗生素的工艺研究[J].化学与生物工程,2006,23(12):39-42.
Screening and Optimization of Culture Conditions of Antarctic Marine Actinomycete Producing Antibiotics
PENG Bin,SUN Chao
(College of Chemical Engineering and Environment,Weifang University of Science and Technology,Shouguang 262700,China)
The antibiotic activity of 32 strains of antarctic marine Actinomycete were tested and 3 strains GD-F1,GD-F2,GD-F3 with antibiotic activity were screened,among which strain GD-F2 had the highest antibiotic activity.The culture conditions for strain GD-F2 were obtained as follows:with soluble starch as carbon source,with bean powder or yeast extract as nitrogen source,the medium with p H value of 7.0 was made with natural sea water-distilled water(1∶1),the concentrations of inorganic salts were half of those of improved Gao No.1 culture medium.This study will lay the foundation for adaptation mechanism research and biotechnological application of antarctic marine Actinomycete.
antarctic marine Actinomycete;antibiotics;separation and screening
Q 939
A
1672-5425(2013)03-0064-03
10.3969/j.issn.1672-5425.2013.03.017
2012-12-14
彭彬(1986-),女,山东寿光人,讲师,研究方向:生物工程,E-mail:kdsunchao@163.com。

