饥饿胁迫对卵形鲳鲹幼鱼消化器官组织学的影响*
区又君1,苏慧1,2,李加儿1,王永翠1,2,刘汝建1,2,曹守花1,2
(1.中国水产科学研究院南海水产研究所,农业部南海渔业资源开发利用重点实验室,广东广州 510300;2.上海海洋大学水产与生命学院,上海 201306)
鱼类为维持生长、发育和繁殖等生命活动,必须从水环境中获得充足食物,以提供正常生命活动所需的能量。但在自然环境中,鱼类因环境改变、季节变化、食物短缺等而时常受到饥饿的胁迫,即使是在养殖生产中,也常因饵料供应不足、适口性差、或天气和技术等原因而造成不规则停食,导致饥饿发生。饥饿是影响鱼类生长、发育的重要环境因子,近年来饥饿对鱼类生长和生理生化影响的研究已成为鱼类消化生理学研究的重要领域,但饥饿对鱼类消化系统形态学和组织学的影响研究尚不多,对斜带石斑鱼Epinephelus coioides[1]、哲罗鱼Hucho taimen[2]、褐菖鲉Sebastiscus marmoratus[3]等的研究结果均表明,饥饿或营养不足对鱼类消化系统组织结构具有显著影响。因此,消化系统形态学和组织学的研究是鱼类消化生理研究中最直观的方法之一,可较好地反映鱼类的营养状况,对这一领域的研究有助于了解鱼类适应饥饿胁迫的生态对策,对渔业资源管理及水产养殖等方面的实践具有重要的指导意义。
卵形鲳鲹Trachinotus ovatus隶属鲈形目Perciformes、鲹科 Carangidea、鲳鲹亚科 Trachinotinae、鲳鲹属,俗称黄腊鲳、金鲳,为暖水性鱼类,分布于印度洋、印度尼西亚、澳洲、日本、美洲的热带及温带的大西洋海岸及中国的黄渤海、东海、南海[4],是中国南方重要的优质海水养殖鱼类。目前,国内外学者对卵形鲳鲹的繁殖、发育、养殖、良种选育、营养、病害、基础生物学、生理生态等方面已进行了较深入、系统、全面的研究[4-12],其中,在消化生物学方面,卵形鲳鲹消化道的形态和组织学[13]、仔稚幼鱼消化系统的胚后发育[14]、以及消化酶活性的研究[15]等已有报道,在饥饿生物学方面,许晓娟等[16-17]研究了延迟投饵、饥饿和再投喂对仔鱼摄食和生长的影响,苏慧等[18]研究了饥饿对幼鱼存活和消化酶活力的影响。本文研究饥饿胁迫对卵形鲳鲹幼鱼消化器官组织学的影响,揭示其在饥饿状态下的形态和组织学结构变化和耐受饥饿的能力,为渔业生产中制定合适的投饲策略提供参考资料。
1 材料与方法
1.1 实验材料与驯养管理
试验用鱼为本所人工繁殖、孵化,经人工培育后达到体长 (4.73±0.47)cm、体质量 (2.97±0.79)g的卵形鲳鲹健康幼鱼。试验在规格为50 cm×30 cm×30 cm的水族箱中进行,实验用海水经沉淀和砂滤,水温 (25±0.5)℃,盐度 (20±1)‰,pH 7.8~8.5。试验开始前将幼鱼在实验室内驯养1周至幼鱼状态稳定,驯养期间每日8:30和18:30投喂金鲳鱼膨化颗粒饲料2次,每次达饱食;自然光照,每日换水、清污1次,每次换相同盐度海水2/3,换水温差在±1℃以内,连续充气,溶解氧为5 mg·L-1左右。
1.2 实验设计
随机取健康幼鱼375尾,以正常摄食组为对照组 (饥饿0 d),再设饥饿时间分别为3、6、9、12 d的4个饥饿处理组,每组3个平行,每个平行25 ind,分别放置于15个水族箱中。实验用水的水质和日常管理与驯养期间相同。
1.3 实验方法
在实验开始前和饥饿结束时分别取样,每组随机取4 ind幼鱼,解剖并取其食道、胃、幽门盲囊、肠、肝脏,用Bouin'S液固定24 h以上。固定样品经梯度酒精冲洗至淡黄色,用Leica4-2-429自动脱水机进行脱水、透明、浸蜡,Leica-EG1160组织包埋机进行石蜡包埋,Leica转轮式切片机连续切片,厚度为5 μm,Leica-AUTO-STAINER·XL染色机进行常规 H.E染色,中性树胶封片,ZEISS Scope.A1显微镜观察、拍照,测量的数据为随机测定10~20个平行数据的平均值。
1.4 数据处理
采用SPSS13.0软件对测定所得数据进行单因素方差分析 (One-Way ANOVA),用Duncan氏多重比较法分析各组间的差异显著性。描述性统计结果用“平均值±标准差”表示,P<0.05表示具有显著性差异,P<0.01表示差异极显著。
2 结果
2.1 饥饿胁迫对卵形鲳鲹幼鱼食道组织结构的影响
食道前端接于口咽腔,后端接于胃的贲门部,基本的组织学结构由内向外分为4层:黏膜层、黏膜下层、肌层、浆膜 (图1:a)。食道与胃分界处可以清晰观察到“食道–胃”过渡区,过渡区前段黏膜上皮为复层扁平上皮,后段为单层柱状上皮且有大量杯状细胞分布其中 (图1:b)。固有膜与黏膜下层之间分界不明显。食道的肌层发达,内环外纵,环肌厚度明显大于纵肌,浆膜层由薄层结缔组织组成,位于食道的最外层。与对照组相比较,饥饿3 d卵形鲳鲹幼鱼食道组织结构变化不明显(图1:c);饥饿6 d和9 d食道上皮层细胞排列开始不规则,黏膜下层和肌肉层逐渐疏松,有少部分组织出现断裂的现象,但是程度较轻 (图1:d、e);饥饿12 d黏膜层上皮大部分脱落,很多部位断裂,上皮细胞排列不规则,细胞界限模糊 (图1:f)。
饥饿对卵形鲳鲹幼鱼食道管腔直径、管壁厚度、上皮层高度、皱襞高度和宽度、杯状细胞大小的影响见表1。随着饥饿时间的延长,食道管腔直径逐渐变窄,杯状细胞体积逐渐减小,管壁厚度、上皮层高度、皱襞高度和宽度逐渐下降。饥饿3 d各项可量指标略有下降,其中管壁厚度、皱襞高度、杯状细胞短径与对照组相比差异不显著 (P﹥0.05);饥饿6 d和饥饿9 d各项可量指标继续下降,其中皱襞高度和杯状细胞短径与对照组相比差异不显著 (P﹥0.05);饥饿12 d各项可量指标继续下降,除杯状细胞短径外其他指标与对照组相比差异显著 (P﹤0.05),并且大部分指标与饥饿第3天和第6天差异显著 (P﹤0.05)。

图1 饥饿前后卵形鲳鲹幼鱼食道组织的比较Fig.1 Comparison of histological structure of esophagus for juveniles of T.ovatus before and after starvation

表1 饥饿前后卵形鲳鲹幼鱼食道组织结构的变化1)Table 1 Changes in histological structure of esophagus after starvation for juveniles of T.ovatus
2.2 饥饿胁迫对卵形鲳鲹幼鱼胃组织结构的影响
胃的组织结构和食道一样由内向外分为4层,依次为黏膜层、黏膜下层、肌肉层和浆膜 (图2:a)。贲门部和盲囊部结构相似,黏膜上皮为单层柱状上皮,细胞排列紧密,细胞核位于基部,染色深,黏膜上皮凹陷形成胃小凹,含有少量空泡状杯状细胞。胃腺发达,为管状腺体,开口于胃小凹,腺细胞较周围细胞大,细胞核圆形,位于基部。胃幽门部皱襞高度和宽度较贲门部和盲囊部小。饥饿对胃贲门部、盲囊部和幽门部的影响相似,饥饿3 d胃的组织结构无明显变化 (图2:b);饥饿6 d黏膜层细胞排列疏松,细胞间隙大,上皮层有少部分脱落 (图2:c、d);饥饿9 d细胞界限不清楚,胃腺间的结缔组织增多,细胞排列疏松,上皮脱落情况较饥饿6 d的更严重 (图2:e、f);饥饿12 d黏膜层上皮大量脱落、断裂,胃腺明显减少 (图2:g)。
胃贲门部、盲囊部和幽门部的管腔直径、管壁厚度、上皮层高度、皱襞高度和宽度、肌肉层厚度随饥饿时间的变化情况见表2、表3和表4。随着饥饿时间的延长,胃贲门部、盲囊部和幽门部的管腔直径逐渐变窄,管壁厚度、上皮层高度、皱襞高度和宽度、肌肉层厚度逐渐下降。饥饿3 d,胃贲门部各项可量指标变化较明显,除皱襞宽度和肌肉层厚度外,其余各项与对照组相比差异显著 (P﹤0.05);胃盲囊部管腔直径变窄,上皮层高度、皱襞高度、皱襞宽度和肌肉层厚度下降,并与对照组差异显著 (P﹤0.05),管壁厚度略有下降,与对照组差异不显著 (P﹥0.05);胃幽门部管腔直径、管壁厚度、皱襞宽度变化不明显,与对照组差异不显著(P﹥0.05),上皮层高度、皱襞高度和肌肉层厚度下降明显,与对照组差异显著 (P﹤0.05)。饥饿6 d和9 d,除胃贲门部皱襞宽度、盲囊部管壁厚度和幽门部管腔直径外,其他各项可量指标下降明显,与对照组差异显著 (P﹤0.05),饥饿6 d和9 d之间差异不显著 (P﹥0.05)。饥饿12 d各项可量指标下降更加明显,与对照组差异显著 (P﹤0.05)。

表2 饥饿前后卵形鲳鲹幼鱼胃贲门部组织结构的变化1)Table 2 Changes in histological structure of cardiac stomach for juveniles of T.ovatus before and after starvation

表3 饥饿前后卵形鲳鲹幼鱼胃盲囊部组织结构的变化1)Table 3 Changes in histological structure of fundic stomach for juveniles of T.ovatus before and after starvation
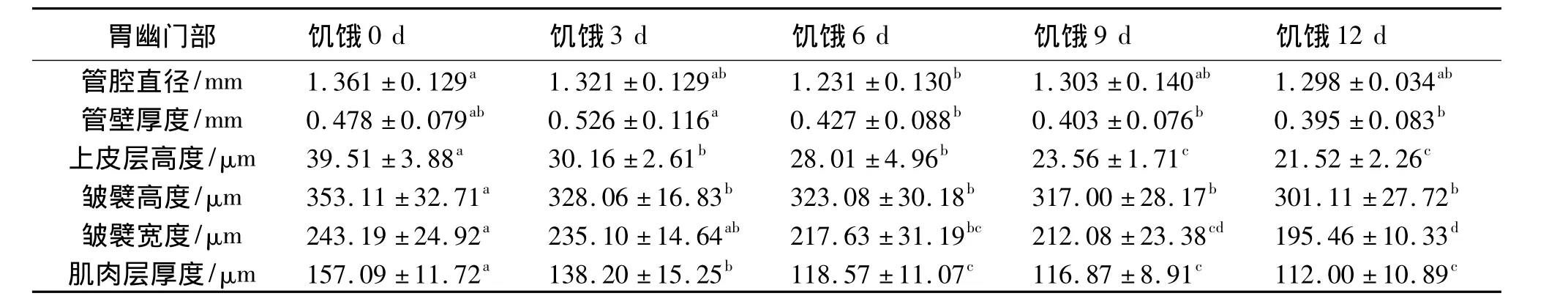
表4 饥饿前后卵形鲳鲹幼鱼胃幽门部组织结构的变化1)Table 4 Changes in histological structure of pyloric stomach for juveniles of T.ovatus before and after starvation
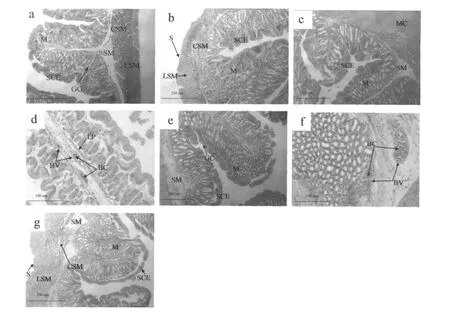
图2 饥饿前后卵形鲳鲹幼鱼胃组织的比较Fig.2 Comparison of histological structure of stomach for juveniles of T.ovatus before and after starvation
2.3 饥饿胁迫对卵形鲳鲹幼鱼幽门盲囊组织结构的影响
幽门盲囊位于胃幽门部与前肠交界处,幽门盲囊肌肉层很薄,黏膜下层和浆膜层极薄,黏膜皱襞多,上皮较厚,内含有大量嗜酸性颗粒细胞和空泡状杯状细胞 (图3:a、b)。嗜酸性颗粒细胞数量随饥饿时间的延长不断减少 (图3);饥饿3 d组织结构变化不明显 (图3:c);饥饿6 d和9 d黏膜层上皮组织间隙变大,黏膜下层结缔组织更加疏松 (图3:d、e);饥饿12 d细胞界限模糊,大量黏膜上皮出现脱落、断裂等 (图3:f)。
饥饿对卵形鲳鲹幼鱼幽门盲囊管腔直径、皱襞高度和宽度、杯状细胞大小的影响见表5。饥饿3 d管腔直径变窄,与对照组差异显著 (P﹤0.05),皱襞高度和宽度、杯状细胞长径和短径略有下降,与对照组相比差异不显著 (P﹥0.05);饥饿6 d管腔直径比饥饿3 d变宽,但比对照组窄,与饥饿3 d和对照组相比差异均不显著 (P﹥0.05),杯状细胞长径和短径略有下降,与对照组差异不显著(P﹥0.05),皱襞高度和宽度下降明显,与对照组差异显著 (P﹤0.05);饥饿9 d和12 d管腔直径、皱襞高度和宽度、杯状细胞长径和短径继续下降,与对照组差异显著 (P﹤0.05),饥饿9 d和12 d之间差异不显著 (P﹥0.05)。

图3 饥饿前后卵形鲳鲹幼鱼幽门盲囊组织的比较Fig.3 Comparison of histological structure of pyloric caeca for juveniles of T.ovatus before and after starvation

表5 饥饿前后卵形鲳鲹幼鱼幽门盲囊组织结构的变化1)Table 5 Changes in histological structure of pyloric caeca for juveniles of T.ovatus before and after starvation
2.4 饥饿胁迫对卵形鲳鲹幼鱼肠道组织结构的影响
卵形鲳鲹幼鱼肠道可分为前、中、后肠三部分,中肠管腔直径最小,前肠次之,后肠最大。肠道组织也由黏膜层、黏膜下层、肌层和浆膜层构成(图4:a、b、c)。黏膜层由单层柱状上皮组成,细胞排列紧密,细胞核圆形,位于细胞基底部。黏膜层和黏膜下层中含有大量血细胞,上皮细胞之间含有少量嗜酸性颗粒细胞和大量空泡状杯状细胞,杯状细胞数量从前肠至后肠逐渐增多。后肠的皱襞高度明显高于前肠和中肠。饥饿对肠道组织结构的影响明显,饥饿3 d前、中、后肠的组织结构无明显变化 (图4:d、e、f);饥饿6 d前肠和中肠的组织结构变化不明显 (图4:g、h),后肠的上皮细胞界限开始模糊,有些部位间隙变大,组织疏松(图4:i);饥饿9 d肠道各部分有不同程度的损伤,后肠更严重 (图4:j、k、l);饥饿12 d肠道上皮组织出现脱落、断裂等现象 (图4:m、n、o)。

图4 饥饿前后卵形鲳鲹幼鱼肠道组织的比较Fig.4 Comparison of histological structure of intestine for juveniles of T.ovatus before and after starvation
饥饿对卵形鲳鲹幼鱼前、中、后肠管腔直径、管壁厚度、上皮层高度、皱襞高度和宽度、杯状细胞大小的影响见表6-8。饥饿3 d,前肠管壁厚度、上皮层高度、皱襞高度和宽度、杯状细胞短径下降不明显,与对照组差异不显著 (P﹥0.05);中肠和后肠除上皮层高度和杯状细胞体积略有减小外其余指标无显著性差异 (P﹥0.05)。饥饿6 d和9 d,前肠管壁厚度和皱襞高度略有下降,与对照组差异不显著 (P﹥0.05),管腔直径、上皮层高度、皱襞宽度、杯状细胞体积下降明显,与对照组差异显著 (P﹤0.05);中肠和后肠的各项可量指标逐渐下降,与对照组差异显著 (P﹤0.05),饥饿6 d和9 d之间差异不显著 (P﹥0.05);饥饿12 d前、中、后肠各项可量指标下降更明显,与对照组差异显著 (P﹤0.05)。

表6 饥饿前后卵形鲳鲹幼鱼前肠组织结构的变化1)Table 6 Changes in histological structure of foregut for juveniles of T.ovatus before and after starvation
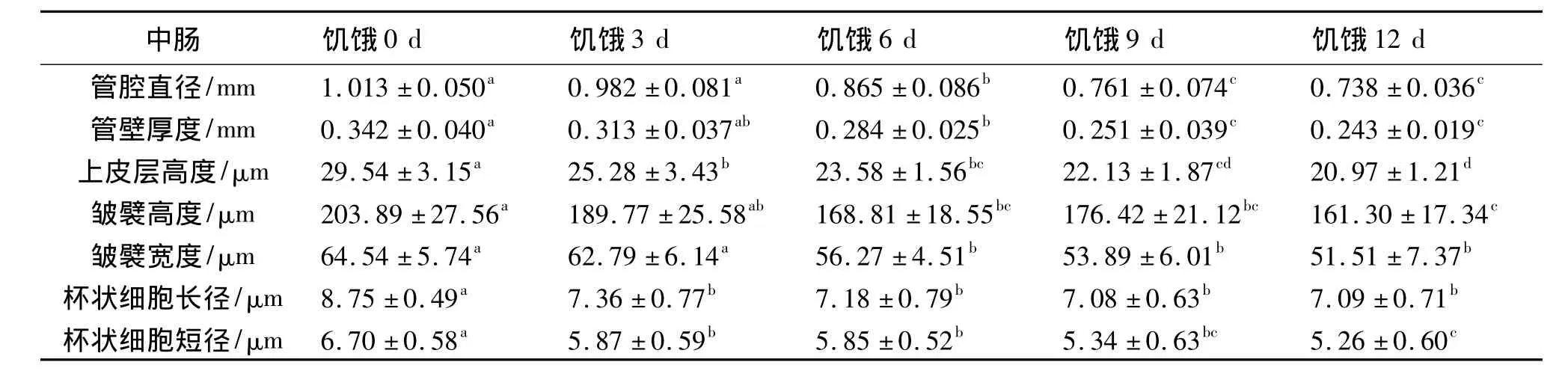
表7 饥饿前后卵形鲳鲹幼鱼中肠组织结构的变化1)Table 7 Changes in histological structure of midgut for juveniles of T.ovatus before and after starvation

表8 饥饿前后卵形鲳鲹幼鱼后肠组织结构的变化1)Table 8 Changes in histological structure of hindgut after starvation for juveniles of T.ovatus
2.5 饥饿胁迫对卵形鲳鲹幼鱼肝胰脏组织结构的影响
卵形鲳鲹的胰脏不均匀分布于肝脏中,称为肝胰脏,但是仍然是两个各自独立的器官,分泌物由各自的导管输送。肝脏最外面覆盖着一层浆膜,内部由无数的肝小叶所构成,肝细胞内充满体积较大的脂质空泡,细胞核被挤到一侧,肝细胞彼此相连,排列呈索状,以中央静脉为中心向外呈放射状排列。肝静脉窦明显,其内可见淋巴细胞、红细胞等 (图5:a、b、c)。
饥饿3 d和6 d肝细胞体积缩小,细胞内脂肪减少;血细胞数量增加,体积略有减小;胰腺泡细胞逐渐缩小 (图5:d、e、f);饥饿9 d肝细胞体积进一步缩小,肝组织变得疏松,细胞排列不规则,细胞界限模糊,肝静脉窦中出现大量黑色颗粒物质 (图5:g);饥饿12 d可见血管破裂,肝细胞血液浸润,血细胞体积减小,并出现降解现象,肝细胞几乎无细胞质,细胞界限模糊 (图5:h、i)。
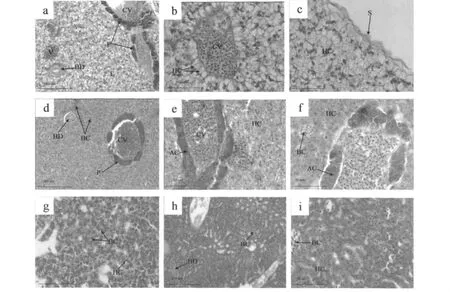
图5 饥饿前后卵形鲳鲹幼鱼肝胰脏组织切片Fig.5 Histological sections of hepatopancreas for juveniles of T.ovatus before and after starvation
3 讨论
3.1 卵形鲳鲹幼鱼消化道结构与功能的关系
卵形鲳鲹幼鱼消化道基本的组织结构由内向外分为4层:黏膜层、黏膜下层、肌层、浆膜。食道肌肉层较发达,环肌层厚度大于纵肌层,保证了食道迅速强大的收缩能力,利于将食物推向胃部。食道中含有大量皱襞,皱襞可以根据食物的大小和多少进行收缩和展平,有利于扩大食道管腔面积,便于食物的吞咽。食道上皮有大量杯状细胞,能分泌大量黏液,具有润滑食物、保护上皮细胞免受机械损伤和起到对食物的初步消化等作用,这与勾效伟等[19]对平鲷Rhabdosargus sarba消化系统形态学和组织学研究结果一致。
卵形鲳鲹幼鱼黏膜层上皮存在明显的“食道-胃”过渡区,并且过渡区后段有大量杯状细胞分布其中,杯状细胞可以分泌大量黏液和消化酶,对食物进行消化吸收,表明食道与胃在组织结构微观水平上具有一定的过渡性和连续性,并且食物的消化始于“食道-胃”过渡区,这与金头鲷Sparus aurata[20]、西 伯 利 亚 鲟Acipenser baerii[21]和 月 鳢Channa asiatica[22]等鱼类消化道组织学的研究结果相似。
与驼背鲈Cromileptes altivelis[23]胃的组织结构特点和功能相似,卵形鲳鲹幼鱼胃部肌肉层和胃腺都很发达,胃壁厚度、黏膜层明显大于其他部位,这增加了胃体的弹性和蠕动,当吞食大型食物时胃可以迅速膨大,并且促使食物和消化液充分接触,保证能充分地消化食物,特别是食物中的蛋白质。
卵形鲳鲹幼鱼幽门盲囊和肠道的组织结构相似,肠道细长,肠壁厚度比其他消化道部位薄,肠腔内分布密集的微绒毛,能显著增加肠道的消化、吸收面积,提高消化吸收效率。前肠和后肠肠腔直径大于中肠,前肠肠腔直径较大有利于大量食物在肠道暂时贮存,食物经前肠消化后大量减少,不需要中肠贮存,所以中肠肠腔直径较小,后肠肠腔直径较大,能够延长食物在肠腔中的停留时间,有利于食物进一步被消化吸收和食物残渣的排泄。黏膜层含有大量杯状细胞,从前肠到后肠杯状细胞数量逐渐增多,表明卵形鲳鲹幼鱼中肠的消化吸收能力大于前肠,这与鲻鱼Mugil cephalus[24]和湘云鲫Carassius auratus、湘云鲤Cyprinus carpio[25]的研究结果一致。
3.2 饥饿胁迫对卵形鲳鲹幼鱼消化器官组织结构和功能的影响
鱼类在饥饿过程中,由于缺乏外来营养,为了维持机体正常的生命活动,必须要消耗自身的机体组织,利用机体的蛋白质、脂肪等作为能量来源,必然会使机体组织器官发生不同程度的变化。过度的饥饿将导致机体、器官受损,生长抑制和死亡[26-27]。本研究结果表明,饥饿同样使卵形鲳鲹幼鱼的消化器官发生了不同程度的变化。3 d以内的短时间饥饿对卵形鲳鲹幼鱼消化器官组织结构影响不明显,随着饥饿时间延长,消化器官开始出现损伤,饥饿6~9 d对消化器官的损伤程度较轻,饥饿12 d消化器官损伤严重,例如消化道管腔变窄、变薄,黏膜上皮细胞界限变得模糊,上皮逐渐脱落、断裂,分泌细胞变小,等等。
短时间的饥饿对卵形鲳鲹幼鱼食道组织结构无明显影响,但随着饥饿时间的延长,食道黏膜上皮细胞界限开始模糊,上皮逐渐脱落、断裂。这与日本黄姑鱼Nibea japonica[28]、美国红鱼Sciaenops ocellatus[29]和施氏鲟Acipenser schrenckii[30]幼鱼的研究结果不同,这三种鱼在饥饿后食道组织结构未发生明显变化。这可能是不同种类的鱼对饥饿的耐受性不同所导致的。
饥饿对卵形鲳鲹幼鱼胃肠组织结构具有明显影响,长时间的饥饿使上皮细胞界限模糊,排列不规则,黏膜层上皮与固有膜之间间隙变大、黏膜下层结缔组织变得更加疏松,上皮层出现断裂、脱落等;胃管腔直径、胃壁厚度、肌肉层厚度、上皮层高度、皱襞高度和宽度等随饥饿时间的延长,都有不同程度的降低。饥饿对美国红鱼[29]和南方鲇Silurus meridionalis[31]的影响与上述结果相似,饥饿后,这两种鱼都出现了胃皱襞和上皮细胞变小,胃腺和黏膜下层厚度明显减小等现象。但是也有部分鱼类的研究结果不同,如Macleod[32]的研究发现,饥饿48 d后虹鳟Oncorhynchus mykiss胃组织结构无明显变化。饥饿对卵形鲳鲹幼鱼后肠的损害程度较前、中肠严重,这与饥饿对斜带石斑鱼[1]的影响有所不同。卵形鲳鲹幼鱼肠腔直径、肠壁厚度、上皮层高度、皱襞高度和宽度、杯状细胞大小等随饥饿时间的延长均不同程度降低,这与饥饿对日本黄姑鱼[28]、美国红鱼[29]、施氏鲟[30]幼鱼和南方鲇[33]的影响基本一致。
卵形鲳鲹幼鱼肝胰脏的损伤程度要较胃肠明显,饥饿第3天可以清晰的观察到肝胰脏内脂肪明显减少,说明卵形鲳鲹幼鱼在饥饿过程中首先利用肝胰脏中的脂肪来补充自身的能量需要;随着饥饿时间延长,肝细胞受损伤并且损伤程度愈来愈严重。这与日本黄姑鱼[28]和美国红鱼[29]的研究结果相似。
[1]宋海霞,翁幼竹,方琼珊,等.斜带石斑鱼幼鱼饥饿前后胃肠道的组织学研究[J].台湾海峡,2008,27(1):74-78.
[2]张永泉,刘奕,徐伟,等.饥饿对哲罗鱼仔鱼形态、行为和消化器官结构的影响[J].大连海洋大学学报,2010,25(4):330-336.
[3]江丽华,朱爱意,苑淑宾.饥饿对褐菖鲉消化道指数及消化酶活力的影响[J].水产科学,2011,30(4):187-191.
[4]区又君,李加儿.卵形鲳鲹的早期胚胎发育[J].中国水产科学,2005,12(6):786 -789.
[5]区又君,何永亮,李加儿.卵形鲳鲹胚后发育阶段鳃的分化和发育[J].中国水产科学,2012,19(1):13-21.
[6]吉磊,区又君,李加儿.卵形鲳鲹3个养殖群体的微卫星多态性分析[J].热带海洋学报,2011,30(3):62-68.
[7]杜强,林黑着,牛津,等.卵形鲳鲹幼鱼的赖氨酸需求量[J].动物营养学报,2011,23(10):1725-1732.
[8]黄忠,林黑着,牛津,等.肌醇对卵形鲳鲹生长、饲料利用和血液指标的影响[J].南方水产科学,2011,7(3):39-44.
[9]许海东,区又君,郭志勋,等.神经坏死病毒对卵形鲳鲹的致病性及外壳蛋白基因序列分析[J].上海海洋大学学报,2010,19(4):482 -488.
[10]XU HAIDONG,FENG JUAN,GUO ZHIXUN,et al.Detection of red-spotted grouper nervous necrosis virus by loop-mediated isothermal amplification[J].J of Virological Methods,2010,163(1):123 –128.
[11]王刚,李加儿,区又君,等.温度、盐度、pH对卵形鲳鲹幼鱼离体鳃组织耗氧量的影响[J].南方水产科学,2011,7(5):37 -42.
[12]王刚,李加儿,区又君,等.环境因子对卵形鲳鲹幼鱼耗氧率和排氨率的影响[J].动物学杂志,2011,46(6):80-87.
[13]区又君,李加儿,勾效伟.卵形鲳鲹消化道的形态学、组织学和组织化学[J].大连海洋大学学报,2012,27(1):38-43.
[14]区又君,何永亮,李加儿.卵形鲳鲹消化系统的胚后发育[J].台湾海峡,2011,30(4):533 -539.
[15]区又君,罗奇,李加儿,等.卵形鲳鲹消化酶活性的研究Ⅰ.成鱼和幼鱼消化酶活性在不同消化器官中的分布及其比较[J].南方水产科学,2011,7(1):50-55.
[16]许晓娟,区又君,李加儿.延迟投饵对卵形鲳鲹早期仔鱼阶段摄食、成活及生长的影响[J].南方水产,2010,6(1):37 -41.
[17]许晓娟,李加儿,区又君.卵形鲳鲹仔鱼的饥饿和补偿生长[M]∥王清印.生态系统水平的海水养殖业.北京:海洋出版社,2010:221-226.
[18]苏慧,区又君,李加儿,等.卵形鲳鲹消化酶活力的研究Ⅵ饥饿对幼鱼存活和消化酶活力的影响[J].海洋渔业,2012,34(1):45 -50.
[19]勾效伟,区又君,廖锐.平鲷消化系统形态学、组织学及组织化学研究[J].南方水产,2008,4(5):28 -36.
[20]CATALDI E,CATAUDELLA S,MONACO G,et al.A study of the histology and morphology of the digestive tract of the sea-bream,Sparus aurata[J].Journal of Fish Biology,1987,30(2):135-145.
[21]陈宁宁,章龙珍,庄平,等.西伯利亚鲟消化道形态学和组织学的初步研究[J].海洋渔业,2011,33(1):20-27.
[22]阮国良,杨代勤,严安生,等.月鳢消化系统形态及组织学的研究[J].湖北农学院学报,2004,24(3):185-189.
[23]区又君,勾效伟,李加儿.驼背鲈消化系统组织学与组织化学研究[J].海洋渔业,2011,33(3):289-296.
[24]于娜,李加儿,区又君.野生鲻鱼和养殖鲻鱼消化系统的组织学观察[J].海洋渔业,2011,33(2):151 -158.
[25]刘飞,张轩杰,刘少军,等.湘云鲫、湘云鲤消化道的组织学研究[J].中国水产科学,2001,8(3):23 -27.
[26]区又君,刘泽伟.饥饿和再投喂对千年笛鲷幼鱼消化酶活性的影响[J].海洋学报,2007,29(1):88-91.
[27]区又君,刘泽伟.千年笛鲷幼鱼的饥饿和补偿生长[J].水产学报,2007,31(3):323 -328.
[28]楼宝,史会来,骆季安,等.饥饿和再投喂对日本黄姑鱼代谢率和消化器官组织学的影响[J].海洋渔业,2007,29(2):140-147.
[29]李霞,姜志强,谭晓珍,等.饥饿和再投喂对美国红鱼消化器官组织学的影响[J].中国水产科学,2002,9(3):211-214.
[30]高露姣,陈立侨,赵晓勤,等.施氏鲟幼鱼的饥饿和补偿生长研究—对消化器官结构和酶活性的影响[J].中国水产科学,2004,11(5):413 -419.
[31]付世健,邓利,张文兵,等.南方鲇幼鱼胃和肝脏的组织结构及其在饥饿过程中的变化[J].西南师范大学学报:自然科学版,1999,24(3):336 -342.
[32]MACLEOD M G.Effects of salinity and starvation on the alimentary canal anatomy of the rainbow troutSalmo gairdneriRichardson[J].Journal of Fish Biology,1978,12(1):71-79.
[33]宋昭彬,何学福.饥饿对南方鲇仔稚鱼消化系统的形态和组织学影响[J].水生生物学报,2000,24(2):155-160.
——奇妙的蛋

