老年大鼠海马细胞凋亡和神经元信号转导通路的变化与学习记忆的关系
王 暖 耿德勤 黄红莉 周 昊 杨秀华 (徐州市第一人民医院神经内科,江苏 徐州 22002)
衰老与海马细胞凋亡以及神经元存活信号转导通路的变化有着密切联系,但众说不一。磷脂酰肌醇3-激酶 (PI3K)-AKt-Caspase-9信号转导途径是细胞内重要的信号转导通路,在细胞的凋亡、存活、增殖以及细胞骨架的变化等活动中发挥重要的生物学功能,其中尤为重要的是它对细胞凋亡、存活的调节作用〔1,2〕。而老年大鼠是否存在 PI3K-AKt-Caspase-9信号转导通路的障碍,尚不十分清楚。本研究探讨老年大鼠海马组织细胞凋亡、PI3K-AKt-Caspase-9信号转导通路与学习记忆的关系。
1 材料与方法
1.1 实验动物及主要试剂和仪器 健康SD大鼠:青年鼠(8月龄,200~250 g),老年鼠(24月龄,450~500 g)各8只,雌雄各半,由徐州医学院实验动物中心提供。Caspase-9 P35抗体、PI3K P85抗体、AKt抗体、p-AKt(ser473)抗体及二抗均购自美国Santa Cruz公司,p(Tyr)-PI3K P85抗体购自美国cell signaling公司,Y型迷宫、免疫组化试剂盒和TUNEL试剂盒均购自国内。
1.2 学习记忆能力测试 两组大鼠分别进行Y型迷宫实验。连续10次电击中有9次正确为达到学会标准,记录动物达到标准所需电击的次数,以此作为学习快慢程度的指标,24 h后重复以上实验过程,观察大鼠的记忆能力。
1.3 TUNEL染色和免疫组化染色 Y迷宫测试24 h后留取8只(每组4只)大鼠麻醉,仰卧于固定台上,暴露心脏,经左心室插入导管至升主动脉,剪开右心耳,先快速灌注生理盐水100~150 ml,再灌注4℃4%多聚甲醛300 ml,然后断头取脑,在视交叉后1 mm及4 mm处以冠状切面切开鼠脑留取中间切块,入4%多聚甲醛中后固定24~48 h,然后按以下程序进行:固定后组织块经流水冲洗1~1.5 h,80%、95%、100%梯度酒精脱水,二甲苯透明,浸蜡,包埋,每一组织块作5 μm的连续切片,贴于载玻片,60℃ ~70℃烤片6 h以上以备TUNEL法染色和免疫组化染色。染色方法按试剂盒说明书进行。在400倍镜下左侧海马区随机取5个不重叠的视野进行TUNEL、p-PI3K P85、p-AKt和Caspase-9 P35阳性神经元计数(个/视野),结果取5个视野的平均值。
1.4 Western印迹 余8只大鼠冰浴上断头取脑,剥离双侧海马进行组织匀浆;离心15 min;取上清用lowary法测蛋白含量;分装,-20℃冻存备用;取30 μl蛋白在SDS-PAGE胶中电泳;之后将蛋白质转至NC膜;取出膜后用BSA封闭室温下振摇3 h,以阻断非特异性结合;再分别加入1∶200稀释的一抗(p-PI3K P85、P-AKt、PI3K P85、AKt、Caspase-9 P35)4℃ 孵育过夜;反应完后二抗温育2 h,AP显色系统显色。
2 结果
2.1 大鼠学习及记忆能力比较 与青年大鼠相比,老年大鼠学习尝试次数明显增加,记忆正确次数明显减少,差异均有极显著性(P<0.01)。见表1。
表1 两组大鼠学习及记忆能力比较(± s,n=8)
与青年组比较:1)P<0.01
组别 学习尝试次数(次) 记忆正确次数(次)青年组50.0±6.3 7.7±0.5老年组 75.0±5.51) 4.0±0.91)
2.2 大鼠海马区TUNEL阳性神经元数比较 青年大鼠海马区未见TUNEL阳性神经元。老年大鼠可见到较多TUNEL阳性神经元(36.3±1.1),其细胞核固缩深染,呈现棕黄色,与青年组相比,差异有极显著性(P<0.01)。见图1。
2.3 免疫组化染色结果 青年组海马区可见较多p-PI3K、p-AKt阳性表达细胞,其染色深,胞浆着色呈棕黄色。老年组海马区阳性表达细胞明显减少,与青年组相比,差异有极显著性(P<0.01)。青年组海马区偶见Caspase-9P35阳性神经元。老年组海马区可见较多Caspase-9P35阳性表达细胞,其染色深,棕黄色颗粒主要沉积在胞核周围,与青年组相比,差异有极显著性(P<0.01)。见表2,图2~图4。

图2 大鼠海马P-PI3表达(DAB,×400)

图3 大鼠海马p-AKt表达(DAB,×400)

图4 大鼠海马Caspase-9P35表达(DAB,×400)
表2 两组大鼠海马区p-PI3K、p-AKt、Caspase-9p35阳性神经元数比较(±s,n=4,个/视野)
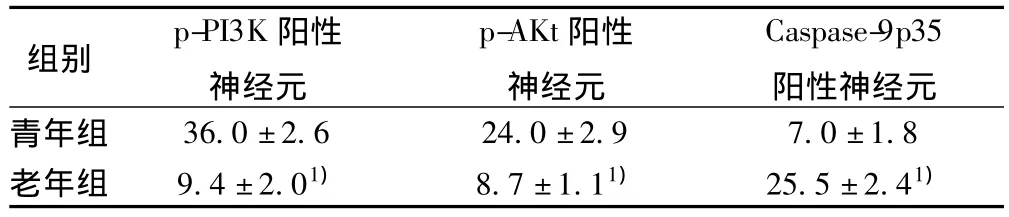
表2 两组大鼠海马区p-PI3K、p-AKt、Caspase-9p35阳性神经元数比较(±s,n=4,个/视野)
与青年组比较:1)P<0.01
组别p-PI3K阳性神经元p-AKt阳性神经元Caspase-9p35阳性神经元青年组36.0±2.6 24.0±2.9 7.0±1.8老年组 9.4±2.01) 8.7±1.11) 25.5±2.41)
2.4 Western印迹结果 与青年组相比,老年组海马区p-PI3K、p-AKt的活性明显降低,Caspase-9p35蛋白表达明显增加(P<0.01);PI3K、AKt蛋白表达在两组之间变化无统计学意义。见图5。
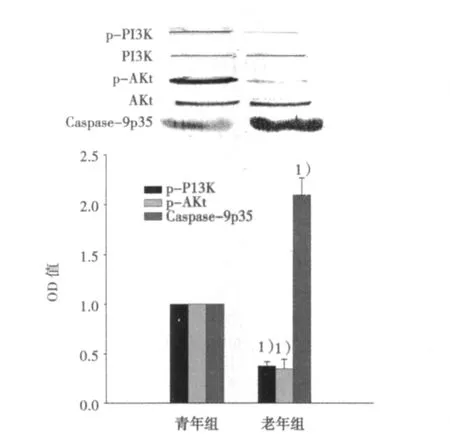
图5 两组大鼠海马组织p-PI3K、PI3K、p-AKt、AKt及Caspase-9p35蛋白表达
3 讨论
近年来在细胞生物学和分子生物学迅速发展的推动下衰老机理的研究已取得了重大进展,其中最具有代表性的学说有:自由基学说、线粒体DNA损伤学说、端粒学说和基因学说〔3,4〕。大量资料显示,衰老大鼠不但出现基底前脑胆碱能神经元的丢失、海马的胆碱能纤维减少和胆碱乙酰转移酶(ChAT)活性下降,而且出现学习记忆障碍。在本研究中,使用Y型电迷宫评价了老年鼠的学习记忆功能,表现为学习尝试次数明显增多,记忆正确次数明显减少,结果表明老年大鼠发生了严重的学习记忆障碍。
有证据表明,在老化过程中存在着神经细胞的凋亡,表现为一些部位神经细胞的减少、细胞对外界刺激不可修复的生物学反应和细胞不能够对生存信号起反应最终导致死亡的一种生物学过程〔5〕等。衰老机体生长因子合成降低、跨膜信号缺陷、控制细胞增殖的特殊基因表达缺陷,不能对付氧化应激,使得衰老机体易于激发凋亡过程〔6〕。在中枢神经系统中,神经生长因子(NGF)等因子与其相应受体结合〔7〕,启动PI3K信号转导途径,通过PI3K-Akt-caspase-9通路,使神经元存活并维持正常功能。PI3K/AKt通路是一个公认的细胞存活通路,介导多种生长因子的生物学效应,如促细胞存活、诱导细胞分化和促细胞生长等〔8~10〕,是抗凋亡、促进细胞增殖的重要信号途径〔11,12〕。caspase-9 是活化的 AKt主要下游靶蛋白,完整的caspase-9即procaspase-9为46 000多肽是没有活性的前蛋白,激活后裂解为37000或35000的活性片段〔13〕。本实验检测的就是有活性的片段caspase-9 p35。Perianayagam等〔14〕注意到,C5a处理的中性粒细胞中caspase-9活性在加入PI3K抑制物Wortmannin后显著提高。当各种原因引起神经存活因子减少或损伤性因素增加时,对信号传导通路的刺激减弱,使多种维持神经元存活的重要蛋白不能随之激活,由此引起神经元功能减退和细胞凋亡进而影响大鼠的认知功能〔15〕。本实验结果说明老年大鼠海马神经元存在着PI3K-Akt-caspase-9信号转导通路的障碍,可能是导致老年大鼠海马神经细胞凋亡、学习记忆功能衰退的重要机制。
总之,老年鼠在衰老过程中,由于PI3K-Akt-caspase-9信号转导通路的障碍,导致海马神经元凋亡,由于海马是动物学习、记忆的重要神经解剖学结构〔16〕,故导致学习记忆能力下降。
1 Brozovic A,Osmak M.Activation of mitogen-activated protein kinases by cisplatin and their role in cisplatin-resistance〔J〕.Cancer Lett,2007;251(1):1-16.
2 Corradetti MN,Guan KL.Upstream of the mammalian target of rapamycin:do all roads pass through mTOR〔J〕?Oncogene,2006;25(48):6347-60.
3 Migliore L,Coppede F.Environmental-induced oxidative stress in neurodegenerative disorders and aging〔J〕.Mutat Res,2009;674(1/2):73-84.
4 Pascale A,AmadioM,Govoni S,et al.The aging brain,a key target for the future:the protein kinase C involvement〔J〕.Pharmacol Res,2007;55(6):560-9.
5 Dickstein DL,Kabaso D,Rocher AB,et al.Changes in the structural comp lexity of the aged brain〔J〕.Aging Cell,2007;6(3):275-84.
6 Ohyagi Y,Asahara H,Chui DH,et al.Intracellular Aβ42 activates p53 promoter:a pathway to neurodegeneration in Alzheimer's disease〔J〕.FASEB J,2005;19(2):255-7.
7 Salminen A,Kaarniranta K.Insulin/IGF-1 paradox of aging:regulation via AKT/IKK/NF-kappaB signaling〔J〕.Cell Signal,2010;22(4):S73-7.
8 Chen YL,Law PY,Loh HH.Nuclear factor kappaB signaling in opioid functions and receptor gene expression〔J〕.J Neuroimmune Pharmacol,2006;1(3):270-9.
9 Wong ML,Kaye AH,Hovens CM.Targeting malignant glioma survival signalling to improve clinical outcomes〔J〕.Clin Neurosci,2007;14(4):301-8.
10 Zhao L,Vogt P K.Class I P I3K in oncogenic cellular transformation〔J〕.Oncogene,2008;27(41):5486-96.
11 Vanhaesebroeck B,Alessi DR.The PI3K-PDK1 connection:more than just a road to PKB〔J〕.Biochem J,2000;346(3):561-76.
12 Liu SL,Liu GZ,Cheng J,et al.Influence of PKB on ROS regulation of proliferation in human 7721 hepatoma cells〔J〕.Sheng Wu Hua Xue Yu Sheng Wu Wu Li Xue Bao(Shanghai),2002;34(1):67-72.
13 Mazumder S,Plesca D,Almasan A.Caspase-3 activation is a critical determinant of genotoxic stress-induced apoptosis〔J〕.MethodsMol Biol,2008;(414):13-21.
14 Perianayagam MC,Balakrishnan VS,King AJ,et al.C5a delays apoptosis of human neutrophils by a phosphatidylinositol 3-kinase-signaling pathway〔J〕.Kidney Int,2002;61(2):456-63.
15 Salvesen GS,Riedl SJ.Caspase mechanisms〔J〕.Adv Exp Med Biol,2008;615(1):13-23.
16 Hernandez-Rabaza V,Llorens-Martin M,Velazquez-Sancherz C,et al.Inhibition of adult hippocampal neurogensis disrupts contextual learning but spares spatial working memory long-term conditional rule retention and spacial reversal〔J〕.Neuroscience,2009;159(1):59-68.

