8-溴-7-甲氧基白杨素对Huh-7细胞系肝癌干细胞样细胞自我更新的影响
周 蓓,肖立红,肖 荞,任凯群,曹建国
(湖南师范大学医学院,湖南 长沙 410013,)
随着癌症发病机制研究的不断深入,"肿瘤干细胞(Cancer Stem Cells,CSCs)"学说已经得到普遍接受[1]。已有研究证实CSCs存在肝细胞癌中[2],并且被认为是肿瘤发生、发展、复发、转移和耐药的根源。因此,分离、纯化和鉴别LCSCs,研发针对LCSCs的治疗药物和方案有望彻底治愈HCC[3]。
8-溴-7-甲氧基白杨素 (8-bromo-7-methoxychrysin,BrMC)是我们自主设计和合成的具有抑制多种肿瘤细胞生长作用的新型白杨素衍生物[4-8],此外,还证实BrMC相对选择性诱导人肝癌SMMC-7721、HepG2、Bel-7402细胞系细胞凋亡,而对人胚肝细胞系L-02影响小[8]。梁晨等采用干细胞条件培养基悬浮培养法获得人肝细胞癌Huh7细胞系肿瘤球形成细胞,鉴定发现其具有CSCs相关基因特征[9]。因此,本研究拟采用干细胞条件培养基悬浮培养法富集和扩增Huh7肝癌干细胞样细胞(LCSLCs),并探讨BrMC对LCSLCs增殖活性、自我更新能力和干细胞标志蛋白CD133表达的作用。
1 材料和方法
1.1 药品与试剂
8-溴-7-甲氧基白杨素(BrMC)根据文献[4]合成,经高效液相色谱法测定纯度为99.5%。氟尿嘧啶(5-FU,美国Sigma公司);高糖DMEM培养基、小牛血清、2%不含维生素A的B27、1%N2、胰蛋白酶 (美国 Invitrogen公司);DMEM/F12培养基、PBS磷酸盐缓冲液 (美国GIBCO公司);异硫氰酸荧光素(FITC)标记 CD133抗体(美国 Biolegend公司);6孔板低粘附细胞培养板 (ultra-low plates,美国BD公司);重组人成纤维细胞生长因子(bFGF,美国eBioscience公司);重组人重组表皮生长因子(EGF,美国eBioscience公司);以上试剂及耗材均购自湖南科泰生物技术公司(中国,长沙)。人胰岛素购自北京鼎国公司(中国,北京)。其余试剂为国产分析纯试剂。
1.2 人肝癌Huh-7细胞培养
人肝癌Huh-7细胞系细胞购自上海中国科学院细胞库(中国,上海)。用含10%胎牛血清、100IU/mL青霉素G和100 μg/ml链霉素的高糖DMEM细胞培养基,置37°C、饱和湿度的5%CO2培养箱培养。待细胞达到70%~80%汇合度,用0.25%胰蛋白酶消化细胞,并重新接种到新培养瓶中,按上述条件继续培养。
1.3 人肝癌Huh-7细胞干细胞条件培养基悬浮培养及肝癌球细胞传代培养
1.3.1 人肝癌Huh-7细胞干细胞条件培养基悬浮培养
取对数生长期Huh-7细胞,消化成单细胞悬液,800rpm离心5min去血清,弃上清,加入PBS洗涤1-2次,离心后以干细胞条件培养基 (添加100 IU/mL 青霉素 G、100 μg/mL 链霉素、20 ng/mL EGF、10 ng/mL bFGF、2%B27,1%N2、5 μg/ml 胰岛素的DMEM/F12培养基)悬浮培养于超低粘附6孔细胞培养板中,每孔接种细胞数不超过5000个细胞。每隔2d半量换入新鲜的干细胞条件培养基,直至球体达到50 μm直径大小(约为6天)。
1.3.2 人肝癌球形成细胞的传代培养
收集上述球体达到50 μm直径大小的肝癌球体细胞,300rpm离心5min,小心吸弃上清,加入0.05%EDTA-胰蛋白酶消化3min,加入干细胞培养基终止消化后,机械分散细胞成单细胞悬液,800 r/m离心5min去除消化酶,计数,重新悬浮于干细胞条件培养基中,以每孔不超过5000个细胞接种至超低粘附6孔细胞培养板中培养。
1.4 肿瘤球形成实验
收集第3代~第9代的肿瘤球细胞,消化成单细胞悬液后,将细胞密度稀释成1000个细胞/mL,以每孔2.0 mL接种至超低粘附6孔细胞培养板中,每隔2 d半量换入新鲜的干细胞条件培养基,待细胞球直径大于50 μm时,计数肝癌球形成数目。
1.5 MTT比色分析
取对数生长期Huh-7细胞,以20000个细胞/ml的密度接种于96孔细胞培养板,每孔100μL;同时收集第3代~第9代的肿瘤球细胞,用干细胞培养基调节细胞密度为10000个细胞/mL,每孔100μL接种于超低粘附96孔细胞培养板中。培养24 h,更换含终浓度为 5.0、10.0和20.0 μM BrMC相应的培养基,并以10.0 μM 5-FU作为化疗药物对照组,以0.1%DMSO作为溶媒对照组,培养72 h,吸除培养基,加入含0.5mg/mL的MTT的培养基,继续培养4 h。吸除培养基后每孔加入100 μL DMSO溶解紫蓝色沉淀。用Elx-800酶联免疫检测仪(美国Bio-Tek公司)在570nm波长处测定吸光度(absorbance,A)值(取3个复孔)。细胞活性相对抑制率按公式计算:相对抑制率 (IR%)=(1-实验组A570值/对照组A570)×100%。实验重复2次。
1.6 肿瘤球形成法测定BrMC对LCSLCs自我更新能力的影响
取对数生长期Huh-7细胞及第3代~第9代的肿瘤球细胞,以2000个细胞/孔接种于超低粘附96孔细胞培养板中,培养24 h,更换含终浓度为5.0、10.0和20.0 μM BrMC的干细胞条件培养基,并以10.0 μM 5-FU作为化疗药物对照组,以0.1%DMSO作为溶媒对照组,培养72 h。每隔3d半量换入新鲜的干细胞条件培养基,直至球体达到50 μm直径大小(第6天),倒置显微镜下计数肝癌Huh-7球体数目。以上实验重复2次。
1.7 荧光标记抗体FCM分析BrMC对LCSLCs细胞标记物CD133表达的影响
收集第3代~第9代的肿瘤球细胞,消化成单细胞悬液后,以2×105个细胞/孔接种于超低粘附6孔细胞培养板,培养24 h,更换含终浓度为5.0、10.0和20.0 μM BrMC的干细胞条件培养基,并以10.0 μM 5-FU作为化疗药物对照组,以0.1%DMSO作为溶媒对照组,培养24 h。收集细胞,调整密度至1×105/mL,分装于EP管中,FITC标记的小鼠抗人CD133抗体和FITC标记的鼠抗人IgG同型对照抗体避光4℃孵育30min,用流式细胞仪检测平均荧光强度,每管计数10000个细胞。实验重复2次。
1.8 统计学分析
实验数据录入SPSS 15.0 for windows evaluation软件(SPSS Inc,Chicago,IL),建立数据库,各组实验数据均用均数±标准差(mean±SD)表示,用One Way ANOVA方式行方差分析。首先进行方差齐性检验,当方差齐性时,各组均数间的两两比较用LSD法,如果方差不齐,对照组均数与实验组均数间的比较用Dunnett法,P<0.05为差异具有统计学意义。
2 结果
2.1 人肝癌Huh-7细胞系中LCSCs的富集与扩增
如图1所示,体外培养和扩增人肝癌Huh-7细胞系后,以干细胞条件培养基,在低粘附细胞培养6孔板中悬浮培养6天,细胞呈现典型非粘附三维球状生长,此与梁晨等人[9]的研究结果相符。因此,在本研究中,我们定义干细胞条件培养基悬浮培养得到的肝癌球形成细胞为LCSLCs,并作为后续实验的受试对象。
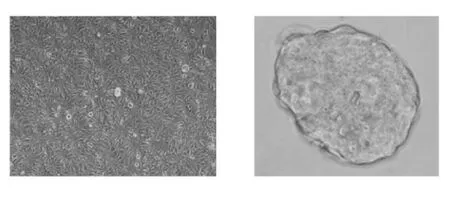
图1 人肝癌Huh-7细胞系细胞成球培养
2.2 BrMC抑制LCSLCs和亲本肝癌Huh-7细胞活性作用的比较
MTT比色法分析表明,与溶媒组(0.1%DMSO)相比,不同浓度的 BrMC(5.0、10.0 和 20.0 μM)均能有效抑制LCSLCs的细胞增殖活性(P<0.05);并且与相同浓度 BrMC(5.0、10.0 和 20.0 μM)处理的人肝癌Huh-7细胞系细胞相比,BrMC对LCSLCs的细胞增殖活性抑制作用更强,并且呈浓度依赖性(P<0.05,图2)。说明BrMC优先抑制Huh-7细胞系成球细胞的增殖活性。
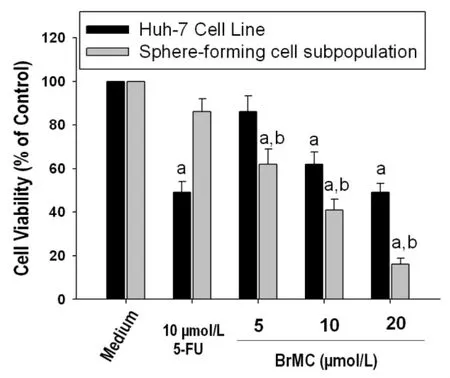
图2 BrMC优先抑制肝癌Huh-7细胞系成球细胞增殖活性
数据为3次实验的均数±标准差,n=9;a,与0.1%DMSO组比较P<0.05;b,与相同浓度BrMC处理人肝癌Huh-7细胞系细胞比较P<0.05。
2.3 BrMC抑制LCSLCs和亲本肝癌Huh-7细胞自我更新能力的比较
如图3所示,与溶媒组(0.1%DMSO)相比,三种浓度的 BrMC(5.0、10.0 和 20.0 μM)均能有效抑制LCSLCs的肿瘤球形成数 (P<0.05,图3);并且与10.0 μmol/L 5-FU处理组比较,差异具有统计学意义(P<0.05,图3)。说明BrMC能显著抑制 LCSLCs的自我更新能力。
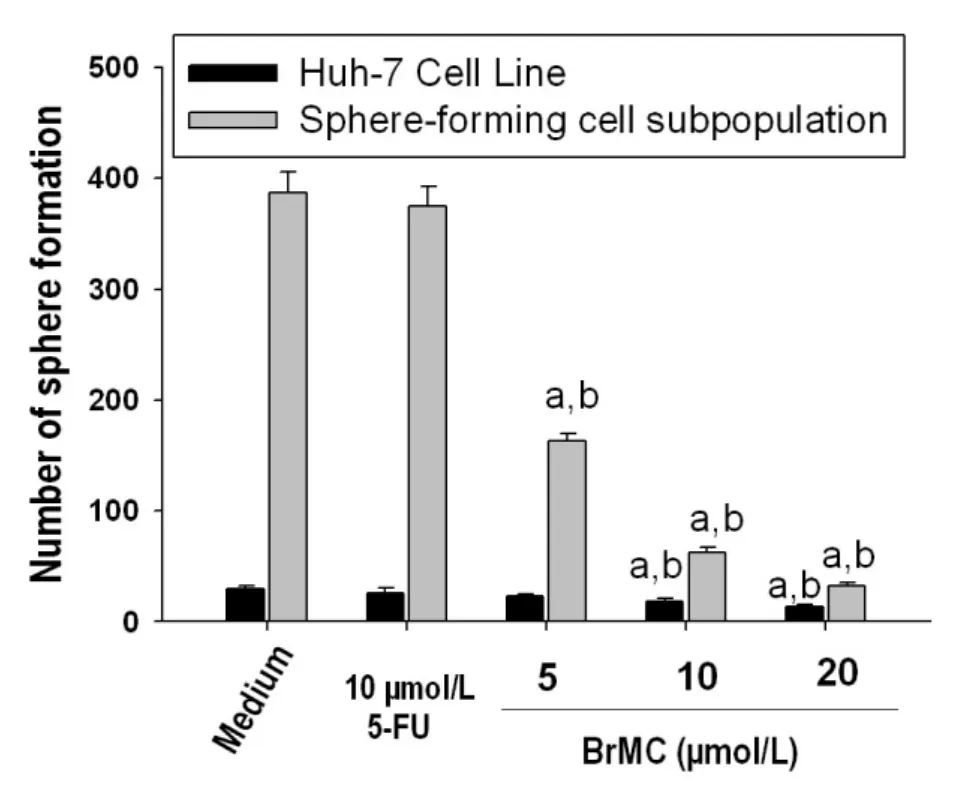
图3 BrMC相对选择性抑制LCSLCs自我更新(肝癌球形成)能力
数据为3次实验的均数±标准差,n=3,a,与0.1%DMSO 组比较,P<0.05;b,与 10.0 μmol/L 5-FU处理组比较,P<0.05。
2.4 BrMC抑制LCSLCs细胞CD133的表达
FITC-CD133标记FCM分析表明,LCSLCs中CD133表达水平明显高于亲本Huh-7细胞 (P<0.05,图4),并且与空白组细胞相比,BrMC浓度为5.0、10.0和20.0 μM 时均能减少 LCSLCs的CD133表达,差异具有统计学意义(P<0.05,图4)。说明肿瘤形成细胞高表达干细胞标记蛋白CD133,且BrMC显著抑制LCSLCs中CD133的表达。
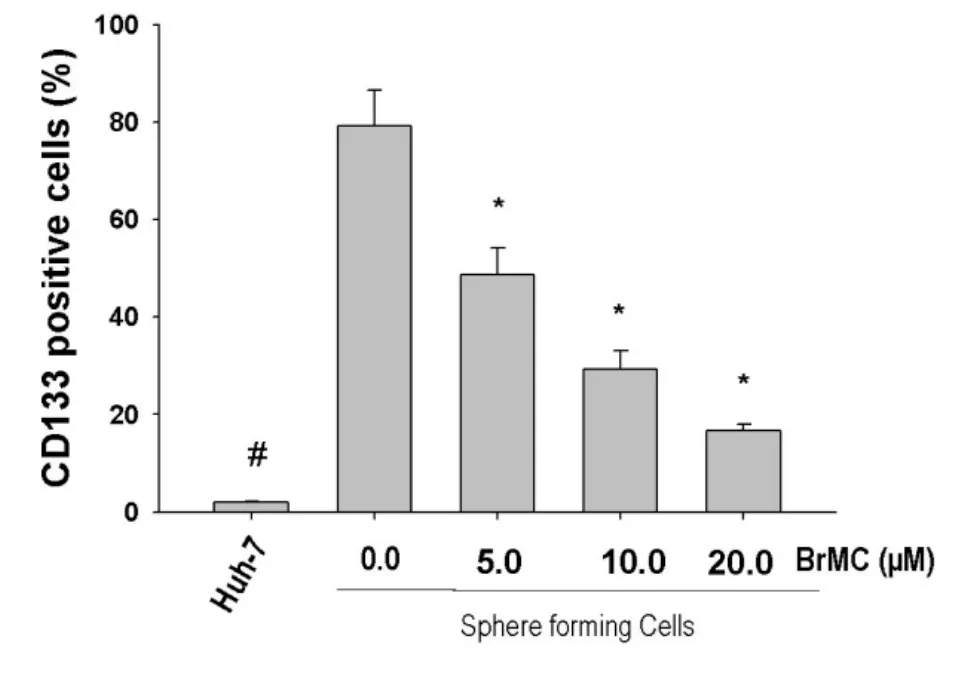
图4 BrMC对LCSLCs细胞CD133蛋白表达的影响
3 讨论
肝细胞癌(Hepatocellular carcinoma,HCC)是全球第五大恶性肿瘤,每年导致近百万人死于该疾病。目前常用的临床方法包括肝切除术、肝移植术、动脉化疗栓塞法(TACE)、放/化疗等,但任何治疗方法后的肿瘤高复发率仍是人们所关注的焦点[10,11]。CSCs假说的形成无疑为肿瘤研究工作者们提供了新的视野,一系列靶向CSCs的治疗方法的发现使人们看到彻底根治肿瘤的希望,但如何有效鉴别CSCs仍是亟需解决的难题。肿瘤球悬浮培养法是基于CSCs特殊的功能性质筛选CSCs的一种有效方法。早在1992年发现无血清培养条件下维持神经元未分化的干细胞状态,并且添加EGF、bFGF等生长因子后可使干细胞增殖,并呈现悬浮球状生长[12],此后,这种非锚着的干细胞肿瘤球培养方法成功运用于乳腺癌、结直肠癌、肝癌等多种成体干细胞的鉴定[13]。梁晨等应用该方法获得Huh7细胞球并对其进行鉴定,发现Huh7细胞球具有肿瘤干细胞特性[9]。在本研究中,我们以干细胞条件培养系统从体外培养的人肝癌Huh-7细胞系中成功分离和富集典型非粘附生长的球状细胞,这些结果与梁晨等人[9]的研究结果相符。
CD133是一种具有5个跨膜结构的糖蛋白,在正常干细胞和癌组织中均有所表达,在包括肝细胞癌的许多实体肿瘤中,作为一种干细胞标记物用于CSCs的分离和鉴定[14]。CD133+Huh7细胞表现出许多类似干细胞的性质,包括集落形成、自我更新和分化能力、以及在体内比CD133-细胞更强的肿瘤诱导形成能力,并且CD133+赋予HCC的 CSCs放/化疗耐受性[15]。Lan等人通过慢病毒介导的短发夹RNA(shRNA)转染LCSLCs发现,沉默CD133的表达显著抑制LCSLCs的细胞增殖、肿瘤球形成和NOD/SCID小鼠异种移植肿瘤的能力,并增敏LCSLCs对化疗和放疗的敏感性[16]。因此,CD133不仅是鉴定CSCs的重要标记蛋白,同时也是潜在的治愈肝细胞癌的靶点。
在本研究中,我们通过FITC-CD133标记FCM证实:与亲本Huh-7细胞相比,LCSLCs高表达干细胞表面标记蛋白 CD133(79.2±6.04%vs.2.11% ±0.10,进一步证实干细胞条件悬浮培养法富集得到的球体细胞具有肿瘤干细胞特性。BrMC(5.0、10.0和20.0 μM)均能有效下调LCSLCs CD133阳性表达率(CD133阳性细胞数分别为48.7±4.49%,29.4±2.98%,16.7±1.14%)。 此外,BrMC以浓度依赖性方式抑制LCSLCs的活性和自我更新能力,我们推测BrMC靶向抑制LCSCs的作用机制可能与干细胞相关标志物蛋白CD133的下调有关,但具体的分子机制还有待深入阐释。结合先前BrMC对人胚肝细胞系L-02影响甚微[12]的研究结果,我们可以推断新型白杨素类似物BrMC具有靶向LCSCs预防和治疗人肝癌的潜在价值。
[1]Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cellsperspectives on current status and future directions:AACR Workshop on cancer stem cells[J].Cancer Res,2006,66:9339-9344.
[2]Ma S,Chan KW,Hu L,et al.Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J].Gastroenterol,2007,132:2542-2556.
[3]Zou GM.Liver cancer stem cells as an important target in liver cancer therapies[J].Anticancer Agents Med Chem.2010,10(2):172-175.
[4]Zheng X,Meng WD,Xu YY,et al.Synthesis and anticancer effect of chrysin derivatives[J].Bioorg Med Chem Lett,2003,13(5):881-884.
[5]向红林,郑兴,曹建国.8-溴-7-甲氧基白杨素诱导人胃癌(C SGC-7901)细胞凋亡[J].中国药理学通报,2008,24(10):1370-1373.
[6]李凌,阳云 ,向红琳,曹建国.8-溴-7-甲氧基白杨素诱导白血病Jurkat细胞凋亡[J].湖南师范大学学报(医学版),2010,7(4):10-21
[7]单文娟,安东建,曹建国.8-溴-7-甲氧基白杨素诱导人肺癌(A549)细胞凋亡及其机制的探讨[J].中外医疗,2011,7(基础医学):16-17,
[8]Yang XH,Zheng X,Cao JG,et al.8-Bromo-7-methoxychrysin-induced apoptosis of hepatocellular carcinoma cells involves ROS and JNK [J].World J Gastroenterol.2010,16(27):3385-3393.
[9]梁晨,单娟娟,沈俊杰,刘立,钱程.肝癌细胞系Huh7中肿瘤干细胞分离及鉴定[J].浙江理工大学学报,2011,28(4):602-605.
[10]Yang,J.D.,and L.R.Roberts.Hepatocellular carcinoma:a global view.Nat.Rev.Gastroenterol.Hepatol.2010,7:448-458.
[11]Chun um,Kwon HJ,Sohn J et al."Prognostic factors after early recurrence in patients who underwent curative resection for hepatocellular carcinoma[J],"Sur Onco;2011,103(2):148-151.
[12]Reynolds BA,et al.Generation of neurons and astro-cytes from isolated cells of the adult mammalian central nervous system[J].Science,1992,255:1707-1710.
[13]Cao L,Zhou Y,Zhai B,et al.Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines[J].BMC Gastroenterol.2011,11:71-81.
[14]Ma S,Lee TK,Zheng BJ,et al.CD133+HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway.Oncogene.2008,27:1749-1758.
[15]Piao LS,Hur W,Kim TK,et al.CD133+liver cancer stem cells modulate radioresistance in human hepatocellular carcinoma[J].Cancer Lett.201228,315(2):129-137.
[16]Xi Lan,Yong-Zhong Wu,Yong Wang et al.CD133 silencing inhibits stemness properities and enhances chemoradiosensitivity in CD133-positive liver cancer stem cells[J].Int J Mol Med,2013,31(2):315-324.

