山药多糖抗神经细胞缺氧性凋亡机制研究
向 勤,蒲 明,胡微煦,文 珠,何 丹,胡国柱*
(1.南昌大学研究生院医学部,江西南昌 330006;2.江西省人民医院,江西南昌 330006;3.复旦大学上海市肿瘤医院,上海 200032;4.江西省医学科学研究院,江西南昌 330006)
研究发现缺血/缺氧性脑损伤的病理过程引发神经细胞凋亡,尤其是慢性脑缺血。传统医学中补气为主的方剂在治疗脑中风,特别是对于脑神经功能的恢复等疗效显著。动物及体外实验也证明人参皂苷、黄芪注射液、党参皂苷、黄精多糖、甘草酸二铵等均具有抗神经细胞缺血/缺氧性凋亡作用。山药是食药同源的补气中药,山药多糖(Chinese Polysaccharide from Yam,CYPS)具有抗氧化与衰老等作用[1]。本研究运用SD胎鼠大脑皮层神经细胞培养技术建立缺氧性神经细胞损伤体外模型,研究山药多糖抑制神经细胞缺氧性凋亡的机制,以期为缺氧性脑病治疗药物的开发与应用提供理论与实验依据。
1 材料与方法
1.1 试验药物 山药多糖(Chinese Yam Polysaccharide),购于南京泽朗生物科技有限公司,多糖质量分数大于95%,使用培养液稀释成不同质量浓度。
1.2 动物 清洁级孕15~18 d SD大鼠(购自江西省中医学院动物中心,许可证号:SCXK(赣)2005-0001)。
1.3 试剂 Neurobasal Medium和B27 Supplement(GIBCOBRL公司产品);神经元特异性烯醇化酶(NSE)和兔抗小鼠多克隆抗体(Boster产品);胶质纤维酸性蛋白(GFAP);兔抗人多克隆抗体,DAB显色试剂盒(中杉金桥产品);ABC-抗兔IgG试剂盒(Vector产品);罗丹明123染色试剂盒(南京凯基生物科技发展有限公司产品);TransS-criptTMTwo-Step RT-PCR SuperMix试剂盒(北京全式金生物技术有限公司产品);抗Bcl-2抗体及抗Bax抗体,兔抗大鼠多克隆抗体(Santa Cruz公司产品,北京中杉金桥生物技术有限公司分装);抗Caspase-3抗体(Anbo公司产品)。
1.4 仪器 3164型CO2培养箱(美国Forma Scientific公司);厌氧培养箱(YQX—Ⅱ型,上海跃进医疗器械厂);PCR扩增仪(型号:MyCyclerTMThermal Cycler,美国BIO—RAD公司);凝胶成像分析系统(型号:Universal HoodⅡ,美国 BIO—RAD公司);DMI3000型倒置荧光显微镜(德国Leica公司);流式细胞仪(型号:COULTER EPICS XL,美国BECKMANCOULTER公司)。
1.5 实验分组 正常对照组,神经细胞在37℃,5%CO2饱和湿度培养箱培养6 d;凋亡阳性组,神经细胞在37℃,5%CO2饱和湿度培养4 d后缺氧12 h,复氧24 h培养;山药多糖0.025 g/L组、山药多糖0.05 g/L组、山药多糖0.1 g/L组、山药多糖0.25 g/L组,神经细胞在37℃,5%CO2饱和湿度培养箱中培养4 d后加入以上不同质量浓度的山药多糖预处理4 h,再进行缺氧12 h,复氧24 h培养。
1.6 方法
1.6.1 神经细胞原代无血清培养,鉴定及缺氧/复氧培养等方法详见参考文献 [2]方法。
1.6.2 罗丹明123(Rhodamine 123)染色按说明书所述方法操作,流式细胞仪测定按常规方法进行,流式细胞仪测定采用FlowJo 6.5软件分析荧光强度。
1.6.3 RT-PCR操作步骤按照说明书所述方法进行,Bax正向引物序列:5'-GATCAGCTCGGGC ACTTTAG-3',反向引物序列:5'-TGCAGAGGATGATTGCTGAC-3';扩增长度173 bp;Bcl-2正向引物序列:5'-ATGCCGGTTCAGGTACTCAG-3',反向引物序列:5'-CGACTTTGCAGAGATGTCCA-3';扩增长度223 bp;Caspase-3正向引物序列:5'-GCATGCCATATCATCGTCAG-3';反向引物序列:5'-GGACCTGTGGACCTGAAAAA-3';扩增长度159 bp;β-actin正向引物序列:5'-TCAGGTCATCACTATCGGCAAT-3';反向引物序列:5'-AAAGAAAGGGTGTAAAACGCA-3';扩增长度432 bp;Bax与Bcl-2扩增条件:94℃ 5 min,94℃ 30 s,58℃ 30 s,72℃ 1 min,72℃ 10 min,32个循环,Caspase-3与β-actin退火温度为55℃,其余相同,用Quantity One测量条带的OD值,并以OD值目的基因/OD值内参值的比值作为目的基因的表达量。
1.6.4 免疫细胞化学染色按参考文献 [2]方法操作,Caspase-3(1 ∶1000)、Bax(1 ∶400)、Bcl-2(1∶400),染为棕黄色或棕褐色的细胞计为阳性细胞,随机计数200个细胞,计算阳性率。
1.7 统计分析 所有结果均采用SPSS 17.0统计软件进行统计分析,数据以表示,采用单因素方差分析,组间比较采用LSD检验,P<0.05具有统计学意义。
2 结果
2.1 神经细胞鉴定 胎鼠大脑皮层神经细胞原代培养6 d后,经神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)免疫细胞化学染色证明,NSE阳性细胞达到(93.70±0.56)%(n=5),GFAP阳性细胞达到(8.87±0.55)%(n=5)。细胞浆染色成棕黄色为阳性,未染色或淡黄色为阴性(见图1)。
“生命之根”能不能留住?——这是不是当今时代,比屈原的《天问》更其迫切更带根本的“诸心之问”或“指天之问”?

图1 神经细胞NSE、GFAP免疫细胞化学染色(放大倍数10×20)Fig.1 In vitro cultured cerebral cortical neurons stained by immunocytochemistry(10×20)
2.2 山药多糖对缺氧神经细胞线粒体的影响 神经细胞在培养4 d后加入不同质量浓度的山药多糖预处理4 h,再缺氧12 h复氧24 h培养,经流式罗丹明123检测发现山药多糖在0.025~0.25 g/L组平均荧光强度较正常对照组明显降低(P<0.05),但与凋亡阳性组相比均显著升高(P<0.05),且质量浓度在0.1 g/L时抑制作用最强(见表1,图2)。证明山药多糖能够在一定程度上减少缺氧对神经细胞线粒体损伤及所引起的细胞凋亡。
表1 山药多糖对各组缺氧的神经细胞线粒体的影响(,n=3)Tab.1 Effect of polysaccharide from Yam against mitochondrial injury of hypoxic neurons(,n=3)

表1 山药多糖对各组缺氧的神经细胞线粒体的影响(,n=3)Tab.1 Effect of polysaccharide from Yam against mitochondrial injury of hypoxic neurons(,n=3)
注:与正常对照组比较,▽P<0.05;与凋亡阳性组比较,▼P<0.05;与山药多糖0.025 g/L组比较,*P<0.05;与山药多糖0.05 g/L组比较,#P<0.05;与山药多糖0.1 g/L组比较,◇P<0.05
组 别 质量浓度/(g·L-1) 平均荧光强度(MFI)232.33 ±17.62凋亡阳性组 0 34.30±13.00▽山药多糖 0.025 54.87±8.95▽▼山药多糖 0.05 159.33±4.51▽▼*山药多糖 0.1 180.33±13.43▽▼*#山药多糖 0.25 45.90±3.53▽▼#◇正常对照组0
2.3 山药多糖对缺氧的神经细胞Caspase-3、Bax、Bcl-2 mRNA表达的影响 神经细胞在培养4 d后加入不同质量浓度的山药多糖预处理4 h,再缺氧12 h复氧24 h培养,经RT-PCR检测发现与凋亡阳性组比较,山药多糖在0.1~0.25 g/L之间显著下调缺氧的神经细胞Caspase-3 mRNA的表达(P<0.05),在0.05~0.25 g/L之间显著下调缺氧的神经细胞 Bax mRNA的表达(P<0.05),在0.05~0.1 g/L之间显著上调缺氧的神经细胞Bcl-2 mRNA的表达(P<0.05)(见表2,图3)。证明山药多糖预处理缺氧诱导的神经细胞通过下调Caspase-3和Bax基因的表达,上调Bcl-2基因的表达抗神经细胞凋亡,保护缺氧的神经细胞。
2.4 山药多糖对缺氧的神经细胞Caspase-3、Bax和Bcl-2蛋白表达的影响 神经细胞在培养4 d后加入不同质量浓度的山药多糖预处理4 h,再缺氧12 h复氧24 h培养,经免疫细胞化学染色发现与凋亡阳性组比较,山药多糖在0.025~0.25 g/L之间显著地下调Caspase-3蛋白表达,且在0.1 g/L时作用最强(P<0.05),在0.05~0.25 g/L之间显著下调Bax蛋白表达(P<0.05),在0.05~0.25 g/L之间显著上调Bcl-2蛋白的表达,且质量浓度为0.1 g/L时作用最强(P<0.05)(见表3,图4~6)。证明山药多糖预处理可通过下调Caspase-3、Bax凋亡蛋白表达,上调Bcl-2抗凋亡蛋白表达保护缺氧的神经细胞减少凋亡。

图2 山药多糖对缺氧的神经细胞线粒体的影响Fig.2 Effect of polysaccharide from Yam against mitochondrial injury of hypoxic neurons
2.5 山药多糖对缺氧的神经细胞Bcl-2/Bax比值的影响 神经细胞在培养4 d后加入不同质量浓度的山药多糖预处理4 h,再缺氧12 h复氧24 h培养,经免疫细胞化学染色发现与凋亡阳性组比较,山药多糖在0.005~0.1 g/L之间显著地降低缺氧的神经细胞Bcl-2/Bax mRNA比值(P<0.05),在0.025 g/L至0.25 g/L之间显著地降低缺氧的神经细胞Bcl-2/Bax蛋白比值(P<0.05)(见表2~3),其中以0.1 g/L最为显著。证明山药多糖预处理可通过提高抗凋亡基因和蛋白与凋亡基因和蛋白Bcl-2/Bax比值保护缺氧的神经细胞减少凋亡。
3 讨论
细胞缺血/缺氧影响线粒体膜通透性转运孔(MPTP)的功能,引起线粒体通透性改变(MPT),从而使线粒体膜电位(MMP)降低,导致过度产生的氧自由基、凋亡诱导因子及细胞色素C的释放,致使细胞凋亡[3-4]。黄芪的有效成分能够通过抑制PC12细胞活性氧的生成,提高MMP抑制氧化损伤性细胞凋亡[5]。黄芪多糖治疗腹主动脉缩窄的大鼠后发现心肌MMP较模型组明显升高[6]。本研究证明山药多糖在0.025~0.25 g/L抑制了缺氧的神经细胞线粒体的损伤,罗丹明-123检测发现平均荧光强度较凋亡阳性组显著提高,可能山药多糖修复MPTP的功能,提高线粒体的膜电位。
表2 山药多糖对缺氧的神经细胞Caspase-3、Bax、Bcl-2 mRNA表达(OD值)的影响(,n=3)Tab.2 Effect of polysaccharide from Yam on mRNA expressions of Caspase-3,Bax,Bcl-2 in hypoxic neurons((OD value),n=3)
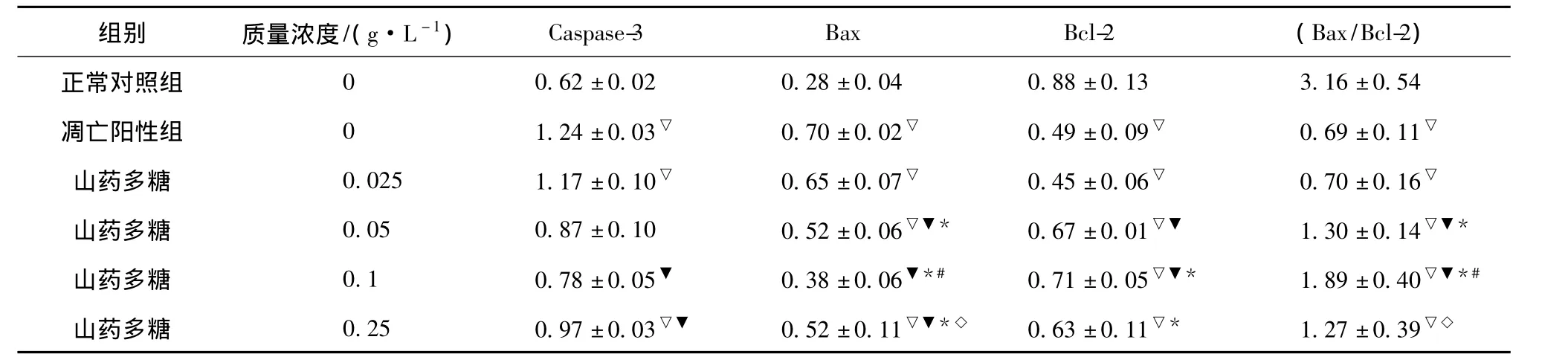
表2 山药多糖对缺氧的神经细胞Caspase-3、Bax、Bcl-2 mRNA表达(OD值)的影响(,n=3)Tab.2 Effect of polysaccharide from Yam on mRNA expressions of Caspase-3,Bax,Bcl-2 in hypoxic neurons((OD value),n=3)
注:与正常对照组比较,▽P<0.05;与凋亡阳性组比较,▼P<0.05;与山药多糖0.025 g/L组比较,*P<0.05;与山药多糖0.05 g/L组比较,#P<0.05;与山药多糖0.1 g/L组比较,◇P<0.05
组别 质量浓度/(g·L-1) Caspase-3 Bax Bcl-2 (Bax/Bcl-2)正常对照组0.62±0.02 0.28±0.04 0.88±0.13 3.16±0.54凋亡阳性组 0 1.24±0.03▽ 0.70±0.02▽ 0.49±0.09▽ 0.69±0.11▽山药多糖 0.025 1.17±0.10▽ 0.65±0.07▽ 0.45±0.06▽ 0.70±0.16▽山药多糖 0.05 0.87±0.10 0.52±0.06▽▼* 0.67±0.01▽▼ 1.30±0.14▽▼*山药多糖 0.1 0.78±0.05▼ 0.38±0.06▼*# 0.71±0.05▽▼* 1.89±0.40▽▼*#山药多糖 0.25 0.97±0.03▽▼ 0.52±0.11▽▼*◇ 0.63±0.11▽* 1.27±0.390▽◇
表3 山药多糖对缺氧的神经细胞Caspase-3、Bax、Bcl-2蛋白表达的影响(,n=3)Tab.3 Effect of polysaccharide from Yam on protein expressions of Caspase-3,Bax,Bcl-2 in hypoxic neurons(,n=3)

表3 山药多糖对缺氧的神经细胞Caspase-3、Bax、Bcl-2蛋白表达的影响(,n=3)Tab.3 Effect of polysaccharide from Yam on protein expressions of Caspase-3,Bax,Bcl-2 in hypoxic neurons(,n=3)
注:与正常对照组比较,▽P<0.05;与凋亡阳性组比较,▼P<0.05;与山药多糖0.025 g/L组比较,*P<0.05;与山药多糖0.05 g/L组比较,#P<0.05;与山药多糖0.1 g/L组比较,◇P<0.05
组 别 质量浓度/(g·L-1) Caspase-3/% Bax/% Bcl-2/% (Bcl-2/Bax)正常对照组 0 37.03±0.38 53.32±0.77 59.36%±2.23 1.11±0.03凋亡阳性组 0 58.89±0.45▽ 65.08±1.02▽ 37.83% ±1.08▽ 0.58±0.01▽山药多糖 0.025 55.65±0.24▽▼ 61.70±2.12 43.54% ±0.93▽ 0.71±0.02▽▼山药多糖 0.05 53.54±0.79▽▼ 57.34±2.53▼ 46.82% ±0.63▽▼ 0.82±0.03▽▼*山药多糖 0.1 45.76±0.53▽▼ 53.74±1.72▼ 52.82% ±1.33▽▼ 0.98±0.06▽▼*#山药多糖 0.25 52.42±1.06▽▼ 58.38±1.11▽▼ 45.88% ±1.38▽▼ 0.79±0.04▽▼*◇
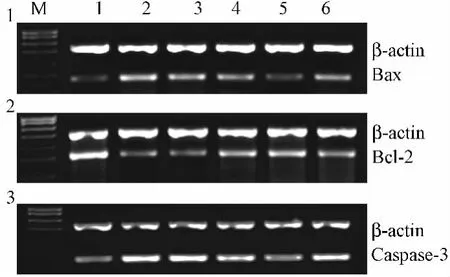
图3 山药多糖对缺氧的神经细胞Bax、Bcl-2、Caspase-3 mRNA表达的影响Fig.3 Effect of polysaccharide from Yam on mRNA expressions of Caspase-3,Bax,Bcl-2 in hypoxic neurons

图4 山药多糖对缺氧的神经细胞Bax蛋白表达的影响Fig.4 Effect of polysaccharide from Yam on protein expression of Bax in hypoxic neurons

图5 山药多糖对缺氧的神经细胞Bcl-2蛋白表达的影响Fig.5 Effect of polysaccharide from Yam on protein expression of Bcl-2 in hypoxic neurons
图6 山药多糖对缺氧的神经细胞Caspase-3蛋白表达的影响Fig.6 Effect of polysaccharide from Yam on protein expression of Caspase-3 in hypoxic neurons
本课题组对不同补气强度的中药进行体外抗缺氧性神经细胞凋亡研究发现,人参皂苷Rb1和西洋参总皂苷在 0.05~0.1 g/L[10-11]、黄精多糖在0.5 ~1.5 g/L[12],白扁豆多糖在0.5 ~3.5 g/L[13]、山药多糖则在0.025~1.0 g/L提高缺氧的神经细胞Bcl-2/Bax表达比值,并成剂量依赖性。这些结果证明,不同强度的补气中药均能有效地抑制缺氧性神经细胞凋亡,且抗神经细胞缺氧性凋亡的强弱与中药补气强弱相一致;同时也初步证明同一药性的中药其功效相同。
综上所述,山药多糖通过降低凋亡基因及蛋白的产生,上调抗凋亡基因及蛋白的产生,提高Bcl-2/Bax的比值达到抗神经细胞缺氧性凋亡作用。
[1]袁书林.山药多糖的化学成分和生物活性作用研究进展[J].食品研究与开发,2008,29(3):176-179.
[2]聂荣庆,李扣华,胡国柱,等.黄芪抗新生大鼠大脑皮层神经细胞缺氧性凋亡研究[J].中国中医基础医学杂志,2004,10(11):34-37.
[3]Lee J.Martin.Mitochondrial and cell death mechanisms inneurodegenerative diseases[J].Pharmaceuticals(Basel),2010,3(4):839-915.
[4]陈 冬,刘 青,陈书起.线粒体膜通透性转运孔与缺血缺氧性脑损伤[J].中国健康心理学杂志,2011,19(3):381-384.
[5]黄小平,刘晓丹,邓常清.黄芪和三七主要有效成分配伍对氧化损伤所致的PC12细胞凋亡及其活性氧线粒体膜电位的影响[J].中西医结合学报,2012,10(10):1127-1134.
[6]宋 莹,王洪新,张 晶,等.黄芪多糖对腹主动脉缩窄致大鼠心肌肥厚能量代谢紊乱的抑制作用[J].中国药理学与毒理学杂志,2012,26(2):177-181.
[7]Broughton B R,Reutens D C,Sobey C G.Apoptotic mechanisms after cerebral ischemia[J].Stroke,2009,40(5):e331-e339.
[8]Asahi M,Hoshimaru M,Uemura Y,et al.Expression of interleukin-1beta converting enzyme gene family and bcl-2 gene family in the rat brain following permanent occlusion of the middle cerebral artery[J].J Cereb Blood Flow Metab,1997,17(1):11-18.
[9]Namura S,Zhu J,Fink K,et al.Activation and cleavage of caspase-3 in apoptosis induced by experimental cerebral ischemia[J].J Neurosci,1998,18(10):3659-3668.
[10]聂荣庆,李扣华,胡国柱,等.人参皂苷Rb1抗新生大鼠大脑皮层神经细胞缺氧性凋亡研究[J].中国康复理论与实践,2004,10(12):723-725.
[11]胡国柱,漆琼瑶,高幼奇,等.西洋参皂苷抑制缺氧性神经细胞凋亡机制的影响[J].中药药理与临床,2012,28(2):57-61.
[12]胡国柱,聂荣庆,肖移生,等.黄精多糖对新生大鼠大脑皮层神经细胞缺氧性凋亡的影响[J].中药药理与临床,2005,21(4):37-39.
[13]胡国柱,姚于飞,文 珠,等.白扁豆多糖对神经细胞缺氧性凋亡的保护[J].中药药理与临床,2012,28(1):91-94.

