齐墩果酸和绿原酸对HepG2细胞及P450酶的影响
汤 浩,刘晓莉,王 锐,高庆剑,陆 铖,孙志博
(1.甘肃省人民医院药剂科,甘肃兰州 730000;2.宁夏医科大学药学院药理系,宁夏银川 750000;3.兰州大学基础医学院遗传所,甘肃兰州 730000)
人体内主要药物代谢酶是细胞色素P450家族,其中CYP1A1、CYP3A4是主要的诱导酶,前者能催化许多前致癌物转化为致癌物[1],后者代谢60%临床常用药物[2],它们是药物代谢/毒理学的重要指标。齐墩果酸临床上主要用于治疗急性黄疸型和慢性中毒性肝炎,并作为抗癌辅助药物。经研究齐墩果酸具有保肝作用[3-4],并且能够诱导肝癌细胞HepG2细胞的凋亡[5]。绿原酸具有广泛的药理和生理活性,主要存在于杜仲,金银花等植物中。有文献报道,绿原酸具有抗肝纤维化和肝损伤的作用[6],绿原酸对小鼠急性肝损伤的保护作用[7],利福平是肝脏CYP450酶某些同工酶的诱导剂和抑制剂,影响其他药物代谢[8]。因此本实验选取齐墩果酸和绿原酸为研究对象,探讨它们对HepG2细胞增殖、细胞周期、CYP1A1mRNA、CYP3A4 mRNA的影响。
1 材料和方法
1.1 材料 齐墩果酸和绿原酸均购自中国药品生物制品检定所,供定量测定用。利福平(上海化学试剂有限公司)。采用二甲基亚砜(DMSO)助溶,DMSO在细胞液中的终浓度不超过0.1%。TaKaRa RNAiso Plus购自宝生物工程(大连)有限公司;Rever Ace qPCR RT Master Mix购自TOYOBO公司;实验所用引物用Primer Premier 5.0软件设计,委托上海生工合成;新生牛血清购自PAA公司;噻唑蓝(MTT,美国 Sigma公司)。一次性细胞瓶(5×5 cm2),细胞培养皿(100 mm),96孔细胞培养板全部购自NUNC公司。
1.2 仪器 超净台,细胞培养箱,ABI7500实时荧光PCR,梯度 PCR测定仪(购自 PCR公司),高速低温离心机(SIGMA公司),核酸蛋白测定仪。
1.3 HepG2 细胞株人肝癌细胞HepG2为本实验室保存。HepG2接种于含10%新生牛血清、抗生素(100 U/mL青霉素和100μg/mL链霉素)的DMEM高糖培养基中。HepG2细胞培养环境:5%CO2、37℃、相对湿度90%。HepG2细胞取对数生长期细胞用作实验。
1.4 MTT方法 取对数生长期细胞,调整密度为5×104个/mL接种于96孔板中,100μL/孔,16 h后加入含不同质量浓度齐墩果酸、绿原酸和利福平的培养基,药物终质量浓度为200、100、50、25、12.5、6.25μg/mL,每个质量浓度设5个复孔,同时设空白对照组和正常细胞生长组,药物作用24 h后,加入5 mg/mL MTT,20μL/孔,继续培养4 h后弃上清,加入DMSO 150μL/孔溶解,震荡混匀10 min,在酶联免疫检测分析仪上测定A490nm值。按以下公式计算药物细胞生长抑制率,实验以3次平行实验数据为最终结果。
细胞生长抑制率=(1-A实验/A对照)×100%
1.5 细胞周期测定 取对数生长期的细胞,按1×106个/瓶接种于一次性细胞培养瓶,培养16 h后,用PBS清洗两遍,加入含不同质量浓度药物齐墩果酸和绿原酸的培养基,药物质量浓度分别为100、50、25μg/mL,阳性对照利福平 10μg/mL,继续培养24 h后,胰蛋白酶消化成单细胞液,收集细胞,用PBS洗涤细胞后,加入300μL PBS,再加入 -20℃预冷的无水乙醇 700μL,混匀,-20℃冰箱固定24 h以上,离心洗涤细胞后,加入终质量浓度20μg/mL的RNA酶,置于37℃水浴30 min,接着加入50μg/mL PI 300μL避光染色30 min,300目筛网过滤,2 h内流式细胞仪分析细胞周期。
1.6 齐墩果酸和绿原酸对HepG2细胞中CYP1A1、CYP3A4 mRNA表达的影响
1.6.1 分组 实验组,齐墩果酸和绿原酸质量浓度为100、50、25μg/mL;阴性对照组,正常细胞生长组,阳性对照利福平10μg/mL。
1.6.2 RNA的提取和cDNA的合成 细胞接种于一次性细胞培养瓶,16 h后吸取旧的培养基,用PBS清洗两遍,加入含不同质量浓度两种药物的培养基,药物作用时间为24 h。用RNAiso Plus试剂盒提取RNA之后,用核酸蛋白测定仪检测A260/A280比值,鉴定 RNA的纯度。RNA溶解于15μL RNse-free H2O中,5μL用于测定 RNA的纯度,8μL用于反转录。反转录体系为5×RT Master Mix 2μL,RNA 溶解液 8μL,反转录总体积 10μL。反转录的条件为37℃ 15 min,50℃ 5 min,98℃5 min,反转录产物4℃保存。
1.6.3 实时荧光PCR反应 将反转录产物10倍稀释后作为PCR反应模板,PCR的反应体系为:1μL稀释液,上下游引物 10μmol/L(表 1)各1μL,2×SYBR Green I 12.5μL,添加高压灭菌的三蒸水至终体积25μL,混匀。反应条件:起始95℃ 5 min,扩增时95℃ 15 s,60℃15 s,72℃45 s循环40次,溶解曲线分析。以GADPH为内参,进行PCR扩增产物的实时定量分析。
实时定量PCR数据采用比较阈值法进行相对定量分析。计算方法:目的基因诱导或抑制倍数=2-ΔΔCt,Ct值是热循环仪中荧光达到阈值循环数,ΔΔCt=实验组ΔCt(目的基因Ct-内参基因Ct)-对照组ΔCt(目的基因Ct-内参基因Ct)。计算每一个标本目的基因的拷贝数。

表1 实时荧光PCR引物Tab.1 Sequence of primer used in real-time PCR
1.7 数据统计学分析 所有试验数据用SPSS 17.0统计学软件进行统计学分析,数据均用“”表示,采用单因素方差分析。
2 结果
2.1 齐墩果酸和绿原酸对HepG2细胞增殖的影响MTT实验结果表明,随着齐墩果酸和绿原酸质量浓度的增大,对HepG2细胞抑制率明显升高,并且具有明显的剂量依赖关系。质量浓度低于50μg/mL时,绿原酸对HepG2细胞的抑制作用比齐墩果酸强,但质量浓度高于50μg/mL,齐墩果酸对HepG2的抑制作用明显高于绿原酸。在50μg/mL时,两种药物的抑制率相同。利福平6.25~200μg/mL对HepG2细胞的抑制作用都在40%左右,抑制作用较强。在下述细胞周期和实时荧光定量PCR实验中选择药物处理质量浓度为100、50和25μg/mL,阳性对照利福平10μg/mL。观察齐墩果酸、绿原酸和利福平对HepG2细胞周期和CYP1A1 mRNA、CYP3A4 mRNA表达的影响。见图1。
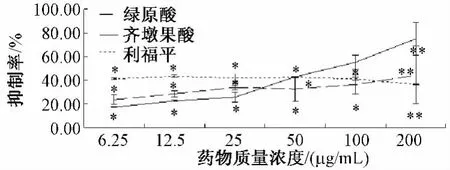
图1 齐墩果酸、绿原酸和利福平对HepG2细胞增殖的影响Fig.1 Effect of oleanolic acid,chlorogenic acid and rifampicin on proliferation of HepG2 cells
2.2 流式细胞术测定3种质量浓度齐墩果酸和绿原酸对HepG2细胞周期的影响 经3种药物不同质量浓度药物处理后,HepG2细胞各时期细胞数占细胞总数的百分比与正常对照组相比较,有些细胞周期分布发生了明显变化。齐墩果酸25μg/mL和绿原酸 50、25μg/mL、阳性对照利福平 10μg/mL均对细胞周期没有明显影响。齐墩果酸的100、50μg/mL 和绿原酸的100μg/mL 均对HepG2细胞周期S期发生了明显阻滞。见图2。

图2 不同质量浓度齐墩果酸、绿原酸对HepG2细胞周期的影响Fig.2 Different concentrations of oleanlic acid and chlorogenic on the cell cycle of HepG2 cells
2.3 实时荧光PCR检测两种药物不同质量浓度对HepG2细胞中CYP1A1 mRNA表达的影响 实验结果显示,齐墩果酸在3个质量浓度均可明显诱导HepG2细胞中CYP1A1 mRNA表达,给药质量浓度从大到小诱导倍数依次为2.48、1.45、2.34。绿原酸3个质量浓度均可明显抑制HepG2细胞中CYP1A1 mRNA表达,给药质量浓度从大到小抑制倍数依次为1.91、0.61、2.82,阳性对照利福平10μg/mL的诱导倍数为2.3相对较弱。见图3。

图3 齐墩果酸、绿原酸和利福平对HepG2细胞CYP1A1 mRNA表达的影响Fig.3 Effect of oleanolic acid,chlorogenic acid and rifampicin on the expression of in CYP1A1 mRNA HepG2 cells
2.4 实时荧光PCR检测两种药物不同质量浓度对HepG2细胞中CYP3A4 mRNA表达的影响 实验结果显示,齐墩果酸在3个质量浓度均可明显诱导HepG2细胞中CYP3A4 mRNA表达,给药质量浓度从大到小诱导倍数依次为1.17、2.42、8.40。绿原酸 100、50μg/mL均可抑制 HepG2细胞中CYP3A4 mRNA表达,抑制倍数依次为 0.65、1.00,绿原酸 25μg/mL HepG2细胞中 CYP3A4 mRNA表达可明显诱导HepG2细胞中CYP3A4 mRNA表达,诱导倍数为0.59,诱导相对较弱,阳性对照利福平10μg/mL能显著诱导HepG2细胞中CYP3A4 mRNA表达,诱导能力较强。见图4。
3 讨论
药物代谢酶在药物的代谢解毒和代谢活化中起着重要的作用[9]。研究中药成分对 CYP的影响,为预测有关中西药之间相互作用,提高中药有效成分的有效性和安全性具有重要意义。
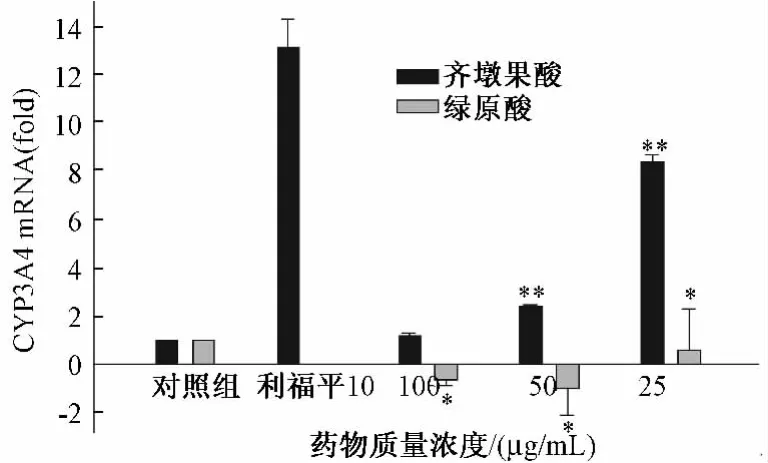
图4 齐墩果酸、绿原酸和利福平对HepG2细胞CYP3A4 mRNA表达的影响Fig.4 Effect of oleanolic acid and chlorogenic acid and rifampicin on theexpression ofin CYP3A4 mRNA cells HepG2
齐墩果酸和绿原酸是一种天然药物,国内对其提取分离及药理作用研究较多,但很多作用机制尚处于研究探索阶段[10]。因此,进一步研究两种药物抗肿瘤机理及其药物的体外代谢,显得很有意义。HepG2细胞具有典型肝癌细胞的一系列恶性特征,最大的优点是保留了一系列生物转化过程中的Ⅰ相和Ⅱ相酶,是研究和评价防治肝癌药物的较理想细胞模型。
MTT实验结果表明,200~6.25μg/mL齐墩果酸和绿原酸均可抑制肝癌细胞 HepG2生长,50μg/mL时,两种药物的抑制率相同,说明齐墩果酸和绿原酸是潜在防治肝癌的中药制剂,利福平在一定范围能显著抑制肝癌细胞生长。细胞周期在肿瘤的生长调控中具有重要的作用,通过改变细胞周期来阻止肿瘤细胞的无限增殖已受到人们的关注[11]。细胞周期的调节主要发生在2个重要阶段:G1-S期和G2-M期。齐墩果酸和绿原酸的有效质量浓度处理HepG2细胞,使S期细胞显著降低,两种药物有可能通过影响细胞周期而抑制细胞生长。
近年来认为CYP1A1活化苯并芘等多种多环芳烃化合物使其致癌[12],并且CYP1A1的诱导能力是作为评价致癌性的重要指标。本研究发现,齐墩果酸和绿原酸的三个有效质量浓度均能诱导的CYP1A1 mRNA表达,由于齐墩果酸和绿原酸对CYP1A1的诱导是否可能增加机体对毒性物质代谢发生变化,对机体造成一定的损害,长期服用含齐墩果酸和绿原酸的药物是否对机体有潜在的毒副作用,对药物代谢性相互作用的影响,有待于进一步实验研究。
CYP3A4可同时氧化代谢多种药物,导致药效的增强(降低)或毒副作用的增加[13]。由于其代谢的广泛性,进一步影响了药物的药效学和毒理学。本实验结果显示,齐墩果酸高、中、低3个质量浓度是CYP3A4的诱导剂,而绿原酸的低质量浓度是CYP3A4的抑制剂,两种药物与其他药物合用时,能够影响其他药物的血药浓度和生物利用度,对药物相互性作用的影响有待于进一步研究,利福平是肝癌细胞的强诱导剂。有相关文献报道[4-15],齐墩果酸能抑制肝癌细胞SMC-7721、Hep3B的增殖和诱导其凋亡。
综上所述,本实验分析了齐墩果酸和绿原酸对HepG2细胞周期和两种CYP450酶的诱导作用。本实验结果初步证明齐墩果酸和绿原酸对CYP450酶系的诱导作用,实验结果为中西药代谢相关性提供了体外实验的数据支持。两种药物体内是否也存在CYP450酶的诱导或者抑制作用,有待于进一步的实验研究。
[1]刘高峰,郭兴蕾.中药对细胞色素P450调控作用的研究进展[J].中草药,2008,39(1):139-143.
[2]钟育敏,吴文康.中药对细胞色素P450调控作用的研究进展[J].陕西中医,2011,32(2):244-247.
[3]张明发,沈雅琴.齐墩果酸和熊果酸保肝药理作用的研究进展[J].抗感染药学,2012,9(1):13-19.
[4]汤新慧,严丽芳,徐力致,等.3种五环三萜化合物对高钙诱发的小鼠肝MPT的抑制作用研究[J].中国中药杂志,2011,36(4):496-499.
[5]陈 莉,尚 娟,王志凤,等.硝酸酯/齐墩果酸杂合物的合成及HepG2细胞凋亡抑制活性的研究[J].药学学报,2010,45(12):1516-1522.
[6]戚晓渊,史秀灵,高银辉,等.绿原酸抗肝纤维化作用的研究[J].中国实验方剂学杂志,2011,17(15):139-143.
[7]史秀玲,高银辉.绿原酸对小鼠急性肝损伤的保护作用[J].中国实验方剂学杂志,2011,17(19):199-202.
[8]Neimi M,Backman J T,Fromm M F,et al.Pharmacokinetic interactions with rifampicin:clinical relevance[J].Clin Pharmacokinet,2003,42(9):819-850.
[9]Glei M ,Kirmse A,Haberman N.Bread enriched with green coffee extract has chemoprotectire and antigenotoxic antivities in human cells[J].Nutr Canner,2006,56(4):192.
[10]王 奇,芦柏震.齐墩果酸的研究进展[J].中国药房,2008,19(9):711-712.
[11]Townsend D M,Tew K D.The role of glutathione-S-transferase in anti-canner drug resistance[J].Oncogene,2003 ,22(47):7369-7375.
[12]Shaik A P,Jamil K,Das P.CYP1A1 polymorphisms and risk of prostate cancer:a meta-analysis[J].Urol J,2009,6(2);78-86.
[13]Klein K,Thomas M,Winter S,et al.PPARA:a novel genetic determinant of CYP3A4 in vitro and in vivo[J].Clin Pharmacol Ther,2012,91(6):1044-1052.
[14]黄开顺,朱链链,刘 丹,等.齐墩果酸抑制肝癌细胞QGY增殖和诱导凋亡的作用研究[J].世界科技研究与发展,2011,33(2):318-321.
[15]吴英俊,王超男,刘洁婷,等.蛇莓中齐墩果酸对肝癌细胞SMMC-7721的抑制作用[J].中国生化药物杂志,2011,32(4):306-308.

