针刺对胚胎着床障碍大鼠子宫内膜CCR2的影响*
高伟娜 唐 潇 呙 月 王丽君 张明敏 黄光英
华中科技大学同济医学院附属同济医院中西医结合研究所,武汉 430030
近些年来,大量研究[1-2]显示趋化因子在排卵、月经、胚胎着床、分娩等生理过程和早产、HIV感染、子宫内膜异位症、卵巢过度刺激症等病理过程中均发挥重要的作用。妊娠期间,母胎界面的趋化因子通过与其受体结合,能够调节白细胞的募集,促进滋养细胞的侵袭,调整细胞的增殖和黏附分子的表达,从而成为成功妊娠的重要决定者。其中,趋化因子配体/趋化因子受体(CCL2/CCR2)这对配/受体在上述过程中起到关键的作用[3-5]。我们前期的研究[6]也证明针刺能够提高胚泡着床障碍大鼠的着床胚泡数和妊娠率,能够调节子宫内膜Th1和Th2细胞因子的表达。那么,针刺能否调节CCR2在母胎界面上的表达呢?通过本研究,将回答这个问题。
1 材料与方法
1.1 实验动物及分组
SPF级成年未孕产雌性 Wistar大鼠(鼠龄10~12周,平均体重为220~230 g)和有生育能力的成年雄性Wistar大鼠(平均体重为250~300 g)均来源于湖北省疾病控制中心。所有大鼠均饲养于华中科技大学同济医学院实验动物中心屏障系统。适应性喂养1周,然后阴道涂片观察所有大鼠动情周期,动情周期正常者开始进入正常实验周期。处于动情期的雌性大鼠与雄性大鼠以2∶1的比例于6:00 p m时进行交配,次日8:00 am时行大鼠阴道涂片发现有大量精子者视为妊娠第1天。然后将怀孕的大鼠随机分为正常组(N)、胚胎着床障碍组(M)、针刺治疗组(A)、黄体酮治疗组(W),每组18只,每组孕鼠根据处死的时间再分为第6天组(D6)、第8天组(D8)、第10天组(D10)。
1.2 试剂与仪器
米非司酮片(夕韵,湖北葛店人福药业)、黄体酮注射液(浙江仙琚制药股份有限公司)由华中科技大学同济医学院附属同济医院提供。兔抗大鼠多克隆抗体CCR2(ab32144)购于Abcam公司。HRP(辣根过氧化物酶)标记的山羊抗兔Ig G、山羊或兔抗大鼠Actin多克隆抗体购于Santa Cr uz公司。HRP标记的山羊抗兔Ig G(H+L)和DAB显色试剂盒购于北京中杉金桥生物技术有限公司。RIPA裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光试剂盒购于碧云天生物科技研究所。Cocktail蛋白酶抑制剂购于Roche公司。NC膜来自Pierce公司。Trizol RNA提取试剂盒、逆转录试剂盒和SYBR荧光定量试剂盒来源于Takara公司。主要设备:核酸蛋白质分析仪(DU730,Beck man Coulter,USA);PCR 仪(Eppendorf Company,Ger many);荧光定量PCR仪(Applied Biosystems,Calif or nia,USA);全能酶标仪(Bio Tek Syner gy2,Ver mote,USA);尼康显微成像系统(TE2000-U,Japan)。
1.3 造模与处理
在超净工作台中将米非司酮研磨成粉末后溶于适量体积的麻油中,配制成2 mg/ml的米非司酮麻油溶液,分装后置于4℃冰箱中备用。M组、A组和 W组孕鼠于妊娠第1天9:00 am于头颈部皮下注射米非司酮麻油溶液(5.5 mg/kg),N组则给予同量的纯麻油溶液。从妊娠第1天直至处死当日,A组孕鼠于每日3:00 p m用自制布袋固定后,针刺后三里和三阴交,每5 min行针1次,共留针25 min,穴位的定位和进针深度参考前期的研究[6];同时 M组和N组大鼠仅固定不予针刺;W组大鼠则每日肌肉注射黄体酮(40 mg/kg)。
1.4 取材
各组孕鼠在1%的戊巴比妥纳麻醉下行剖腹,观察胚泡着床情况。1/3的着床点子宫被收集,立即固定在4%的多聚甲醛中,24 h后行石蜡包埋。剩余的子宫组织置于-80℃冰箱保存。
1.5 妊娠大鼠着床点子宫内膜CCR2的蛋白检测
1.5.1 免疫组织化学法 5μm的石蜡切片置于60℃烤箱中烤片1 h。然后二甲苯中脱蜡,梯度酒精(70%乙醇)中水化。PBS漂洗切片后,切片置于0.01 M的枸橼酸缓冲液(p H 6.0)中微波修复15 min(98℃)。自然冷却后,用3%的H2O2室温下封闭过氧化氢酶10 min。漂洗切片后,5%BSA室温下封闭20 min。甩干液体,合适浓度的一抗(CCR2 1∶500)4℃孵育过夜。第2天漂洗切片后,根据一抗来源选择HRP标记的山羊抗兔Ig G(H+L)37℃孵育30 min。漂洗切片后,DAB试剂盒显色,苏木精复染细胞核,氨水返蓝。然后梯度酒精脱水(70%乙醇),二甲苯透明,中性树胶封片。显微成像系统拍照后,每张切片选取3个视野用Image-Pro Plus 6.0软件测得平均光密度值。
1.5.2 Wester n blot法 沿着子宫的系膜对侧将子宫沿长轴剪开,在解剖显微镜下将胎儿剔除,收集着床点子宫内膜。子宫内膜被剪碎后放于预冷的RIPA裂解液中在冰上研磨成匀浆状。冰上静置30 min。然后4℃,12 000 g离心20 min。上清被收集分装放于-80℃冰箱中。蛋白浓度用BCA试剂盒定量,酶标仪分析。将加了上样缓冲液的蛋白98℃蒸煮10 min后,加入12%SDS-PAGE中电泳,然后将分离的蛋白转移至NC膜上。5%的脱脂牛奶室温下封闭2 h后,一抗4℃孵育过夜(β-actin 1∶200;CCR2 1∶500)。漂洗后,HRP(辣根过氧化物酶)标记的山羊抗兔Ig G(1∶20 000)室温下孵育1 h。然后根据说明书进行ECL曝光。扫描胶片,用Quantity One软件获得积分光密度值。每个样本的光密度值以目的蛋白/β-actin的比值来表示。
1.6 妊娠大鼠着床点子宫内膜CCR2的mRNA检测(Real-ti me PCR)
按照说明书,将剪碎的着床点子宫内膜置于预冷的Trizol中提取RNA。取2μl RNA用核酸蛋白质分析仪测定其浓度和纯度后,用Pri me Script RT Reagent Kit将其逆转录成c DNA,反应条件为:37℃15 min,85℃5 s,4℃稳定储存在-20℃冰箱中。然后在20μl体系下进行扩增[10μl SYBR Premix Ex Taq(2×),2μl c DNA样品,10μM 的引物各0.4μl(引物序列详见表1),0.4μl ROX Reference Dye(50×),6.8μl无菌DECP水],反应条件为:第一步95℃30 s,1个循环;第二步95℃5 s,60℃30 s,40个循环;第三步95℃15 s,60℃1 min,95℃15 s,1个循环。其中每个样本做2个复孔,β-actin为内参。每个标本的相对RNA含量通过2-△△ct计算得到。
1.7 统计学处理
采用SPSS 15.0统计软件进行分析。所有的实验数据以±s表示,单因素方差分析进行统计处理(如果数据满足方差齐性条件选择LSD检验,如果不满足,则用Dunnett’s T3检验),以P<0.05为差异有统计学意义。
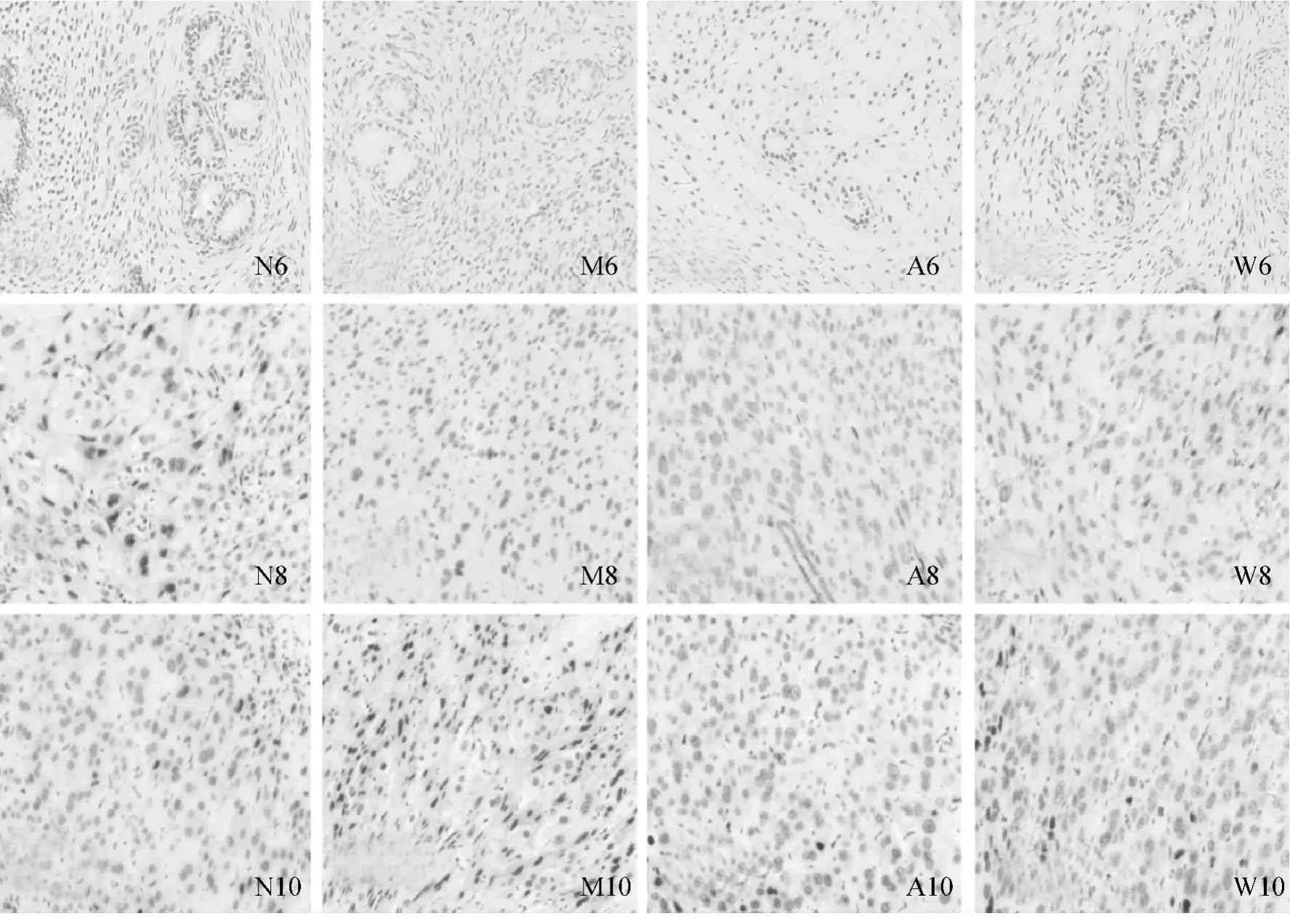
图1 各组大鼠妊娠第6、8、10天着床点子宫内膜CCR2的蛋白定位

表1 CCR2和β-actin的引物序列
2 结果
2.1 各组妊娠大鼠着床点子宫内膜CCR2的免疫组织化学分析
CCR2蛋白的表达在妊娠第6天主要集中在子宫内膜的腺上皮和腔上皮,而妊娠第8天和第10天则主要分布在蜕膜细胞上。平均光密度分析结果显示:与正常组相比,模型组大鼠妊娠第6、8、10天CCR2蛋白的表达均明显下降(P<0.05);而与模型组相比,针刺组和黄体酮组大鼠妊娠第6、8、10天CCR2蛋白的表达则明显升高(P<0.05);针刺组和黄体酮组之间CCR2的表达无差异(P>0.05)。见图1-2。
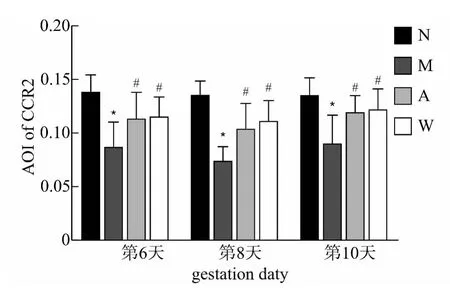
图2 各组大鼠妊娠第6、8、10天着床点子宫内膜CCR2蛋白表达的比较(免疫组织化学法)
2.2 各组妊娠大鼠着床点子宫内膜CCR2的Western blot分析
与正常组相比,模型组大鼠妊娠第6、8、10天子宫内膜CCR2的蛋白表达明显降低,差异有统计学意义(P<0.05);与模型组相比,针刺组大鼠妊娠第6、10天子宫内膜CCR2的蛋白表达和黄体酮组大鼠妊娠第6、8、10天子宫内膜CCR2的蛋白表达均明显上升(P<0.05);针刺组和黄体酮组之间CCR2的表达无差异(P>0.05)。见图3a-b。

图3 各组大鼠妊娠第6、8、10天着床点子宫内膜CCR2的蛋白表达(Wester n blot)
2.3 各组妊娠大鼠着床点子宫内膜CCR2的mRNA表达分析
与正常组相比,模型组大鼠着床点子宫内膜CCR2 mRNA的表达在第6、8、10天均明显下降(P<0.05);而针刺组和黄体酮组大鼠妊娠第6、8天子宫内膜CCR2 mRNA的表达明显高于模型组(P<0.05);针刺组和黄体酮组之间CCR2的表达无差异(P>0.05)。见图4。

图4 各组大鼠妊娠第6、8、10天着床点子宫内膜CCR2 mRNA 表达(Real-time PCR)
3 讨论
趋化因子是一类由70~90个氨基酸(8~12 kd)组成的具有趋化特定白细胞亚群的细胞因子超家族。根据他们的半胱氨酸残基的相对位置,趋化因子主要被分为4个亚家族:CC、CXC、C、CX3C。趋化因子受体是G蛋白耦联细胞表面受体,其命名依据配体结构而定(CCR、CXCR、CR、CX3CR)。趋化因子不仅能够趋化特定的白细胞至特定的组织区域,同时还是白细胞活化的重要调节者[7]。趋化因子与特定白细胞亚型的受体结合后,通过上调黏附分子增强白细胞与内皮组织的黏附,促进白细胞的溢出。大量研究显示趋化因子在妊娠建立过程中有重要作用。CCL2/MCP-1,属于趋化因子CC(C指半胱氨酸残基)亚家族,可由炎症因子刺激的单核-巨噬细胞、成纤维细胞、内皮细胞、B细胞和平滑肌细胞等产生。子宫内膜产生的CCL2与其特异性受体CCR2结合,能够特异地趋化巨噬细胞和自然杀伤细胞至母胎界面,并使之激活,产生大量的诸如 LIF、IL-6、IFN-γ等细胞因子,从而有利于胚胎的着床和螺旋动脉的重塑[8-10]。可是,趋化因子CCL2在母胎界面的免疫调节作用并非如此简单。有研究[11-12]指出,在容受期的子宫内膜上皮有CCL2和CCR2的存在,他们可能在胚胎的定位和黏附阶段起到重要作用。妊娠早期侵袭性细胞滋养层中也发现CCR2的存在,这些滋养层细胞可能时刻准备着对母胎界面的趋化因子信号做出反应[13]。这说明子宫内膜局部的CCL2通过与其受体CCR2的结合,能够以自分泌和(或)旁分泌的方式调节妊娠的进行。
本研究中,我们观察到CCR2在子宫内膜的腔上皮、腺上皮、蜕膜细胞和胚胎上均有表达。由于未进行CCR2和巨噬细胞或自然杀伤细胞的双重染色,所以CCR2在免疫细胞上的表达情况尚不清楚。胚胎着床障碍组大鼠妊娠第6、8、10天子宫内膜CCR2的表达明显低于正常组,而针刺治疗能明显上调CCR2在胚胎着床障碍大鼠子宫内膜上的表达,且与黄体酮治疗的在上调CCR2表达上的作用无明显差异。大鼠的胚胎着床发生在交配后的6~7 d[8],血管重塑在妊娠8.5 d开始,妊娠10.5 d完成,自此胎盘循环建立[14]。这说明针刺上调了CCR2在大鼠子宫内膜上的表达,使CCL2/CCR2这对受/配体更加有效的结合,从而有利于胚胎着床和母体螺旋动脉的重塑。另外,有研究显示,怀孕相关的雌激素、孕激素和人体绒膜促性腺激素能够上调CCL2和其对应的受体CCR2的表达,参与蜕膜基质细胞功能的调节[5],且本研究中针刺治疗与黄体酮治疗均能提高CCR2在子宫内膜的表达,所以我们推测针刺可能并非直接上调CCR2在子宫内膜上的表达,而是在孕激素的介导下完成的。
总之,针刺能上调母胎界面CCR2的表达,从而有助于胚胎着床障碍大鼠的胚胎着床和胎盘形成,这为针刺治疗不孕症提供了新的实验依据。
[1]COCCHI F,De VICO,AL,GARZINO-DEMO A,et al.I-dentification of RANTES,MIP-1 alpha,and MIP-1 beta as the major HIV-suppressive factors pro-duced by CD 8+ T cells[J].Science,1995,270(5243):1811-1815.
[2]SI MÓN C,CABALLERO-CAMPO P,GARCIA-VELASCO JA,et al.Potential i mplications of chemokines in reproductive function:an attractive idea[J].J Reprod Immunol,1998,38(2):169-193.
[3]DI MITRIADIS E.Cytokines,chemokines and growth factors in endometrium related to implantation[J].Human Reproduction Update,2005,11(6):613-630.
[4]ARICI A,MACDONALD P,CASEY M.Regulation of mon-ocyte chemotactic protein-1 gene expression in human endometrial cells in cultures[J].Mol Cell Endocrinol,1995,107(2):189-197.
[5]HE YY,DU MR,GUO PF,et al.Regulation of C-C motif chemokine ligand 2 and its receptor in human decidual stromal cells by pregnancy-associated hor mones in early gestation[J].Hum Reprod,2007,22(10):2733-2742.
[6]GUI J,XIONG F,LI J,et al.Effects of acupuncture on Th1,Th2 cytokines in rats of implantation failure[J].Evid Based Co mplement Atter nat Med,2012,2012:893023.doi:10.1155/2012/893023.
[7]PAPADAKIS K,PREHN J,NELSON V,et al.The role of thymus-expressed chemokine and its receptor CCR9 on lymphocytes in the regional specialization of the mucosal immune system[J].J Immunol,2000,165(9):5069-5076.
[8]van MOURIK MS,MACKLON NS,HEIJNEN CJ.Embr yonic i mplantation:cytokines,adhesion molecules,and i mmune cells in establishing animplantation environment[J].J Leukoc Biol,2009,85(1):4-19.
[9]GUI MOND MJ,WANG B,CROY BA.Engraft ment of bone marrow from severe combined i mmunodeficient(SCID)mice reverses the reproductive deficits in natural killer cell-deficient tg epsilon 26 mice[J].J Exp Med,1998,187(2):217-223.
[10]ASHKAR AA,DI SANTO JP,CROY BA.Interferon gamma contributes to initiation of uterine vascular modification,decidual integrity,and uterine natural killer cell maturation during nor mal murine pregnancy[J].J Exp Med,2000,192(2):259-270.
[11]DOMINGUEZ F,GALAN A,MARTIN J,et al.Hor monal and embryonic regulation of chemokine receptors CXCR1,CXCR4,CCR5 and CCR2Bin the hu man endometriu m and the hu man blastocyst[J].Mol Hu m Reprod,2003,9(4):189-198.
[12]CABALLERO-CAMPO P,DOMINGUEZ F,COLOMA J,et al.Hor monal and embryonic regulation of chemokines IL-8,MCP-1 and RANTES in the human endometrium during the widow of i mplantation[J].Mol Hum Reprod,2002,8(4):375-384.
[13]DRAKE P,RED-HORSE K,FISHER S.Reciprocal chemokine receptor and ligand expression in the human placenta:i mplications for cytotrophoblast differentiation[J].Dev Dyn,2004,229(4):877-885.
[14]STEWART I,PEEL S.Granulated metrial gland cells at i mplantation sites of the pregnant mouse uter us[J].Anat Embryol(Berl),1980,160(2):227-238.

