HCV核心蛋白对人肝癌细胞系SMMC-7721增殖的影响*
李志勤,孙长宇,余祖江,黄建敏,李建生,张 毅#
1)郑州大学第一附属医院感染科 郑州450052 2)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 3)郑州大学第一附属医院消化内科 郑州 450052
丙型肝炎病毒(hepatitis C virus,HCV)为有包膜的单股正链RNA病毒,其编码区只有一个开放阅读框,编码长3 010~3 030个氨基酸序列的蛋白前体,其中HCV核心蛋白是一种多功能蛋白,由191个氨基酸残基组成, 在慢性丙型肝炎、丙型肝炎肝硬化及肝细胞癌的致病过程中起到重要作用[1]。HCV核心蛋白通过影响线粒体功能,致使与过氧化反应有关的细胞生长相关基因表达异常;此外,HCV核心蛋白还通过调节细胞基因表达,影响细胞间的信号传导(如MAPK途径),从而导致转录因子活化和细胞周期的异常[2],但HCV的致癌机制尚不清楚。该研究将HCV核心蛋白质粒转染低侵袭性肝癌细胞系SMMC-7721,观察其对该细胞系增殖能力的影响。
1 材料与方法
1.1材料pcDNA3.0-C-EGFP重组质粒和pcDNA3.0(-)质粒、细胞系SMMC-7721由郑州大学第一附属医院感染科孙长宇教授惠赠。TRIREAGENA(美国Molecular Research Centre公司),200 U/mL Revert AIdTMHMinus M-MULV逆转录酶、5 U/mL Taq DNA聚合酶(华美生物公司),驴抗羊抗体HCV核心蛋白抗体(美国Santa Cruz公司),驴抗羊抗体、羊抗小鼠二抗(上海康成生物公司),强化化学发光试剂盒(美国Pierce公司),HCV核心蛋白 ELISA检测试剂盒(科华生物公司),MTT细胞增殖检测试剂盒(上海吉泰生物公司),细胞侵袭小室Transwell(孔径8.0 μm)、滤膜(孔径8.0 μm)均购自美国Costar公司,Matrigel(美国BD公司),Rohe PCR仪、Bio-Rad电泳仪、电转仪、96孔酶标仪。
1.2细胞转染将SMMC-7721细胞在含体积分数7%胎牛血清的RPMI 1640培养基中连续培养。转染前一天将细胞接种于6孔培养板,每孔2×105个细胞,过夜培养后,细胞分2组,分别进行pcDNA3.0-C-EGFP 重组质粒(观察组) 和 pcDNA3.0(-)质粒(空质粒组)转染,操作按照Lipofectamine2000转染手册进行。
1.3转染细胞HCV核心蛋白的检测
1.3.1 RT-PCR法检测转染细胞HCV核心蛋白的mRNA 细胞转染24 h后,用Trizol试剂提取RNA,逆转录得cDNA,以cDNA为模板,以β-actin为内参,进行PCR扩增。HCV核心蛋白引物序列如下:上游引物 5’-CGCGGATCCATGAGCACAAATCC-3’(1~14 bp),下游引物5’-CCGGAATTCGCAAC CGGGC-3’(505~516 bp)。PCR反应体系(50 μL):双蒸水34.5 μL,10×缓冲液5 μL,dNTPs(25 mmol/L)4 μL,Mg2+3 μL,模板DNA(45 ng)1 μL ,上、下游引物(10 pmol/L)各1 μL,高保真Taq酶0.5 μL。反应条件: 94 ℃ 2 min;94 ℃ 30 s, 50 ℃ 30 s, 72 ℃ 30 s, 10个循环;94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 20个循环;72 ℃ 7 min。PCR产物于10 g/L琼脂糖凝胶进行电泳,用凝胶成像系统照相分析。目的基因mRNA相对表达量=(目的基因条带面积×颜色强度)/(β-actin条带面积×颜色强度)。
1.3.2 Western blot法检测转染细胞HCV核心蛋白 收集转染2~3 d后的细胞,加入裂解液后破碎,采用考马斯亮蓝G250方法测定蛋白质浓度,取40 mg样品,加等体积的上样缓冲液后进行电泳分离,转膜,脱脂牛奶封膜2 h,加入HCV核心蛋白单克隆抗体(按1 000倍稀释)温育2 h,磷酸盐吐温缓冲液(PBST)洗膜3次,加入辣根过氧化酶标记的羊抗小鼠二抗温育1 h,PBST洗膜4次,用电化学发光显色系统进行显色。用Quantity one软件分析条带灰度值,以目的蛋白与内参β-actin条带灰度值的比值表示目的蛋白表达水平。
1.3.3 转染细胞培养上清中HCV核心蛋白的检测
取转染2~3 d后的细胞培养上清液100 μL,加入96孔板4 ℃包被过夜,硝酸盐缓冲液洗板5次,37 ℃封闭1 h,PBST洗板5次,加入HCV核心蛋白抗体10 μL/孔,37 ℃ 1 h,甩尽板内液体,用洗涤液洗涤反应板并去除水滴(在厚叠吸水纸上拍干),反复洗涤5次。将辣根过氧化酶偶联的驴抗羊抗体稀释后,加入反应孔内,PBS洗板5次。每孔加入50 μL底物A和底物B,轻轻混匀30 s,室温避光10 min。每孔加入100 μL终止液,轻轻振荡30 s,30 min内在450 nm处读吸光度(A)值,利用标准曲线计算蛋白表达量。
1.4转染细胞纤维连接蛋白黏附实验每孔100 μL纤维连接蛋白(10 mg/L)包被96孔板,以100 mg/L多聚赖氨酸和体积分数1%牛血清白蛋白(BSA)包被孔作为最大和最小黏附参照。每孔加入5×104个转染2~3 d后的细胞,37 ℃、体积分数5%CO2孵育2 h。用PBS洗涤除去未黏附细胞,多聚甲醛固定,结晶紫溶液染色25 min,每孔加入400 μL 体积分数0.5%TritonX-100过液,酶标仪测定590 nm处的A值。细胞黏附率=(A样品-ABSA包被)/(A多聚赖氨酸包被-ABSA包被)×100%。
1.5转染细胞增殖率的检测将转染2~3 d 后的细胞分别按(1.5~2.0)×104/孔的密度接种于96孔板,每孔100 μL,设立阴性对照组。采用MTT法观察细胞增殖情况,酶标仪检测波长为570 nm。每组8个复孔,重复3次。细胞增殖率=(实验组A-对照组A)/对照组A×100%。
1.6转染细胞侵袭和运动实验在Transwell上室加入100 μL Matrigel,37 ℃孵育2 h,加入无血清RPMI 1640稀释的1×105个转染2~3 d后的细胞悬液,下室加入500 μL 条件培养基;培养箱内孵育48 h,取出上室用棉棒擦去Matrigel和未侵袭细胞,多聚甲醛固定10 min,Giemsa染色15 min,取下滤膜,于200倍光镜下计数移至微孔膜下层的细胞(穿膜细胞数)。每个样本计数8个视野,取平均值。运动试验中除不加Matrigel外,余同侵袭实验。
1.7统计学处理采用SPSS 17.0进行数据分析。观察组和空质粒组HCV核心蛋白表达水平、细胞黏附率、侵袭和运动实验穿膜细胞数的比较采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 2组细胞HCV核心蛋白表达水平的比较2组细胞HCV核心蛋白mRNA、蛋白及培养上清HCV核心蛋白测定结果见表1。可以看出,观察组HCV核心蛋白表达水平高于空质粒组。
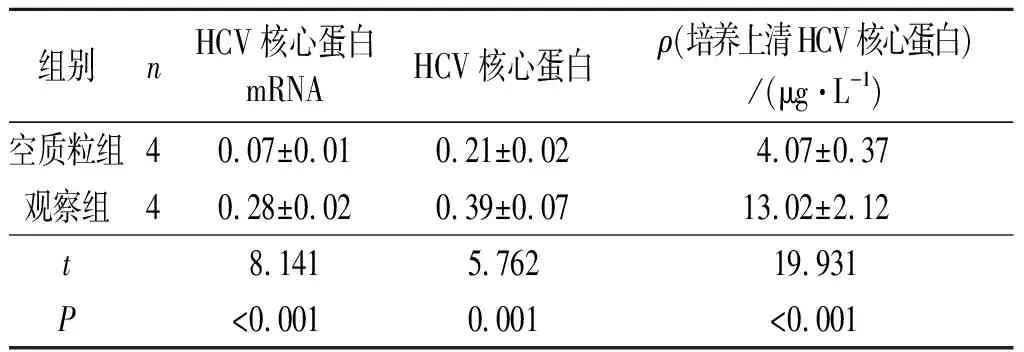
表1 2组HCV核心蛋白表达水平的比较
2.2细胞增殖率的比较阴性对照组、空质粒组和观察组细胞增殖率分别为(20.4±2.1)%、(16.9±4.6)%和(46.5±3.3)%,3组比较,差异有统计学意义(F=68.231,P=0.001),观察组细胞增殖率明显高于空质粒组(P=0.002)。
2.3细胞黏附、侵袭和运动实验结果观察组细胞黏附率高于空质粒组,侵袭和运动实验穿膜细胞数大于空质粒组,见表2。

表2 2组细胞黏附、侵袭和运动实验结果
3 讨论
HCV核心蛋白除了与病毒核衣壳的组成有关以外,还参与病毒颗粒的装配和释放,并与宿主糖蛋白相互作用,完成病毒颗粒的成熟与分泌。HCV核心蛋白通过与细胞内重要调节蛋白结合,影响某些重要信号通路的传递,进而直接参与宿主细胞的脂质代谢、免疫调节、细胞信号转导、细胞凋亡以及细胞转化过程,与HCV感染后肝病的发生发展密切相关。
大量研究[3-6]表明HCV核心蛋白能够与介导细胞凋亡的诸多相关信号分子相互作用,诱导或抑制细胞的凋亡,具体包括Fas抗原、Bcl-2B家族、淋巴毒素β受体等信号分子。抑制肝细胞凋亡一直被认为是HCV核心蛋白导致肝细胞癌发生的重要机制之一。也有研究[7]证明HCV核心蛋白能激活或上调NF-κB的活性,NF-κB与细胞凋亡关系密切,参与多种凋亡相关基因的转录调控,具有抑制细胞凋亡而导致细胞癌变的作用。罗琼等[8]报道表达HCV核心蛋白的HepG2细胞系Cyclin D1和pRb/p130的表达下调,细胞生长周期被抑制。另有报道[9]HCV核心蛋白通过增强Wnt/β信号传导途径导致肝癌细胞增长。该研究中,SMMC-7721细胞系是低侵袭性不转移的人肝癌细胞系,在转染pcDNA3.0-C-EGFP 重组质粒后高表达HCV核心蛋白;体外功能实验结果提示,转染pcDNA3.0-C-EGFP 重组质粒后,SMMC-7721细胞黏附、运动和侵袭能力明显增强,同时细胞增殖能力也明显增强。由此推测HCV核心蛋白可以促进SMMC-7721细胞系的增殖,HCV核心蛋白与HCV感染所致肝细胞癌的发生有直接关系,但HCV核心蛋白致人肝细胞发生恶性转化的具体分子机制还有待于进一步的研究和阐明。
[1] Angus AG, Loquet A, Stack SJ,et al. Conserved glycine 33 residue in flexible domain Ⅰ of hepatitis C virus core protein is critical for virus infectivity[J]. J Virol,2012,86(2): 679
[2] 焦健,王江滨,赵平.丙型肝炎病毒蛋白在转基因模型中的作用机制研究进展[J].世界华人消化杂志,2010,18(10):1016
[3] Zhu W, Wu C, Deng W, et al.Inhibition of the HCV core protein on the immune response to HBV surface antigen and on HBV gene expression and replication in vivo[J]. PLoS One, 2012, 7(9):e45146
[4] Braconi C, Valeri N, Gasparini P,et al.Hepatitis C virus proteins modulate microRNA expression and chemosensitivity in malignant hepatocytes[J]. Clin Cancer Res, 2010,16(3):957
[5] Machida K, Tsukamoto H, Liu JC, et al. c-Jun mediates hepatitis C virus hepatocarcinogenesis through STAT3 and nitric oxide-dependent impairment of oxidative DNA repair[J]. Hepatology, 2010,52(2):480
[6] 廖巧芳,李志花,陈汝福,等.丙型肝炎病毒核心蛋白对胆管癌细胞NFAT1基因表达的影响[J].南方医科大学学报,2012,32(6):789
[7] 陈少雅,陈崇宏,杨丽娟,等.褪黑素对HeLa细胞的生长及NF-κB蛋白表达的影响[J].中国药理学通报,2011,27(1):73
[8] 罗琼,姜傥,陈景,等.丙型肝炎病毒核心蛋白对HepG2 细胞生长周期的影响[J].中国病理生理杂志,2012,28(4):631
[9] Liu J, Ding X, Tang J,et al. Enhancement of canonical Wnt/β-catenin signaling activity by HCV core protein promotes cell growth of hepatocellular carcinoma cells[J]. PLoS One, 2011, 6(11):e27496
——一道江苏高考题的奥秘解读和拓展

