p53抑制剂pifithrin-α对肝原代细胞增殖的影响
刘曙正,Henrik HS,段广才
1)郑州大学公共卫生学院流行病学教研室 郑州 450001 2)河南省肿瘤医院肿瘤防治办公室 郑州 450008 3)挪威奥斯陆大学医院病理研究所 奥斯陆 挪威 0027
p53基因与肿瘤的发生密切相关,在所有恶性肿瘤中,50%以上会出现该基因的突变[1]。大多数文献报道p53起到抑制细胞增殖和促进细胞凋亡的作用,但有研究表明肝细胞生长因子可诱导肝细胞表达P53蛋白,提示P53蛋白可能也具有促进细胞增殖的作用[2]。从肝组织中提取肝细胞(肝原代细胞)体外培养后,细胞具有与体内相似的生理过程,因此常用来代替动物模型研究体内细胞的生理机制。肝细胞体外培养后即从静止期进入G1期,但只有在外源性的生长因子如表皮生长因子(epidermal growth factor,EGF)刺激下,细胞才能通过G1/S期限制点,继续增殖。EGF刺激细胞后可以激活MAPK信号传导通路,最终Erk磷酸化后进入细胞核。而持续的Erk磷酸化可以促进Cyclin D的表达[3-5]。细胞周期由不同种类的周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)和Cyclin结合推进,而CDK蛋白水平在各个细胞周期中保持恒定,因此细胞周期的推进主要依赖Cyclin水平的变化。Cyclin E和Cyclin D是G1期的主要调控蛋白。P21是P53转录因子的直接下游产物之一[6],因此可以间接反映P53蛋白的功能水平。该研究观察了p53抑制剂pifithrin-α对肝原代细胞增殖及增殖相关蛋白P53、P21、Cyclin D、Cyclin E及磷酸化Erk(pErk)蛋白表达的影响,探讨P53蛋白在肝细胞增殖中的作用及机制。
1 材料与方法
1.1试剂及仪器氚标记的胸苷、 Kodak Image Station 4000R购自英国GE Healthcare 公司,pifithrin-α购自美国Calbiochem公司。Williams medium E培养液购自美国Gibco公司。DC protein assay试剂购自美国Bio-Rad公司。Cyclin E和P53抗体、Thr202/204位点磷酸化的Erk抗体购自美国Cell Signalling Technology公司,Cyclin D和P21抗体购自美国Upstate Biotechnology公司,β-tubulin抗体购自Sigma Aldrich公司。二抗为HRP连接的山羊源性抗兔IgG、驴源性抗鼠IgG,均购自Sigma Aldrich公司。
1.2肝原代细胞的提取和培养雄性成年Wistar大鼠, 体质量200~220 g。使用改良的体外胶原酶灌注两步分离术提取肝原代细胞[7-8],按20 000 cm-2的密度于Williams medium E培养液、37 ℃、体积分数5% CO2条件下培养。
1.3细胞增殖检测将肝原代细胞培养于6孔板上,每3孔为一组,于培养23 h后分别加入pifithrin-α 0、10、20和30 μmol/L,1 h后添加10 nmol/L EGF诱导24 h, 然后添加氚标记的胸苷(1 μCi/L),EGF诱导30、36和48 h后收集细胞,用三氯乙酸冲洗2×10 min。未被冲洗掉的细胞由0.3 mL/孔的1 mol/L KOH溶解,用液体闪烁仪进行放射性计数,使用DC protein assay检测。用放射性计数与细胞蛋白浓度的比值表示增殖水平。
1.4P53、P21、CyclinD、CyclinE、pErk蛋白的检测将肝原代细胞培养于6孔板上,每6孔为一组,对照组常规培养,EGF组用10 nmol/L的EGF诱导培养,EGF+pifithrin-α组用30 μmol/L的pifithrin-α和10 nmol/L的EGF诱导培养(方法同1.3)。EGF诱导24、30 h后收集细胞,Western blot法检测P53、P21、Cyclin D、Cyclin E、pErk蛋白(抗体均按1 000倍稀释),以β-tubulin为内参。使用Kodak Image Station 4000R测定条带灰度值,以目标蛋白与β-tubulin条带灰度值的比值表示目标蛋白的相对表达量。
1.5统计学处理采用 SPSS 17.0处理数据。 采用4×3析因设计的方差分析比较不同培养条件下细胞增殖水平;因蛋白表达水平方差不齐,故使用Kruskal-WallisH检验比较各组蛋白的表达水平;检验水准α=0.05。
2 结果
2.1细胞增殖检测结果见表1。由表1可知,pifithrin-α在各个时间点上对EGF诱导的肝原代细胞的增殖均有抑制作用,且抑制程度随pifithrin-α浓度的增大而增加。

表1 细胞增殖测定结果(n=3) pCi·L/g
F剂量=54.690,F时间=214.370,F交互=50.450,P均<0.001。
2.2目标蛋白表达水平检测结果各蛋白检测结果见图1、表2。可以看出,3组细胞P53、Cyclin E蛋白表达水平差异无统计学意义,但EGF组P21、Cyclin D及 pErk蛋白表达水平升高,而EGF+pifithrin-α组P21、Cyclin D及pErk表达水平较EGF组降低。

图1 EGF诱导后各组细胞P53、P21、Cyclin D、Cyclin E及pErk蛋白的表达
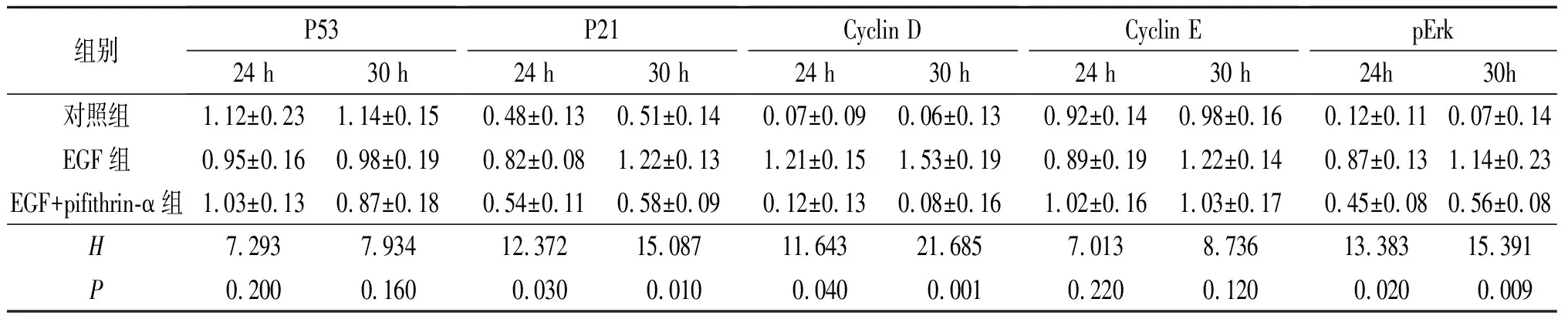
表2 各组细胞目标蛋白表达水平检测结果(n=6)
3 讨论
P53蛋白是人源性或鼠源性TGFα的转录起始因子[9]。EGF具有与TGFα相似的结构,可与相同的受体EGFR结合,同样可以激活MAPK通路,最终Erk磷酸化后进入细胞核。而持续的Erk磷酸化可以促进Cyclin D的表达[3-5]。Cyclin D和Cyclin E分别与CDK2和CDK4结合成复合物,磷酸化激活Rb蛋白家族,Rb蛋白依次磷酸化后释放与之结合的E2F因子并促使细胞进入S期[7,9]。
pifithrin-α是P53抑制剂,通过阻止P53蛋白进入细胞核发挥其生理作用。该研究结果显示,pifithrin-α可以抑制EGF诱导的肝原代细胞的增殖;实验中虽然未能检测到P53蛋白表达有变化,但EGF诱导后,肝原代细胞P21表达增高,也间接说明EGF激活了P53蛋白,提示P53蛋白在肝细胞增殖中具有一定作用。
EGF诱导后肝原代细胞Cyclin E的表达水平不变而Cyclin D的表达增高,说明Cyclin D是肝细胞增殖的主要调控蛋白。而pifithrin-α抑制EGF诱导的肝原代细胞Cyclin D的表达,也证实了P53蛋白通过调控Cyclin D的表达促进细胞增殖。作者还观测到pifithrin-α可以抑制肝原代细胞Erk的磷酸化水平,这与文献[8]报道结果一致。因为Cyclin D并不是P53蛋白的转录调控产物,所以P53蛋白可能是通过转录生成的TGFα激活MAPK传导通路,从而参与Cyclin D表达的调控。
综上所述,P53蛋白具有促进肝原代细胞增殖的作用,其作用机制可能与转录生成的TGFα激活MAPK信号通路后,上调Cyclin D的表达有关,但其具体分子机制尚需进一步研究证实。肝癌细胞中p53基因突变并不少见,因此必然存在某种补偿机制确保细胞在P53蛋白功能缺失的情况下继续增殖,研究这种补偿机制可为肝癌的分子靶向治疗提供新的思路。
[1] Soussi T, Wiman KG. Shaping genetic alterations in human cancer: the p53 mutation paradigm[J].Cancer Cell, 2007,12(4):303
[2] Inoue Y, Tomiya T, Yanase M, et al. p53 may positively regulate hepatocyte proliferation in rats[J]. Hepatology, 2002,36(2):336
[3] Thoresen GH, Guren TK, Christoffersen T. Role of ERK, p38 and PI3-kinase in EGF receptor-mediated mitogenic signalling in cultured rat hepatocytes: requirement for sustained ERK activations[J]. Cell Physiol Biochem, 2003, 13(4):229
[4] Liu Y, Hock JM, Sullivan C,et al. Activation of the p38 MAPK/Akt/ERK1/2 signal pathways is required for the protein stabilization of CDC6 and cyclin D1 in low-dose arsenite-induced cell proliferation[J]. J Cell Biochem, 2010,111(6):1546
[5] Recchia AG, Musti AM, Lanzino M, et al. A cross-talk between the androgen receptor and the epidermal growth factor receptor leads to p38MAPK-dependent activation of mTOR and cyclinD1 expression in prostate and lung cancer cells[J]. Int J Biochem Cell Biol, 2009,41(3):603
[6] Eswaran J, Li DQ, Shah A, et al. Molecular pathways: targeting p21-activated kinase 1 signaling in cancer-opportunities, challenges, and limitations[J]. Clin Cancer Res, 2012,18(14):3743
[7] Bartek J, Bartkova J, Lukas J. The retinoblastoma protein pathway in cell cycle control and cancer[J]. Exp Cell Res, 1997, 237(1):1
[8] Sherr CJ, McCormick F. The RB and p53 pathways in cancer[J]. Cancer Cell, 2002, 2(2):103
[9] Singh S, Upadhyay AK, Ajay AK, et al. p53 regulates ERK activation in carboplatin induced apoptosis in cervical carcinoma: a novel target of p53 in apoptosis[J]. FEBS Lett, 2007, 581(2):289

