脑胶质瘤术后放疗后复发和放射性脑坏死磁共振弥散张量成像鉴别*
李永丽,连建敏,窦社伟,闫峰山,史大鹏,徐俊玲
河南省人民医院放射科 郑州 450003
传统MRI技术对脑胶质瘤术后放疗后复发和放射性脑坏死鉴别困难。磁共振弥散张量成像(diffusion tensor imaging,DTI)是基于弥散加权成像(diffusion weighted imaging,DWI)发展而来的成像技术,可同时获得反映水分子弥散特性的表观弥散系数(apparent diffusion coefficient,ADC)图和各相异性分数(fractional anisotropy,FA)图,并可通过ADC和FA定量分析组织微细结构。应用DWI鉴别肿瘤复发的研究近年来可见文献报道,但研究结果却存在较大差异[1-5],而DTI对脑胶质瘤术后放疗后复发和放射性脑坏死的鉴别研究目前国内外报道尚少。作者自2006年12月开始,对河南省人民医院收治的脑胶质瘤术后放疗后常规MRI出现新强化病灶患者加做DTI检查,以评价DTI对胶质瘤术后放疗后复发和放射性脑坏死的鉴别价值。
1 对象与方法
1.1研究对象35例患者中男19例,女16例,年龄21~65岁。所有患者均满足下列条件:①脑实质内肿瘤手术切除标本经组织学检查证实为胶质瘤(WHO组织学分级分别为2级4例,3级14例,4级17例)。②所有患者术后均行全程分割放射治疗,放射总剂量48.0~68.8 Gy。③放射治疗后6~52个月(中位时间17个月),传统MRI检查在原病灶区或放疗区再次出现新的强化病灶。④DTI检查后至病变性质确诊前的随访期内患者未再接受任何抗肿瘤治疗。
1.2脑胶质瘤复发和放射性脑坏死诊断标准肿瘤复发诊断标准为符合以下两条之一:①脑组织活检或二次手术后组织学检查可见有活性的胶质瘤细胞。②影像学随访强化病灶逐渐扩大,周围水肿及占位效应逐渐加重,患者临床表现逐渐恶化。不能诊断为复发即诊断为放射性脑坏死。
1.3影像学检查采用德国Siemens 3.0 T Trio 系统磁共振扫描仪。首先行头颅轴位T1WI、T2WI及FLAIR序列扫描,层厚5 mm,间隔1 mm;视野230×230,矩阵128×128;T1WI:TR/TE,400 ms/15 ms;T2WI:TR/TE,3 500 ms/105 ms;FLAIR:TR/TE/TI,10 000 ms/175 ms/2 200 ms,激励次数1次;DTI采用弥散加权单发射平面回波序列,64个方向施加敏感梯度;TR/TE/NEX:5 000 ms/97 ms/1 ms, b=0和1 000 s/mm2。层厚5 mm,间隔1 mm;视野230×230,矩阵128×128;扫描时间5 min 42 s。
1.4图像后处理及病例分组将扫描原始数据传输到工作站,使用Siemens公司提供的Syngo MR B15软件进行后处理,分别得到ADC图和FA图,在ADC图和FA图上的病变强化区和近侧水肿区选择感兴趣区(region of interest,ROI)3~4 mm2,在对侧大脑半球相应脑白质区选择相同大小ROI作为对照,在每一病变区内至少应用5个ROI进行ADC值和FA值测量,计算强化区和水肿区的ADC比值(病变侧ADC值/对照侧ADC值)和FA比值(病变侧FA值/对照侧FA值)。最后行3D神经纤维束重建。
1.5统计学处理采用SPSS 11.5进行分析,应用两独立样本t检验比较肿瘤复发组和放射性脑坏死组间ADC比值和FA比值的差异;对病变强化区ADC比值和FA比值行受试者工作特征(receiver operating characteristics,ROC)曲线分析,计算曲线下面积(area under curve,AUC),找出最佳诊断临界值,计算DTI诊断复发的敏感性、特异性和准确性,检验水准α=0.05。
2 结果
经组织学检查确诊23例,临床观察结合反复的影像学随访确诊12例。随访时间6~31个月,中位时间13个月。根据1.2项的诊断标准将35例患者分为肿瘤复发组(20例)和放射性脑坏死组(15例)。2组患者病变强化区和水肿区ADC值、ADC比值、FA值、FA比值结果见表1。代表性MRI图、ADC图、FA图及3D神经纤维束成像图分别见图1、2。

表1 2组患者病变强化区、水肿区ADC值、ADC比值及FA值、FA比值结果 ×10-3mm2/s
*t,检验。
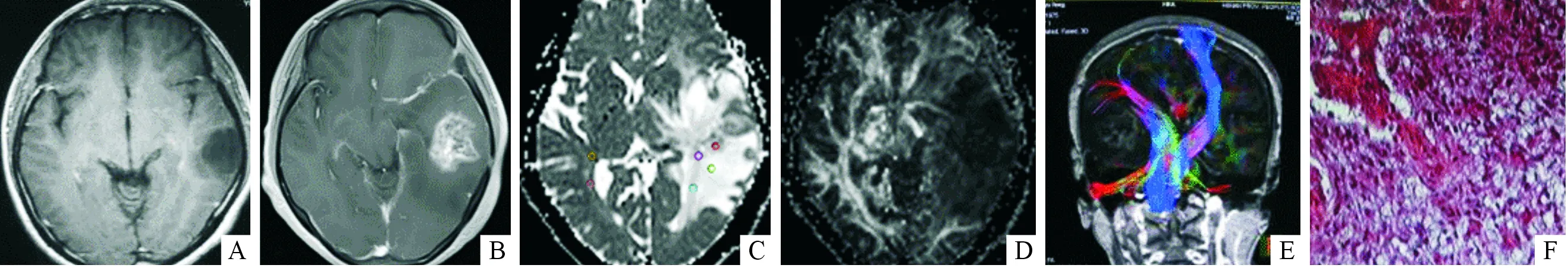
图1 左颞叶Ⅱ级星形细胞瘤术后放疗后肿瘤复发

图2 右额顶叶间变性星形细胞瘤术后放疗后放射性脑损伤
ROC曲线(图3)分析结果显示,病变强化区ADC比值的AUC为0.86,最佳诊断界值为1.65;FA比值的AUC为0.85,最佳诊断界值为0.36。将患者病变强化区ADC比值<1.65和(或)FA比值>0.36作为肿瘤复发判断标准时,3例肿瘤复发和2例非肿瘤复发被错误分类。故DTI对肿瘤复发的诊断敏感性、特异性和准确性分别为85.0%(17/20)、86.7%(13/15)和85.7%(30/35)。

图3 肿瘤复发者ROC曲线
3 讨论
胶质瘤术后极易复发,放射治疗是胶质瘤术后为防止或延缓肿瘤复发最常用的辅助治疗方法。放射性脑坏死是胶质瘤术后放疗后最常见的非肿瘤复发病变,常见于照射总剂量大于50 Gy患者,可在放疗后数月至数年发生,临床症状和常规影像学表现均与复发非常相似,二者鉴别一直是临床治疗面临的难题。长期随访可发现脑坏死组织病变逐渐吸收好转,而肿瘤复发病变则进展扩大,虽可将二者加以鉴别,但会延误肿瘤复发患者的治疗时机。二次手术或脑穿刺活检是最准确的鉴别方法,但会给患者带来巨大风险和创伤。功能性磁共振技术可从不同角度反映肿瘤复发特点,为鉴别诊断提供更多信息,对胶质瘤复发有重要的鉴别价值[1-3]。DTI可敏感反映活体组织内水分子的微观扩散运动,同时获得反映水分子弥散特性的ADC图和FA图,可更全面反映不同病变之间水分子弥散状态的差异。理论上胶质瘤复发和放射性脑坏死的组织结构、生化特性和血管供应等都有显著不同,这两种病理状态下水分子的弥散能力也应该不同,从而产生不同的ADC值和FA值,据此有望将两种病变加以区别。
根据病理组织学分析,复发肿瘤组织内含有密集的胶质瘤细胞,限制了水的弥散,而坏死组织水分子弥散能力较前者大,应具有较大的ADC值;星形细胞肿瘤内,正常纤维和细胞结构均可被肿瘤细胞破坏,导致水弥散方向性减低,FA值显著低于正常脑组织,而坏死组织内则几乎无正常纤维和细胞结构,故而具有更低FA值[4-5]。以往应用DWI获得的ADC值或ADC比值进行的类似研究中,多数学者[4-6]也认为肿瘤复发ADC比值低于放射性脑损伤。Hein等[4]应用平均ADC值和ADC比值对比研究了18例原发高度恶性胶质瘤术后放疗后的强化病变,6例复发胶质瘤平均ADC值和ADC比值均明显低于12例放射性脑坏死,该研究显示ADC比值大于1.62仅见于放射性脑坏死,小于1.62仅见于肿瘤复发。但也有少部分学者[7-8]得出了相反结果,认为肿瘤复发的ADC值高于放射性脑坏死。Sundgren等[8]分析认为造成肿瘤复发高ADC值的原因可能与细胞外间隙扩大及高级别胶质瘤内易发坏死有关,而放射性脑坏死弥散减低则可能与病变区胶质增生和纤维化限制了水分子的弥散有关。FA值在以往肿瘤组织学类型和分级诊断中已显示价值[9-10],但将其用于胶质瘤复发和放射性脑坏死鉴别目前尚仅见少数个案报道[11]。Kashimura等[11]曾对3例胶质瘤术后放疗后患者的新强化病灶进行FA值测量,结果发现2例肿瘤复发FA值分别为0.29和0.27,1例放射性脑损伤FA值为0.17,其结果与前述理论相一致,但其研究例数太少。作者此次的研究结果显示,肿瘤复发组病变强化区ADC比值低于放射性脑坏死组,FA比值高于放射性脑坏死组。ROC曲线分析显示,强化区ADC比值和FA比值诊断复发有一定的应用价值,AUC分别为0.86和0.85;将病变强化区ADC比值<1.65和(或)FA比值>0.36作为肿瘤复发判断标准时,DTI的诊断敏感性、特异性和准确性分别为85.0%、86.7% 和85.7%。说明DTI对脑胶质瘤术后放疗后复发具有很高的诊断价值。该研究未单纯应用病变区ADC值或FA值,而是应用标准化的ADC比值和FA比值作为鉴别诊断参考指标,避免了不同研究之间因所用设备、技术方法及患者个体差异等可能带来的误差,更能合理评价病变区域的弥散状态,具有更大的参考和应用价值。
综上所述,MR DTI检查对胶质瘤术后放射后复发的检出具有很大价值;但该方面研究目前尚处于探索阶段,其临床应用价值尚有待更深入的探讨。
[1] Jain R, Scarpace LM, Ellika S,et al.Imaging response criteria for recurrent gliomas treated with bevacizumab:role of diffusion weighted imaging as an imaging biomarker[J].J Neurooncol,2010,96(3):423
[2] 徐俊玲,李永丽,连建敏,等.二维氢质子磁共振波谱分析鉴别胶质瘤术后复发和放射性脑损伤[J].中国医学影像技术,2010,26(4):639
[3] Xu JL, Shi DP, Dou SW,et al. Distinction between postoperative recurrent glioma and delayed radiation injury using MR perfusion weighted imaging[J]. J Med Imaging Radiat Oncol, 2011, 55(6):587
[4] Hein PA, Eskey CJ, Dunn JF, et al. Diffusion weighted imaging in the follow-up of treated high-grad gliomas: tumor recurrence versus radiation injury[J]. Am J Neuroradiol, 2004,25(1):201
[5] Zhou XJ, Leeds NE, Kumar AJ, et al. Differentiation of tumor recurrence from treatment-induced necrosis using quantitative diffusion MRI[J].Proc Intl Soc Mag Reson Med, 2010,9(3):726
[6] Tung GA, Evangelista P, Rogg JM, et al. Diffusion-weighted MR imaging of rim-enhancing brain masses: is markedly decreased water diffusion specific for brain abcess?[J]. AJR, 2001,177(3):709
[7] Biousse V, Newman NJ, Hunter SB, et al. Diffusion weighted imaging in radiation necrosis[J]. J Neurol Neurosurg Psychiatry, 2003,74(3):382
[8] Sundgren PC, Fan XY, Weybright P, et al. Differentiation of recurrent brain tumor versus radiation injury using diffusion tensor imaging in patients with new contrast-enhancing lesions[J]. Magn Reson Imaging, 2006,24(9):1131
[9] Beppu T, Inoue T, Shibata Y, et al. Measurement of fractional anisotropy using diffusion tensor MRI in supratentorial astrocytic tumors[J]. J Neurooncol, 2003,63(2):109
[10]Sinha S, Bastin ME, Whittle IR, et al. Diffusion tensor MR imaging of high-grade cerebral gliomas[J]. Am J Neuroradiol, 2002,23(4):520
[11]Kashimura H, Inoue T, Beppu T, et al. Diffusion tensor imaging for differentiation of recurrent brain tumor and radiation necrosis after radiotherapy-three case reports[J]. Clin Neurol Neurosurg, 2007,109(1):106

