子痫前期患者胎盘组织中DLX3和Syncytin的表达
赵先兰,刘 彩,刘 传
郑州大学第一附属医院妇产科 郑州 450052
子痫前期是妊娠期高血压疾病中的一种,该病严重影响母婴健康,是孕产妇和围产儿病死的主要原因。近年来,随着胎盘滋养细胞缺血缺氧及“胎盘浅着床”学说日益受到关注,探索有关影响胎盘滋养细胞生长分化能力的因素已成为研究子痫前期发病机制的热点之一[1-3]。DLX3基因是DLX基因家族中的一员,含有高度保守的转录序列,在调控胚胎生长发育的许多方面起重要作用。研究[4]显示DLX3基因可能参与胎盘滋养细胞的生长分化,但其与子痫前期的关系尚未见报道。Syncytin是人内源性逆转录缺陷病毒(HERV)系列中HERV-W 编码的糖包膜蛋白,Mi 等[2]首次报道Syncytin可介导胎盘滋养细胞的生长分化。作者通过检测DLX3和Syncytin mRNA和蛋白在子痫前期胎盘组织中的表达,探索2者在子痫前期发病中的可能作用及相互关系。
1 对象与方法
1.1研究对象选择2011年3月至12月在郑州大学第一附属医院产科分娩的子痫前期患者60例,诊断标准及分类参照文献[4],其中轻度子痫前期30例,年龄和孕周分别为(31.69±3.61)岁、(35.81±2.16)周,重度子痫前期30例,年龄及孕周分别为(32.16±4.82)岁、(34.73±2.92)周。同时选择同期正常孕妇30例作为对照,年龄及孕周分别为(28.62±2.81)岁、(37.91±2.51)周。研究对象均无其他妊娠期合并症及并发症,各组年龄、孕周等一般情况均衡。
1.2标本的采集、处理及保存胎盘娩出15 min内,取近脐带根部胎盘母面约1 cm2的组织2块,冲洗干净,即刻分装于经焦炭酸二乙酯(diethylpyrocarbonate, DEPC)水处理过的2 mL冻存管,置于-80 ℃冰箱中保存。1份用于RT-PCR,另1份用于ELISA。
1.3胎盘组织中DLX3和SyncytinmRNA的检测
按Trizol总RNA提取试剂盒(美国Invitrogen公司)说明书提取胎盘组织总RNA。紫外分光光度计鉴定RNA的纯度,15 g/L琼脂糖凝胶电泳鉴定RNA的完整性。每个标本分别取8 μL总RNA逆转录得cDNA,操作严格按逆转录试剂盒说明书进行。PCR反应体系为50 μL,其中DNA聚合酶(5 kU/L)1 μL,上下游引物各1 μL,2.5 mmol/L dNTPs 4 μL,cDNA 2 μL,10×Easy Tap Buffer 5 μL,DEPC水 36 μL。反应条件为94 ℃ 2 min;94 ℃ 30 s,55 ℃ 35 s,72 ℃ 2 min,循环35次;72 ℃ 6 min。引物序列见表1。

表1 引物序列
取3 μL PCR产物用15 g/L琼脂糖凝胶电泳,电泳条件90 V电压下20 min,70 V电压下20 min。凝胶成像系统拍摄图像,用D-140图像记录分析系统进行分析。以目的基因与内参条带灰度值的比值作为目的基因mRNA的相对表达量。
1.4胎盘组织中DLX3和Syncytin蛋白的检测采用固相夹心ELISA法测定,具体步骤严格按照试剂盒(武汉博士德生物工程公司)说明书进行。
1.5胎儿脐动脉血流S/D值及胎头双顶径测定终止妊娠前3天内分别用彩色多普勒超声测定胎儿脐动脉血流S/D值及胎头双顶径。
1.6统计学处理采用SPSS 17.0进行数据分析,3组胎盘组织中DLX3和Syncytin 表达、胎儿脐动脉血流S/D值及胎头双顶径的比较采用单因素方差分析,两两比较采用LSD-t检测;轻(重)度子痫前期组DLX3与Syncytin表达相关性,轻(重)度子痫前期组DLX3或Syncytin蛋白的表达与胎儿脐动脉血流S/D值和胎头双顶径的关系均采用Pearson相关分析进行评估,检验水准α=0.05。
2 结果
2.1 3组胎盘组织中DLX3、SyncytinmRNA和蛋白的表达以及胎儿脐动脉血流S/D值、胎头双顶径测量结果见图1、表2。
2.2子痫前期患者胎盘组织中DLX3与Syncytin表达的相关关系轻、重度子痫前期组胎盘组织中DLX3与Syncytin的表达均呈正相关(mRNA:r=0.429、0.513,蛋白:r=0.579、0.677,P<0.05)。
2.3子痫前期患者胎盘组织中DLX3、Syncytin蛋白的表达与胎儿脐动脉血流S/D值及胎头双顶径的关系轻度子痫前期组DLX3和Syncytin蛋白的表达与胎儿脐动脉血流S/D值均呈负相关(r=-0.324和-0.352,P<0.05),与胎头双顶径均呈正相关(r= 0.431和0.510,P<0.05)。重度子痫前期组DLX3和Syncytin蛋白的表达与胎儿脐动脉血流S/D值均呈负相关(r=-0.624和-0.637,P<0.05),与胎头双顶径均呈正相关(r=0.536和0.617,P<0.05)。
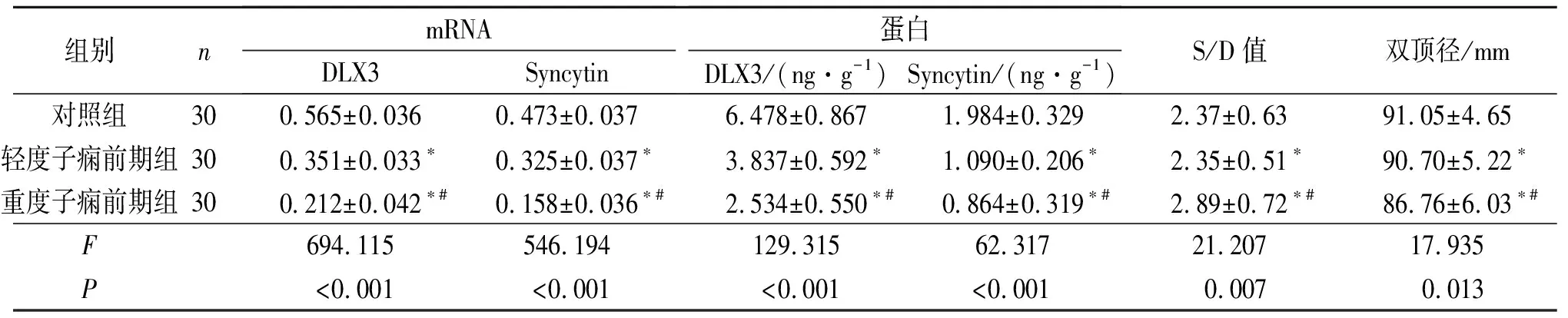
表2 3组胎盘组织中DLX3、Syncytin mRNA和蛋白的表达及胎儿脐动脉血流S/D值、胎头双顶径的测量结果比较
*与对照组比较,P<0.05; #与轻度子痫前期组比较,P<0.05。
3 讨论
3.1DLX3与子痫前期DLX3含有高度保守的转录序列,能够编码一种通过同源域结合DNA并对下游靶基因表达进行调节的特殊转录因子。DLX3在许多细胞的功能发育过程中发挥重要的转录调控作用,如牙胚、颌面部、毛囊以及成骨细胞等的发育过程均有DLX3基因的参与[5]。
人DLX3基因与鼠DLX3基因高度同源。在小鼠模型中,当敲除DLX3基因后会因胎盘发育障碍导致小鼠胚胎死亡,DLX3主要在小鼠胎盘滋养细胞中表达,缺失DLX3可能会影响胎盘迷路的扩建[3]。Chui 等[1]研究发现,在人类早期妊娠和足月妊娠的胎盘组织中,DLX3广泛分布于绒毛细胞滋养细胞、合体滋养细胞、微血管内皮细胞以及一些胎盘间叶组织的基质细胞。因此,推测DLX3参与滋养细胞的增殖分化以及胎盘血管床的构建。DLX3表达失调,可能引起胎盘形态异常及功能障碍,进而导致病理妊娠的发生。
作者利用RT-PCR和ELISA方法在子痫前期患者的胎盘组织中检测到DLX3 mRNA和蛋白的表达均低于对照组,且重度组低于轻度组,提示子痫前期的发病与胎盘组织中DLX3的表达下调有关,且其表达程度与疾病严重程度有关。
3.2Syncytin与子痫前期Syncytin只在胎盘组织中特异性高表达,通过介导滋养细胞的分化融合,从而在胎盘发育发挥重要作用[6-7]。
近年来研究[8-9]表明,Syncytin表达减少可能导致合体滋养细胞形成减少,浸润能力下降,影响胎盘滋养层的血管构建和功能完善,导致胎盘低灌注,绒毛缺血缺氧,此病理生理变化过程符合子痫前期形成的“胎盘浅着床”学说。胡蓉等[10]研究发现子痫前期滋养细胞发育异常可能与缺氧导致Syncytin表达下降有关。而Syncytin表达下降又进一步影响合体滋养细胞形成,加重胎盘缺血缺氧。
该研究结果显示,子痫前期组胎盘组织中的Syncytin mRNA和蛋白表达均显著低于对照组,且重度组低于轻度组,提示Syncytin低表达不利于绒毛细胞滋养细胞的增殖分化及浸润,可导致胎盘滋养层和血管功能紊乱,其表达与子痫前期的发病及疾病进展有关。
3.3子痫前期胎盘组织中DLX3与Syncytin表达的关系研究[11]发现在诱导BeWo细胞分化过程中,DLX3和Syncytin的表达均较对照组显著升高;通过cDNA质粒转染技术使BeWo细胞中DLX3过度表达,检测到Syncytin表达随之显著升高。Chui等[11]利用siRNA技术使BeWo细胞中DLX3低表达,检测到Syncytin的表达随之显著下降。
该研究结果显示,在轻度子痫前期和重度子痫前期的胎盘组织中,DLX3与Syncytin mRNA 和蛋白的表达水平均呈正相关,提示DLX3可能是Syncytin的上游调控因子之一,2者共同参与指导绒毛细胞滋养细胞向合体滋养细胞分化,在维持胎盘正常形态和功能方面发挥重要作用。
3.4子痫前期患者胎盘组织DLX3与Syncytin蛋白的表达与临床指标的关系脐动脉血流S/D值随孕周增大而逐渐降低,这表明胎盘逐渐成熟,胎儿胎盘循环阻力下降使脐动脉在舒张期仍有足够的血流来满足胎儿生长发育。 该研究结果显示子痫前期组DLX3与Syncytin的蛋白表达与脐动脉血流S/D值均呈负相关,与胎头双顶径均呈正相关,进一步提示子痫前期患者胎盘组织中DLX3、Syncytin的表达水平降低影响胎盘血管床的构建及功能,导致胎盘缺血缺氧及血管阻力增大,从而影响胎儿血供及其生长发育。
综上所述,DLX3、Syncytin低表达与子痫前期的发病有关,对DLX3与Syncytin 的研究有助于进一步了解子痫前期的发病机制。
[1] Chui A, Pathirage NA, Johnson B, et al. Homeobox gene distal-less 3 is expressed in proliferating and differentiating cells of the human placenta[J]. Placenta, 2010, 31(8): 691
[2] Mi S, Lee X, Li X, et al. Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis[J]. Nature, 2000, 403(6771): 785
[3] Berghorn KA, Clark PA, Encarnacion B, et al. Developmental expression of the homeobox protein Distal-less 3 and its relationship to progesterone production in mouse placenta[J].J Endocrinol, 2005, 186(2): 315
[4] 乐杰.妇产科学[M].7版.北京:人民卫生出版社,2008:84
[5] 荣恩光,王志鹏,张志威,等.中国美利奴羊DLX3基因3’UTR的多态性及其与羊毛品质性状的关联分析[J]. 畜牧兽医学报,2012,43(3):358
[6] Peng L, Arensburg J, Orly J, et al. The murine 3beta-hydroxysteroid dehydrogenase (3beta-HSD) gene family: a postulated role for 3beta-HSD VI during early pregnancy[J]. Mol Cell Endocrinol, 2002, 187(1/2): 213
[7] Frendo JL, Olivier D, Cheynet V, et al. Direct involvement of HERV-W Env glycoprotein in human trophoblast cell fusion and differentiation[J]. Mol Cell Biol, 2003, 23(10): 3566
[8] 李春芳,苟文丽,李雪兰,等.Syncytin在正常妊娠及子痫前期胎盘组织中的表达意义[J].西安交通大学学报:医学版,2012,33(1):104
[9] Knerr I, Huppertz B, Weigel C, et al. Endogenous retroviral syncytin:compilation of experimental research on syncytin and its possible role in normal and disturbed human placentogenesis[J]. Mol Hum Reprod, 2004, 10(8): 581
[10]胡蓉, 李笑天, 左伋. Syncytin及其受体ASCT2 在子痫前期胎盘的表达以及缺氧对其表达的影响[J]. 复旦学报:医学版, 2007, 34(1): 24
[11]Chui A, Tay C,Cocquebert M,et al.Homeobox gene Distal-Less 3 is a regulator of villous cytotrophoblast differentiation and its expression is increased in human idiopathic foetal growth restriction[J]. J Mol Med, 2011, 90(3): 273

