α-突触核蛋白与Nurr1相互作用增强致小鼠小胶质细胞系肿瘤坏死因子α表达增多
庄 颖,鲁玲玲,赵春礼,段春礼,杨 慧
(首都医科大学神经生物学系北京脑重大疾病研究院北京市神经再生修复研究重点实验室神经变性病教育部重点实验室,北京100069)
帕金森病(Parkinson's Disease,PD)其主要病理特征为胞质内出现以聚集化的 α-突触核蛋白(α-syuclein,α-syn)为主要成分的路易小体[1],并伴随以小胶质细胞激活为主要特征的免疫炎性反应[2-4],但此类炎性反应的具体机制目前还不清楚。
α-syn 是第一个被发现的 PD 致病基因[5-6]。在小胶质细胞系BV2细胞中过表达野生型α-syn可致炎症因子 TNF-α,NO 等释放量显著增高[7-8],但其确切分子机制目前尚无报道。
Nurr1作为核受体超家族的一种转录因子与PD密切相关[10]。近年来,Saijo等发现用LPS刺激小胶质细胞产生炎性因子后致Nurr1上调,其入核后作为转录抑制子使炎性因子无法转录,当敲减掉Nurr1后可促进炎性反应的发生[9]。
因此,本研究观察α-syn是否通过Nurr1调节炎性因子TNF-α产生,为阐明PD可能发病机制、发现新的治疗靶点提供线索。
1 材料与方法
1.1 材料
细胞:人源的神经母细胞瘤细胞系(SK-N-SH),(ATCC公司);小鼠小胶质细胞系(BV2),由首都医科大学神经生物学系王晓民教授惠赠;Wizard Plus Midipreps DNA Purification systems(Promega公司);DMEM培养基、胎牛血清(FBS)和胰蛋白酶(Gibco公司);RIPA裂解液(北京普利莱基因有限公司);蛋白酶抑制剂、磷酸酶抑制剂(Merck公司);Elisa试剂盒(R&D公司);胞质胞核分离提取试剂盒(Millipore公司);anti-MYC 抗体、anti-β-actin(Sigma-aldrich公司);Histon抗体(CST公司);α-syn抗体(BD公司);Nurr1抗体(Santa公司);OX-6抗体(Abcam公司);人源α-syn慢病毒载体:LV-GFP-αsyn(上海吉凯基因化学技术有限公司);人源α-syn质粒(pCMV-MYC-α-syn)和人源Nurr1质粒(pAAVNurr1)均由本实验室成功构建。
1.2 方法
1.2.1 细胞培养及转染:SK-N-SH细胞,BV2细胞采用含10%的胎牛血清的 DMEM培养基,置于37℃的5%CO2培养箱中培养。质粒转染按照lipofectamine2000操作说明书进行。
1.2.2 免疫组织化学染色:将携带有GFP标签的αsyn慢病毒感染的BV2细胞传代于24孔板,弃掉培养基,PBS冲洗2次,加入4%多聚甲醛,室温固定20 min,PBST室温冲洗3次,8%山羊血清室温孵育1 h,加入anti-myc(1∶1 000)、anti-OX-6(1∶1 000)和 anti-Nurr1(1∶100)一抗,4℃过夜,次日用PBST洗3次,加入相应的荧光二抗(1∶500),37℃避光孵育1 h,PBST洗3次,加入DAPI于37℃避光孵育5 min复染细胞核,PBST冲洗3次,甘油封片后用激光共聚焦显微镜观察。
1.2.3 蛋白质免疫共沉淀(Co-IP):质粒转染后24 h收集SK-N-SH细胞,进行细胞裂解,留取少量作免疫印迹对照,其余上清用于免疫共沉淀实验。每个样品加入10 μL相应抗体(α-syn,Nurr1,IgG)及1 mL Co-IP缓冲液,加入IgG组作为空白对照,置于4℃旋转孵育12 h后均加入Protein G agarose beads,于4℃轻轻旋转12 h,洗涤缓冲液漂洗后加入蛋白质上样缓冲液,95℃加热5 min,然后离心取上清,进行Western blot分析。
1.2.4 蛋白印迹(Western blot):BCA法测蛋白浓度,SDSPAGE电泳,半湿转法将蛋白转移至PVDF膜,8% 脱脂牛奶封闭1 h,分别入 α-syn(1∶500)、Nurr1(1∶100)、β-actin(1∶1 000)一抗,4 ℃ 过夜。0.1%TBST洗膜3次,入相应辣根过氧化物酶(HRP)标记的羊抗兔/鼠免疫球蛋白抗体中(1∶10 000),室温孵育1 h,洗膜同前。加入化学发光液,于暗室化学发光及显影、定影。
1.2.5 胞质胞核的分离提取:用α-syn慢病毒感染BV2细胞24 h,用胞质胞核分离提取试剂盒进行胞质胞核蛋白分离提取(按照试剂盒说明书),进行Western blot检测。
1.2.6 Elisa试剂盒检测:转染 Myc-vector,pCMVMYC-synuclein,pAAV-Nurr1质粒于BV2细胞24 h后,分别取细胞上清,离心去除杂质,立即进行检测(按照试剂盒说明书),剩余样品分装后放于-20℃储存。
1.3 统计学分析
所有实验数据均通过SPSS12.0统计软件进行单因素方差分析进行统计学检验,以均数±标准差)表示。
2 结果
2.1 α-syn和Nurr1存在亚细胞共定位
α-syn与Nurr1在BV2细胞中存在共定位关系(图1)。
2.2 α-syn和Nurr1可能存在相互作用
用Nurr1抗体可以免疫沉淀α-syn蛋白(图2A)。用α-syn抗体可以免疫沉淀Nurr1蛋白(图2B),而在上述实验的空载体对照组则没有沉淀到相应蛋白。

2.3 过表达α-syn可抑制Nurr1核转位
用携带GFP标签的α-syn慢病毒成功感染B V2细胞后 (图3A),可以观察到BV2细胞激活即小胶质细胞激活的特异性标志OX-6产生增多,Nurr1的核转位减少 (图3B)。提取胞质胞核蛋白进行Western blot分析,在过表达 α-syn组胞核中的Nurr1与正常组和对照组相比明显减少 (图3C)。
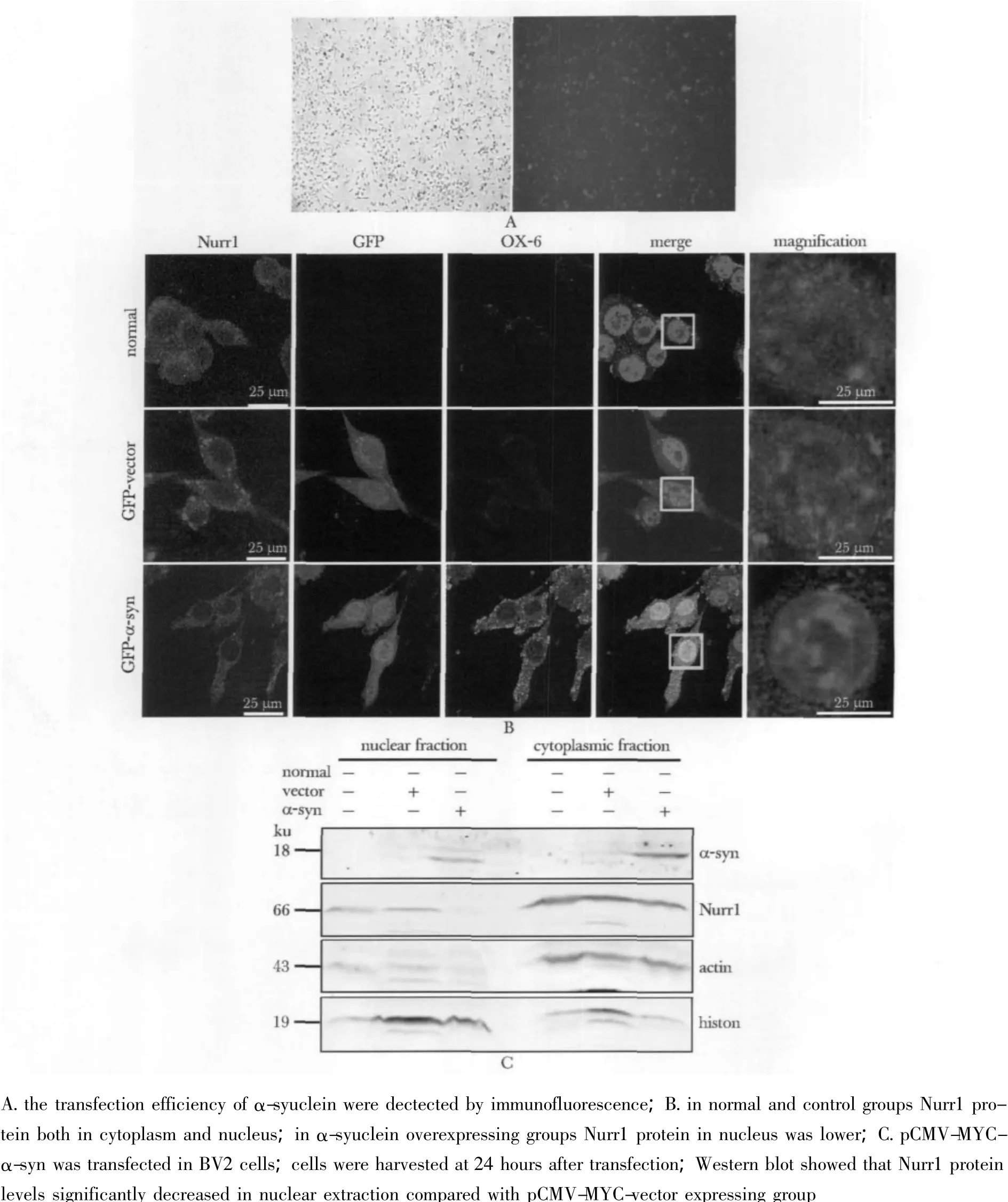
图3 过表达α-syn后对BV2中Nurr1核转位的影响Fig 3 The influence ofα-syn overexpression on Nurr1 nuclear translocation in BV2 cells(×160)
2.4 过表达α-syn和Nurr1明显影响TNF-α的产生
在BV2细胞中单独过表达α-syn可使TNF-α产生显著增多(p<0.05),而共表达α-syn与Nurr1可显著减少TNF-α的产生 (p<0.05)(图4)。

图4 过表达α-syn和Nurr1后对于BV2细胞TNF-α释放的影响Fig 4 The influence ofα-syn-,Nurr1-or doubleoverexpression on TNF-αrelease in BV2 cells
3 讨论
α-syn使得小胶质细胞过度激活产生炎性因子致多巴胺能神经元的损伤可能在PD的发生发展中发挥了重要作用。但α-syn是如何使小胶质细胞产生炎症反应,目前尚不明确。本研究利用BV2细胞进行免疫荧光标记,发现α-syn和Nurr1存在共定位,说明二者具有发生相互作用的生物学基础。同时蛋白质免疫共沉淀结果显示α-syn和Nurr1存在于一个蛋白质复合体中,推测α-syn可能是通过与Nurr1发生相互作用,从而影响了Nurr1对于TNF-α产生的抑制。
在以前的研究中Fan等人发现在原代小胶质细胞中在LPS的刺激下,Nurr1会从胞质转位到胞核[5],而本实验中在过表达α-syn的 BV2细胞中Nurr1的核转位减少,这说明LPS与α-syn导致的小胶质细胞激活机制有可能是不同的。LPS作为一种外来抗原可以引起机体强烈的免疫炎性反应,从而导致Nurr1入核增多来抑制炎性因子产生,所以LPS导致的炎性反应虽然快速剧烈但可逐步缓解。而α-syn导致的免疫炎性反应虽然较LPS缓和却是进行性加重的,这可能是因为α-syn与Nurr1发生了相互作用从而使得Nurr1入核减少,使Nurr1对于炎性因子的转录抑制作用减弱,导致炎性反应逐步加剧,但其具体的机制还要在以后的研究中进一步探讨。
本研究通过Elisa发现单独过表达α-syn可以使小胶质细胞炎性因子TNF-α产生增加,当同时过表达α-syn和Nurr1后TNF-α的产生有明显减少,说明Nurr1在一定程度上参与了α-syn所致炎性因子的产生。之前有报道发现在敲减Nurr1的BV2细胞中,加入LPS刺激后其炎症程度与正常BV2细胞相比明显增强[9],本实验发现过表达Nurr1后α-syn导致的炎性反应有所减轻,二者结果相一致。那么α-syn可能是通过与Nurr1发生相互作用,从而改变了Nurr1的活性,使其入核减少,继而导致了TNF-α的转录无法得到抑制,使得炎性反应加剧。本研究通过证明α-syn和Nurr1之间的相互作用为我们理解α-syn引发小胶质细胞激活及其引发的免疫炎性反应在PD发病中的作用提供了一定的线索,但其具体机制尚需进一步研究。
[1]Halliday GM,McCann H.Human-based studies onα-syuclein deposition and relationship to Parkinson's diease symptoms[J].Exp Neurol,2008,209:12 -31.
[2]Matthew K,Berg DA.Microglia activation during neuroregeneration in the adult vertebrate brain [J].Neurosci Lett,2011,497:11-16.
[3]Thanh GT,Heckbert SR,Longstreth WT,et al.Nonsteroidal Anti-inflammatory drugs and risk of Parkinson's disease[J].Mov Disord,2006,217:964-969.
[4]Fernagut PO,Chesselet MF.Alpha-synuclein and transgen-ic mouse models[J].Neurobiol Dis,2004,17:123 -130.
[5]Fan XL,Luo GR,Ming M,et al.Nurr1 expression and its modulation in microglia[J].Neuroimmunomodulat,2009,16:162-170.
[6]Austin SA,Floden AM,Murphy EJ,et al.α-syuclein expression modulates microglia activation phenotype[J].J Neurosci,2006,26:10558 -10563.
[7]Rojanathammanee L,Murphy EJ,Combs CK.Expression of mutant alpha-synuclein modulates microglia phenotype in vitro[J].J Neuroinflammation,2011,8:44 -55.
[8]Austin SA,Rojanathammanee L,Golovko MY,et al.Lack of alpha-synuclein modulates microglial phenotype in vitro[J].Neurochem,2011,36:994-1004.
[9] Saijo K,Winner B,Carson CT,et al.A Nurr1/Corest pathway in microglia and astrocytes protects dopaminergic Neurons from inflammation-induced death [J]. Cell,2009,137:47-59.
[10]Jankovic J,chen S,Le WD.The role of Nurr1 in the development of dopaminergic neurons and Parkinson's disease[J].Prog Neurobiol,2005,77:128-138.

