一种新的引物二聚体形成机制*
刘姗姗, 岳素文, 江 洪, 王成彬, 吕建新△
1温州医科大学检验医学院,生命科学学院,温州325000
2北京泰格瑞分子检验有限公司,北京102209
3中国人民解放军总医院临床检验科,北京100853
实时荧光定量PCR技术已被广泛应用于基因定量、DNA甲基化分析、线粒体基因损伤的定量分析、疾病相关microRNA、病原微生物检测等相关领域[1-2]。以SYBR GreenⅠ为代表的荧光染料法高效、经济、准确、重复性好、无需另外设计探针[3-4],但由于染料可非特异性结合到双链DNA小沟上,导致引物二聚体和非目的DNA的扩增使结果的判断更加困难,尤其是对低浓度的样本进行精确定量时,很难分辨是否为非特异性扩增引起的假阳性结果,因此限制了该技术的应用[5]。本研究通过SYBR GreenⅠ实时荧光定量PCR对无模板引物对测试结果分析,阐明一种新的引物二聚体形成的机制,探讨SYBR GreenⅠ实时荧光定量PCR的优化方案并测试定量检测乙肝病毒的效果。
1 材料与方法
1.1 试剂和仪器
6mmol/L dNTPs(U 替换 T),5U/μL Taq DNA酶,25×SYBR GreenⅠ,10×PCR buffer(10 mmol/L Tris pH 8.3,50mmol/L KCl,2.0mmol/L MgCl2,20%葡聚糖,PCR增效剂,特异性反义核苷酸,短寡核苷酸序列、引物对,dH2O,SYBR GreenⅠ实时荧光定量检测乙肝病毒试剂盒(批号:20120426)。以上材料均由北京泰格瑞分子检验有限公司提供。TL988Real-time PCR仪购买自西安天隆科技有限公司。
1.2 寡核苷酸序列设计
以GenBank中搜索的若干基因序列为模板,利用软件 DNAMAN、Prime Primer 5设计符合本实验要求的引物对,引物序列均为17~23b,Tm值为54℃~60℃。引物对 A/a、B/b、C/c的3′末端存在6碱基(下划线部分)连续反向互补,引物对D/d、E/e、F/f是一条引物的3′末端与另一引物的中间存在连续6个碱基(下划线部分)反向互补。G/g、H/h、I/i为一条引物的3′末端有6个碱基(下划线部分)与另一条引物的5′末端连续反向互补。J/j、K/k、L/l是利用软件设计的普通引物对。M/m、N/n、O/o为满足一般的引物设计要求且中间部分碱基同向相同的引物对,分别能够扩增布鲁菌、多重肠道病毒、乙肝病毒的DNA序列。其中O是在序列中间人为地修改了1个碱基后的引物,修改后使得O/o存在7碱基(斜体部分)同向相同,但是3′末端仍可以与模板完全结合,不影响靶特异性。针对该引物对设计了特异性反义核酸,其序列都与O引物中间部分的碱基同向互补。P来自乙肝病毒DNA的X区,p是与P 100%反向相同的寡核苷酸序列。R和S为人工设计的短寡核苷酸序列,其3′末端分别与O和o的3′末端连续4碱基反向互补,检测其对引物二聚体形成的影响。本文用到的寡核苷酸的序列和来源见表1。

表1 引物和寡核苷酸序列Table 1 Primers and oligonucleotide sequences
1.3 无模板SYBR GreenⅠReal-time PCR
定量引物二聚体反应体系:25μL SYBR GreenⅠPCR 反应体系:引物 F/R(5μmol/L)0.5μL,dNTP(10mmol/L,U 替 T)0.5μL,SYBR GreenⅠ (25×)1.0μL,Taq酶(5U/μL)1.0μL,10×PCR buffer 2.5μL,以dH2O 将反应体积补足到25 μL。每PCR管沿上部管壁小心地加30μL矿物油。快速离心、不混匀。阴性对照以dH2O代替反应中的引物对,其余操作相同。检测R、S对引物二聚体(PD,primer-dimmer)形成是否有促进作用时用20%葡聚糖稀释R、S及R+S到3个不同的浓度:20 μmol/L、2μmol/L、0.2μmol/L,分别加入各反应管中以观察在热循环反应中对PD形成的影响。
将此3支反应管手动进行以下5个循环的处理:95℃热水浴60s,4℃冰箱15min,室温下15 min。然后分别取25μL反应管1、2、3中的反应混合物(下层液体)作为最终的测试混合物在重新加入30μL矿物油封闭后进行测试。荧光定量反应条件与其他测试的反应条件相同。
SYBR GreenⅠ实时荧光定量PCR反应条件:95℃预变性2min后进行如下45个循环的反应:95℃变性30s,54℃退火30s,72℃延伸30s,在延伸过程中收集荧光信号(激发波492nm,检测波518 nm)(根据具体实验需求可以适当增加循环数)。
1.4 SYBR GreenⅠ实时荧光定量PCR乙肝病毒试剂盒标准曲线测试
按照试剂盒说明书的操作步骤以同一试剂盒中的质粒标准品为模板,分别以部分同向相同的引物对O/o和普通引物对L/l为引物对测试标准曲线。
2 结果
2.1 促进引物二聚体形成
3′末端连续6碱基反向互补的引物对、一条引物3′端结合到另一条引物的中部或者5′端而不能相互反向结合的引物对测试的Ct值见表2。当一条引物的3′端结合到另一条引物的5′端时测试的Ct值有的>45.0,整体上没有规律性,此处仅以其中3对为代表进行测试。相应的PCR扩增曲线见图1。

表2 6碱基反向互补引物对测试Table 2 Ct values of 6-base reverses complementary primers

图1 6碱基反向互补引物对测试PCR扩增曲线Fig.1 The PCR amplification curves of 6-base reverses complementary primers
2.2 短寡核苷酸序列的桥接作用
在含有引物对O/o的SYBR GreenⅠ荧光定量PCR反应体系中分别加入不同浓度热启动短寡核苷酸,在50℃退火温度的条件下不能促进引物二聚体形成,但是有干扰作用。经过低温处理后的短寡核苷酸在相同反应条件下促进引物二聚体的形成。定量结果Ct值见表3。说明在一般的荧光定量PCR反应条件下仅仅有3′末端反向互补结合是不足以形成引物二聚体的,还需要借助于其他的外力才能形成引物二聚体。同时说明在普通的PCR热循环反应中引物不是依靠每个循环延伸1~2b直到能有3′末端的牢固结合后形成引物二聚体。
2.3 普通、100%同向相同、部分同向相同、100%反向相同引物对测试
100%同向相同的引物对(A/A)在无模板测试中,45个循环内未形成PCR扩增曲线,普通、部分(5~7b)同向相同、100%反向相同的引物对均形成指数扩增曲线(图2),Ct值见表4,说明完全同向相同的引物对能够抑制引物二聚体,部分同向相同的一对引物能够部分抑制引物二聚体,100%反向相同和普通引物对易于形成引物二聚体。连续同向相同的碱基在引物对序列的3′或5′末端不影响引物二聚体的Ct值,在设计部分同向相同的引物对时应当将连续相同的碱基置于引物对的中间,距离3′末端4~5b,并且结合实际情况应保证相同的部分为5~8b。

表3 低温预处理后短寡核苷酸加入后测试Ct值Table 3 The Ct value of the mixture containing short oligonucleotides pretreated with low temperature

表4 不同引物对测试结果Table 4 The detection results of different pairs

图2 不同引物对测试PCR扩增曲线Fig.2 The PCR amplification curves of different pairs of primers
2.4 寡核苷酸序列间同向互补作用测试
引物对O/o在SYBR GreenⅠ荧光定量PCR测试结果Ct值为39,在相同反应条件下在反应体系中加入与O同向互补的反义核酸Q的测试结果是在60个热循环反应中未检测到引物二聚体。每个试验管做3次重复的PCR扩增结果见图3。能够同向互补结合到上游引物中部的反义核酸的长度是9b,优化效果与6~7b长的与上游引物反向互补的反义核酸的优化效果相当,若短于9b则无明显优化效果。
2.5 PCR增效剂对普通、部分同向相同的引物对的优化效果
普通引物L/l在联合应用PCR增效剂时仅仅能够推后1个Ct值,但是在部分同向相同的引物对O/o(7个碱基相同)联用PCR增效剂时可以推后10个Ct值,PCR扩增曲线见图4。图4显示PCR增效剂的作用在部分同向相同的引物对基础上效果更好,证明引物设计是非特异性控制的关键。
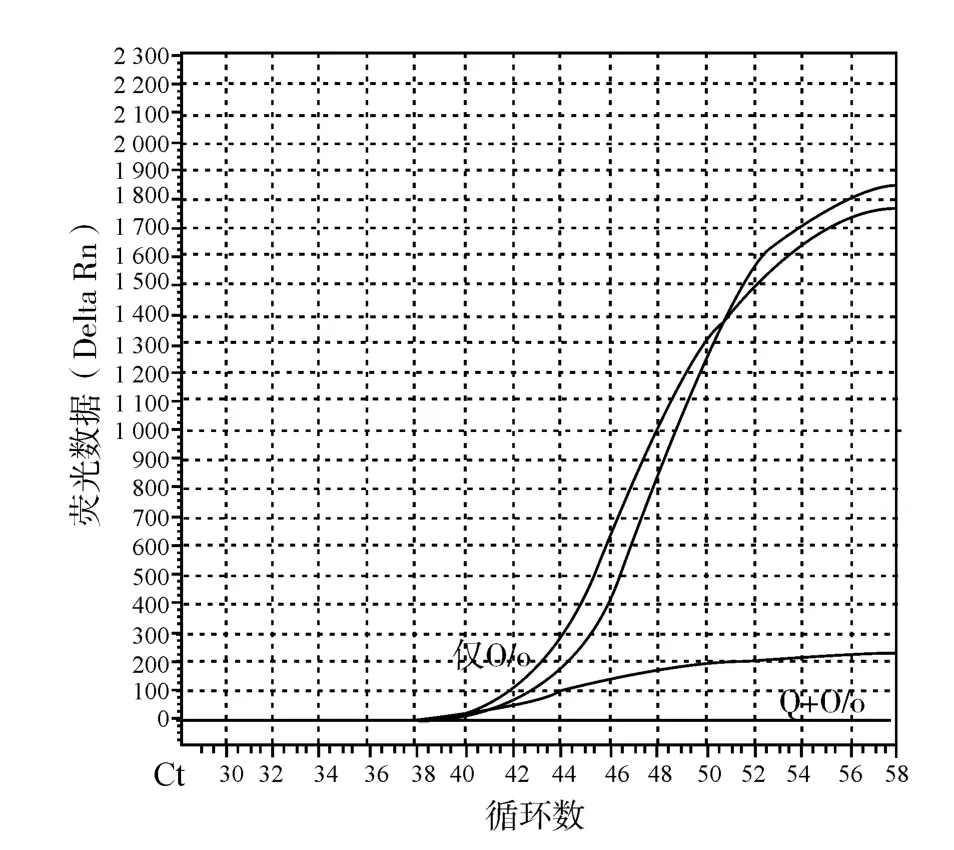
图3 同向互补的反义核酸对引物对O/o的优化效果Fig.3 The optimized effect of synthetic complementary antisense nucleic acid primers on O/o

图4 PCR增效剂的优化效果Fig.4 PCR enhancer optimization
2.6 SYBR GreenⅠ实时荧光定量PCR检测乙肝病毒
试剂盒标准曲线测试结果见图5,普通引物对L/l检测时出现假阳性(图5A),含有同向相同序列的引物对O/o测试的标准曲线在检测低浓度样本时更佳(图5B)。

图5 乙肝病毒试剂盒标准曲线对比Fig.5 Contrast of standard curves
3 讨论
实时荧光定量PCR中非特异性扩增的形成原因分为外部因素和内部因素。外部因素主要为气雾胶的污染,即PCR反应过程中,扩增的目的片段在热循环反应中进入空气中形成气雾胶,使得下一次的PCR反应在前面气雾胶污染的基础上进行而不能避免非特异性扩增。目前减少气雾胶污染的方法很多,例如采用矿物油封闭反应体系、用dUTP替换dTTP联合UDG酶等方法。内部因素包括PCR热循环反应之前反应体系中聚合酶的低温扩增作用、引物的非特异性扩增及引物二聚体的形成。针对内部因素干扰的问题已有人提出了多种优化方案,例如热启动、修饰DNA聚合酶、使用PCR增强剂等,但效果都不理想,特别是引物二聚体的产生对PCR结果定量分析的影响显著。
根据文献报道,PCR反应中引物二聚体的形成必须有Taq DNA聚合酶、一对上下游引物、脱氧核苷酸[6],在此基础上利用SYBR GreenⅠ实时荧光定量PCR无模板测试技术来进一步在分子水平上研究引物二聚体的形成机制。通过测试有典型特点的引物对,发现3′端连续6碱基反向互补促进引物二聚体的形成,而当一条引物的3′端碱基不能与另一引物的3′端碱基配对结合时不影响或抑制引物二聚体形成,说明3′端的碱基连续反向互补是形成引物二聚体的一个必要条件。
能够反向互补结合到引物序列的3′末端的短寡核苷酸在高温热循环PCR反应中不能够作为上下游引物之间的桥梁促进引物二聚体的形成,而预先经过低温循环处理的反应体系在相同条件下促进引物二聚体的形成,说明在低温循环反应中短寡核苷酸既能反向互补结合到引物的3′末端,也能在聚合酶的作用下利用反应体系中的原料进行延伸反应,但在高温热循环反应中能够反向结合到引物序列的3′末端,不能进行延伸反应。这一结果提示PCR热循环反应中引物二聚体的形成需要在3′末端反向互补的基础上借助其他力量。
从2.3测试结果中可以发现,部分或全部同向相同的引物对可抑制引物二聚体的形成,此结果说明除3′末端的碱基外的序列同向相同可以抑制引物二聚体形成,即按照一般的引物设计原则得到的引物无法避免3′末端相互间1~2个碱基的反向互补,即可在反向互补的基础上借助余下的序列在同方向上形成的相互作用力结合在一起而延伸形成引物二聚体。这一机制说明引物序列同方向上碱基之间的排斥使得引物对在空间上无法生成引物二聚体的过渡态,从而无法在反应体系中累积。根据已有的引物设计原则设计的普通引物对可以避免3′端多碱基连续反向互补,但是无法避免1~2个碱基反向互补结合,在此基础上借助余下序列的同向互补结合力量就可以形成引物二聚体。
据文献报道,引物二聚体在PCR反应中存在多种形成机制,且各种机制之间在热循环反应的不断进行中相互影响,但目前尚未阐明具体机制。以上的实验结果可以做出如下解释:尽管短寡核苷酸可以借助3′末端连续的4个碱基牢固地结合到引物序列的3′末端,但余下的序列太短而无法与引物序列在空间上形成相互作用力而没有起到桥接促进作用。Brownie等[7]提到的在引物对的5′端增加一段相同的序列后抑制引物二聚体的机制是由于退火温度下优先形成了袢式结构而避免与引物序列的结合的理论是不全面的,因为100%反向相同的引物对可以形成引物二聚体(Ct值为30.5),但是反向完全相同的引物对形成的引物二聚体中一条链在退火温度下,自身的序列可以在空间中通过反向互补形成环形结构,这样可以避免引物序列与之结合后形成引物二聚体,但是本研究中的实验结果是这种推断所无法解释的,所以认为文献中提出的抑制引物二聚体形成的模式不是主要原因[8-9]。本研究提出的机制和实验方法为进一步研究寡核苷酸序列之间的相互作用提供了切入点。
综上所述,SYBR GreenⅠReal-time PCR反应优化的关键在于引物设计,在采用部分同向相同的引物对的基础上加用其他的优化方法如PCR增效剂可以实现加强效果,普通引物对加用PCR增效剂几乎没有优化效果(图4)。针对同一个试剂盒中的质粒标准品做标准曲线的结果说明部分相同的引物对使得检测低浓度样本更加精确、可靠(图5)。在实际应用中,布鲁杆菌、乙肝病毒、艾滋病病毒、多重肠道病毒的定量检测都可以应用部分相同的引物对来检测低浓度样本。SYBR GreenⅠ实时荧光定量PCR技术准确、线性关系好、线性范围宽并且经济高效,但是因为假阳性的问题而无法实现广泛地应用,该研究有效解决了此问题,从而为拓宽其在相关领域尤其是分子诊断方面的应用范围起到重要的作用。
[1] Cottrell S E,Distler J,Goodman N S,et al.A real-time PCR assay for DNA-methylation using methylation-specific blockers[J].Nucleic Acids Res,2004,32(1):e10.
[2] Chen J,Kadlubar F F,Chen J Z.DNA supercoiling suppresses real-time PCR:a new approach to the quantification of mitochondrial DNA damage and repair[J].Nucleic Acids Res,2007,35(4):1377-1388.
[3] Giglio S,Monis P T,Saint C P.Demonstration of preferential binding of SYBR GreenⅠto specific DNA fragments in realtime multiplex PCR[J].Nucleic Acids Res,2003,31(22):e136.
[4] Shahzamani K,Sabahi F,Merat S,et al.Rapid low-cost detection of hepatitis C virus RNA in HCV infected patients by real-time RT-PCR using SYBR GreenⅠ[J].Arch Iran Med,2011,14(6):396-400.
[5] Stanley K K,Szewczuk E.Multiplexed tandem PCR:gene profiling from small amounts of RNA using SYBR Green detection[J].Nucleic Acids Res,2005,33(20):e180.
[6] Lindahl T,Ljungquist S,Siegert W,et al.DNA N-glycosidases:properties of uracil-DNA glycosidase fromEscherichia coli[J].J Biol Chem,1977,252(10):3286-3294.
[7] Brownie J,Shawcross S,Theaker J,et al.The elimination of primer-dimer accumulation in PCR [J].Nucleic Acids Res,1997,25(16):3235-3241.
[8] Obradovic D,Kevresan S.Optimization of PCR in application of hot start Taq DNA polymerase for detection of Erwinia amylovora with primers FER1-F and FER1-R[J].Mikrobiologiia,2010,79(6):819-823.
[9] Simantini D,Satish C.Mohapatra S C,et al.Studies on primer-dimer formation in polymerase chain reaction(PCR)[J].Biotechnol Tech,1999,13:643-646.

