红景天粗多糖中基分对猪精子冻后生化指标及活力的影响
赵红卫
(燕山大学 环境与化学工程学院生物技术与工程系,河北 秦皇岛066004)
精子有氧呼吸系统与精浆中抗氧化系统形成了一个动态平衡的氧化与抗氧化系统[1-2],冷冻保存处理损耗抗氧化物质,但冻后活精子继续产生活性氧自由基(reactive oxygen species,ROS),冻后精液中抗氧化与氧化系统失衡,导致稀释液中ROS浓度升高[3-4]。多余ROS存在于精子质膜周围而不能及时消除,以至于使精子质膜脂质不饱和脂肪酸氧化[5],造成精子质膜氧化呼吸功能低下、胞内酶泄漏、DNA 破坏[6]和精卵融合能力降低[7]。因此,寻求能够抑制或者抵抗ROS损伤的高效抗氧化物质将成为解决问题关键。红景天多糖作为一种植物提取的抗氧化剂能够很强地清除超氧阴离子自由基(*O2-),并能够有效抑制膜脂氧化[8]。Zhao等[9]研究表明,红景天粗多糖能够显著抵抗冻后猪精液中的ROS,提高精子冻后质量,但是红景天粗多糖成分复杂、杂质较多且粘滞性较高,影响精子正常观察和进一步生产应用。因此,将红景天粗多糖进一步分离纯化成为红景天粗多糖在猪精液冷冻保存中的重要环节。本研究将对多红景天粗多糖分离纯化为红景天粗多糖中基分(Middle Components of Rhodiola Polysaccharide,MCRP),并将 MCRP添加到猪精子冷冻稀释液中,探索MCRP对猪精子冷冻解冻后精子活力以及相关指标的影响,而且目前尚无MCRP应用于精液冷冻的报道。MCRP在猪精液冷冻保存中的应用将为猪精子冷冻保存开辟新途径,为猪冷冻精液生产应用奠定基础。
1 材料与方法
1.1 化学试剂和MCRP的提取
化学药品均采购自于Sigma上海分公司(上海,中国)。MCRP提取自西藏红景天(西藏大学提供)。MCRP提取过程,将风干500 g红景天根茎进行粉碎,在80℃蒸馏水中浸泡5 h,利用纱布过滤粗粒固体物质,再用滤纸除去微粒固态物质,将滤液收集于旋转蒸发仪浓缩,浓缩液中添加无水乙醇5℃过夜,出现5层沉淀,取中间层冷冻干燥获得MCRP,干燥常温保存,备用。
1.2 精液采集
猪精液采集于5头杜洛克猪(2~4岁,2次/周),在整个试验中,公猪饲养环境和营养水平均保持稳定,采用手握法采集精子,富集段精液用稀释液湿润纱布过滤,将精子活率高于80%的精液用于试验。
1.3 冷冻精液处理
取约30 m L精液至预热离心管中,23~25℃,800 g/min,离心8 min,弃上清,用同温BTS(Beltsville thawing solution,表1)稀释液重悬,降至室温后转移至15℃恒温冰箱静置2 h,然后15℃、600 g、离心8 min,弃上清,沉淀精子用冷冻稀释液I(表1)重悬,精子密度1.5×109个/m L,重悬液转移至5℃恒温冰箱降温2 h,再用冷冻稀释液II稀释(重悬精液:稀释液II=2:1),精子最终密度为1×109个/m L。此外,根据试验设计将MCRP按照一定的浓度添加到稀释液I或稀释液II中(见试验设计)。稀释后的精液注入到冷冻麦管(IMVL Aigle公司,法国)并封口,继续保留于5℃恒温冰箱1.5 h,转移到程序冷冻仪(Biotronics公司,英国),以1℃/min的速率从5℃降到-6℃,在-6℃稳定平衡2 min,转移至液氮液面约3 cm处进一步降温,降至-140℃时投入液氮,冻存。

表1 BTS稀释液、冷冻稀释液I和冷冻稀释液II成分Table 1 Composition of BTS and semen extenders I and II
1.4 精子解冻评估
将麦管转移至38℃水浴中50 s,与5 m L室温(23~25℃)BTS稀释液缓慢混合,并分成若干份,分别用于评估精子运动性能、线粒体活性、谷胱甘肽浓度、顶体完整率、质膜完整性及质膜氧化程度等。
1.4.1 精子运动性能的评估 精子运动指标应用精子计算机辅助分析系统(Zoneking软件有限公司,北京)进行评估。分析系统设置:32帧/s,记录频次50 Hz,平均速率为25μm/s,速率小于10μm/s的精子为死精子,最大运动半径为25μm,精子运动轨迹偏离直线小于10%视为精子直线运动。将解冻精液转移在38℃水浴中20 min,密度调整为5×107个/m L,取5μL转移至 Makler计数室(10 μm深),显微镜下分析观测,每个样本测定8个连续的视野,并摄像分析。测定指标为精子活率、死亡率、直线运动率和超活力精子百分率。
1.4.2 线粒体活性的测定 利用罗丹明-123和碘化丙啶联合染色的方法对精子线粒体功能进行评定[10]。先将罗丹明-123配置成1 mg/m L的储存液,分装成20μL小份备用。取3μL罗丹明-123溶液加入1 m L精液样本(精子密度为20×106个/m L)中,在避光37℃孵育20 min,再加入10μL碘化丙啶(0.5 mg/m L),37℃孵育10 min,离心(600×g,6 min)弃上清,用1 m L的PBS重悬精子。取10μL重悬液滴加到预热载玻片上,盖盖玻片,用荧光显微镜(尼康120,日本)分别在490/515 nm(罗丹明-123)和545/590 nm(碘化丙啶)观察大约200枚精子,并统计尾中段只显示绿色荧光的精子。
1.4.3 荧光测定的顶体完整性 花生凝集素-异硫氰酸荧光素(Fluorescein Isothiocyanate Peanut Agglutinin,FITC-PNA)染色检查精子顶体完整率[11],取10μL精液均匀涂到载玻片上,室温风干,浸入到100 mg/m L FITC-PNA PBS溶液中,5℃闭光染色30 min,冰浴PBS中除浮染,闭光30 min,滴加固封剂(甘油90%和PBS 10%,V/V;磷-苯二胺0.1%,W/V),盖上盖玻片,荧光显微镜观察200个精子,精子顶体被均匀着色的为顶体完整精子,顶体区域未被着色或着色不均匀的为非完整精子顶体。
1.4.4 低渗肿胀试验 低渗肿胀试验(hypoosmotic swelling test,HOST)是将3 m L精液添加30 m L的100 m Os M低渗溶液(9 g/L果糖和4.9 g/L柠檬酸钠)中[20-21],37 ℃孵育60 min。取0.2 m L精液涂片,在1000×显微镜视野下观察200枚精子,统计肿胀或翘尾巴精子。
1.4.5 谷胱甘肽浓度测定 取3.0×108个/m L的精液1 m L,添加等体积50%三氯乙酸,然后800×g离心6 min,取上清液0.5 m L与2 m L的0.2 mol/L tris-缓冲液(p H 8.9)和0.5 m L 的0.01 mol/L 55-二硫双硝基对苯甲酸混合,室温保存5 min,然后分光度计412 nm测定谷胱甘肽的浓度(nmol/m L)。
1.4.6 精子质膜氧化测定 取3.0×108个/m L精液1 m L,加入预冷20%(w:v)三氯乙酸,1600×g离心10 min,取1 m L上清液与1 m L的0.67%(w:v)硫代巴比妥酸(TBA)混合,100℃水域10 min,冷却后,分光度计534 nm测定定丙二醛(MDA)浓度(nmol/m L)。
1.5 试验设计
1.5.1 冷冻稀释液I中MCRP对冻后精子运动参数、谷胱甘肽和MDA浓度的影响 分别用含0、3、6、9、12、15 mg/L的 MCRP冷冻稀释液I稀释(表1),平衡2 h后,按照稀释精液与稀释液II体积比为2:1进一步稀释,最终混合精液中MCRP浓度为0、2、4、6、8、10 mg/L。精液冷冻解冻后,分别测定精子相关参数、谷胱甘肽和MDA浓度。
1.5.2 冷冻稀释液II中MCRP对冻后精子运动参数、谷胱甘肽和MDA浓度的影响 用冷冻稀释液I(表1)稀释后,平衡2 h,按照稀释精液与冷冻稀释液II体积比为2:1进一步稀释,稀释液II中MCRP浓度分别为0、6、12、18、24、30 mg/L,混合后精液中MCRP的最终浓度为0、2、4、6、8、10 mg/L。精液冷冻解冻后,测定精子相关参数、谷胱甘肽和MDA浓度。
1.5.3 稀释液I或稀释液II中MCRP对冻后精子运动参数、谷胱甘肽和MDA浓度的影响 每头猪精液分成三等份后单独处理,第1份精液用含9 mg/L MCRP稀释液I稀释,平衡2 h,再用稀释液II稀释;第2份先用稀释液I稀释,平衡2 h,再用含有18 mg/L MCRP稀释液II稀释;第3份先用含4.5 mg/L MCRP稀释液I稀释,平衡2 h,再用含有9 mg/L MCRP稀释液II稀释;混合油后精液中MCRP最终浓度都为6 mg/L,混合精液冷冻解冻后,测定精子相关参数、谷胱甘肽和MDA浓度。
1.6 数据统计分析
所有数据经Kolgomorov-Smirnov检验均为正态分布,经单因素方差分析检验差异显著后,使用多重比较使用Duncan's检验;MCRP浓度与精子冷冻解冻后各参数之间的相关性使用皮尔逊检验。以上数据分析借助SPSS 13.0统计软件,显著性水平全部设置为P<0.05。
2 结果与分析
2.1 MCRP对猪精子冷冻解冻后运动特征的影响
用三个独立试验并借助计算机辅助分析系统,研究了MCRP对冻后精子运动参数的影响。结果见表2~5。由表2知,精子活率随着MCRP浓度的增加而增加,当MCRP浓度超过4 mg/L时,精子活率显著高于对照组(P<0.05);活精子总数(To-tal motile sperm,TM)、线性运动精子(liner motile sperm,LM)和超活跃精子(Hyperactive sperm,Hyp)均表明 MCRP最佳浓度是6 mg/L(P<0.05);MCRP浓度与TM 和LM 显著相关(P<0.05),但与 Hyp无相关性(P>0.05,表4),而且6 mg/L和8 mg/L组的TM、LM和Hyp高于其它浓度组(P<0.05)。由表5可知,A组和C组的TM和LM显著高于B组(P<0.05),但Hyp各组间无显著差异(P>0.05)。

表2 稀释液I中MCRP对冻后精子运动参数、线粒体活性、顶体完整性、HOST以及精液中谷胱甘肽和MAD浓度的影响Table 2 Effects of MCRP in extender I on motion parameter,mitochondrial activity,acrosome integrity,HOST,and concentrations of GSH and MAD of frozen-thawed boar semen
2.2 MCRP对猪精子冷冻解冻后线粒体活性的影响
猪精子冻后线粒体活性(mitochondrial activity,MA)随MCRP浓度增加而升高。表4表明,线粒体活性与 MCRP浓度显著相关(P<0.05)。由表2知,当MCRP浓度高于4 mg/L时试验组线粒体活性高于对照组(P<0.05);由表3知,当MCRP浓度大于6 mg/L时,线粒体活性试验组显著高于对照组(P<0.05)。由表5知,猪精子线粒体活性B组低于A组和C组(P<0.05)。

表3 稀释液II中MCRP对冻后精子运动参数、线粒体活性、顶体完整性、HOST以及精液中谷胱甘肽和MAD浓度的影响Table 3 Effects of MCRP in extender II on motion parameter,mitochondrial activity,acrosome integrity,HOST,and concentrations of GSH and MAD of frozen-thawed boar semen
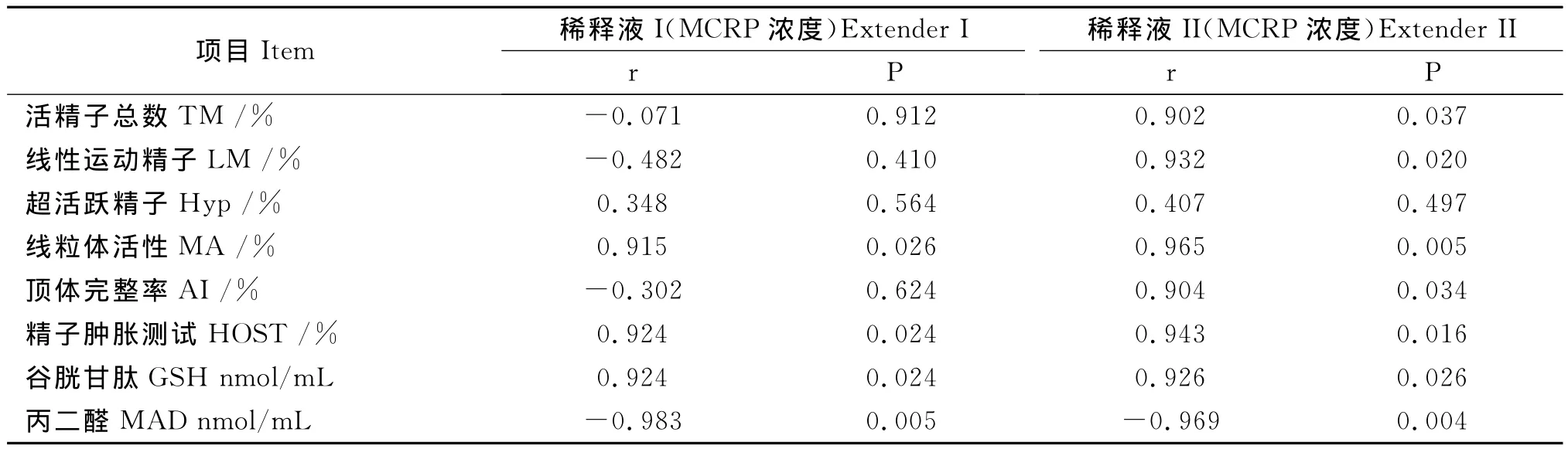
表4 稀释液I和稀释液II中MCRP浓度与冻后精子各参数相关性Table 4 Relationships between MCRP concentration and seminal parameters in extender I and II
2.3 MCRP对猪精子冷冻解冻后顶体完整性和质膜完整性的影响
由表2可见,精子MCRP组顶体完整性(acrosome integrity,AI)均显著高于对照组(P<0.05),精子质膜完整性只有MCRP浓度高于浓度6 mg/L时才显著高于对照组(P<0.05);另外,MCRP浓度与AI之间无显著相关(P>0.05),但与质膜完整性之间显著相关(P<0.05,表4);由表3可见,MCRP浓度高于6 mg/L时,AI和质膜完整性均显著高于照组(P<0.05),且质膜完整性和AI均与MCRP浓度之间存在显著相关(P<0.05)。由表5知,B组质膜完整性低于A组和C组(P<0.05),而A组AI显著高于B和C(P<0.05)。
2.4 MCRP对猪精液冷冻解冻后谷胱甘肽和丙二醛浓度的影响
由表4知,MCRP浓度与谷胱甘肽(GSH)之间存在正相关性(P<0.05),随着 MCRP浓度增加,冷冻冻后精液中GSH浓度逐渐升高趋势,而且MCRP浓度超过4 mg/L(表2)或6 mg/L(表3)时,精液中谷胱甘肽的浓度显著高于对照组(P<0.05)。另外,试验结果表明,冷冻解冻精液丙二醛(MDA)浓度与 MCRP浓度成负相关(P<0.05,表4),且MCRP浓度超过6 mg/L时,精液MDA浓度显著低于对照组(P<0.05,表2,表3)。B组 MDA浓度显著高于A组和C组(P<0.05),但B组GSH浓度显著低于A组和C组(P<0.05)。
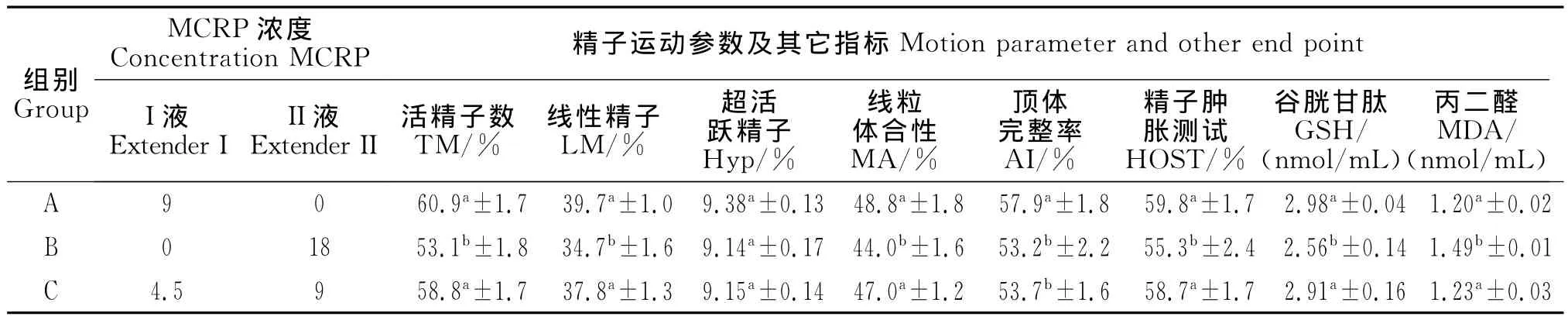
表5 MCRP在稀释液I和稀释液II中MCRP对精子运动参数、线粒体活性、顶体完整性、HOST以及精液中谷胱甘肽和MAD浓度的影响Table 5 Comparison of MCRP effects in extender I and II on motion parameters,mitochondrial activity,acrosome integrity,HOST,and concentrations of GSH and MAD of frozen-thawed boar semen
3 讨 论
Zhao等[9]研究表明,红景天粗多糖能够降低冻后猪精液中ROS,显著提高精子冻后质量,但是目前并没有发现利用MCRP保护哺乳动物精子的相关报道,本研究将MCRP添加冷冻保护稀释液I和稀释液II中,通过对冷冻解冻后精液中谷胱甘肽、丙二醛、精子运动参数以及精子质膜等进行测定,发现MCRP在4~6 mg/L浓度范围内具有良好的效果,而且在稀释液I中效果优于稀释液II,这一结果与Zhao等[9]在冷冻稀释液中添加红景天粗多糖的结果基本相似。
精液冷冻保存过程可以使精液中的超氧化物歧化酶和谷胱甘肽还原酶损耗减少,相对而言精液中谷胱甘肽过氧化酶就会过剩,这导致精液中谷胱甘肽浓度降低,而且谷胱甘肽还原酶的损耗或其酶活性的降低还会造成冷冻解冻过程中精子产生谷胱甘肽能力的降低[12],同时冷冻解冻过程诱发ROS大量产生进一步损耗谷胱甘肽,富余的ROS就会富集于精子表面损伤精子质膜,导致精子质量下降。另外,本研究显示MCRP浓度与谷胱甘肽之间存在显著地正相关性(P<0.05,表5),可以推断 MCRP有助于细胞内谷胱甘肽浓度的增加,谷胱甘肽作用于谷胱甘肽过氧化酶和ROS,从而阻止对细胞质膜的诱导氧化[8]。类似的研究将红景天粗多糖添加到人红细胞培养液中,能够增加人红细胞中谷胱甘肽的浓度[13]。精子冷冻保存过程打破了精液中抗氧化与氧化平衡系统,精子产生的负氧离子自由基聚集在精子表面,从而化了精子质膜上的不饱和脂肪酸,形成细胞氧化次生品MDA[13],本研究表明,冷冻解冻后精液中丙二醛浓度与MCRP呈显著负相关(P<0.05,R=-0.982),推测 MCRP能够有效地清除精液中的负氧离子自由基,并能够抑制质膜的过氧化。类似报道表明,MCRP能显著降低肝细胞中MDA 的浓度[14]。
本研究分别将MCRP添加到冷冻稀释液I和稀释液II观察其对精子各项参数的影响。研究结果表明MCRP添加到稀释液I比添加到稀释液II更能改善精子各项指标,当MCRP添加到稀释液I时,整个冷冻保存过程的精子都受到MCRP抗氧化保护,将MCRP只添加到稀释液II中,精子在稀释液I平衡过程中未受到MCRP保护抗氧化,负氧离子自由基损伤精子质膜,致使精子在冷冻前质量有所下降,而且冷冻前精子的质量显著影响精子冷冻后的质量[15-16],因而MCRP添加到稀释液I比添加到稀释液II更能改善精子各项指标,上述推理也得到本研究相关试验的充分验证(表5)。与本研究类似的报道如在冷冻稀释液中添加谷胱甘肽或者维生素E能够提高精子的运动性能[12,17]。在缺少抗氧化物质的条件下,精子有氧呼吸产生的ROS将会抑制线粒体活性,最终导致精子运动能力的下降[18]。本研究显示,在冷冻稀释液中添加4~6 mg/L的MCRP能够提高精子的运动能力,而且精子MA与MCRP浓度之间存在显著地正相关。但是,值得注意的当MCRP的浓度超过6 mg/L时,精子的运动参数呈下降趋势。本研究认为过高的MCRP可能会抑制在冷冻保存过程中精子正常生理活动产生的ROS,从而抑制了精子的运动能力。相关报道也表示在猪精子冷冻保存液中,过多加入抗氧化剂成分,将会过度中和精液中的ROS或者抑制其产生,从而导致与ROS相关的精子生理功能的缺失[19-20],致使精子运动性能下降。
精液中过多的ROS可能会引起精子质膜、精子顶体和线粒体超显微结构的改变和功能的损伤[21-22],本研究表明 MCRP浓度大于6 mg/L,能够有效地增加HOST比例、顶体完整性和线粒体活性精子的比例,精子有氧呼吸中产生ROS的位置目前集中在两个位置,分别是精子质膜和线粒体,如果冷冻保存液中抗氧化成分的含量不足,过多的ROS首先会攻击线粒体膜和精子质膜,而精子质膜和线粒体膜上有丰富的非饱和脂肪酸很容易被氧化[2,22]。当MCRP添加到冷冻保存稀释液中后,就能够有效地清除多余的ROS,保护了精子质膜、顶体和线粒体活性,从而提高了精子冷冻保存后的质量。
4 结 论
MCRP在猪精子冷冻保存稀释液中最佳添加浓度为4~6 mg/L。在猪精子冷冻保存过程中,MCRP添加到稀释液I的效果优于稀释液II。猪精子冷冻保存中,MCRP抗氧化性效果与浓度有较强的相关性。
[1] Aitken R J,Ryan A L,Baker M A,et al.Redox activity associated with the maturation and capacitation of mammalian spermatozoa[J].Free Radical Biology and Medicine,2004,36:994-1 010.
[2] Allamaneni S S,Naughton C K,Sharma R K,et al.Increased seminal reactive oxygen species levels in patients with varicoceles correlate with varicocele grade but not with testis size[J].Fertility and Sterility,2004,82:1 684-1 686.
[3] Jelezarsky L,Vaisberg C H,Chaushev T,et al.Localization and characterization of glutathione peroxidase(GPx)in boar accessory sex glands,seminal plasma,and spermatozoa and activity of GPx in boar semen[J].Theriogenology,2008,69:139-145.
[4] Hernández M,Roca J,Calvete J J,et al.Cryosurvival and in vitro fertilizing capacity postthaw is improved when boar spermatozoa are frozen in the presence of seminal plasma from good freezer boars[J].Journal of Andrology,2007,28:689-697.
[5] Irvine D S.Gluthatione as a treatment for male infertility[J].Reviews of Reproduction,1996,1:6-12.
[6] White I G.Lipids and calcium uptake of sperm in relation to cold shock and preservation:a review[J].Reproduction Fertility and Development,1993,5:639-658.
[7] Aitken R J,Buckingham D,Harkiss D.Use of a xanthine oxidase free radical generating system to investigate the cytotoxic effects of reactive oxygen species on human spermatozoa[J].Journal of Reproduction and Fertility 1993,97:441-450.
[8] Mook-Jung I,Kim H,Fan W,et al.Neuroprotective effects of constituents of the oriental crude drugs,Rhodiola sacra,R.sachalinensis and Tokaku-joki-to,against beta-amyloid toxicity,oxidative stress and apoptosis[J].Biological &Pharmaceutical Bulletin,2002,25:1 101-1 104.
[9] Zhao H W,Li Q W,Ning G Z,et al.Rhodiola sacra aqueous extract(RSAE)improves biochemical and sperm characteristics in cryopreserved boar semen[J].Theriogenology,2009,71(5):849-857.
[10] Fraser L,Dziekonska A,Strzezek R,et al.Dialysis of boar semen prior to freezing-thawing:its effects on post-thaw sperm characteristics[J].Theriogenology,2007,67:994-1 003.
[11] Lisa M,Thurston K,William V,et al.Post-thaw functional status of boar spermatozoa cryopreserved using three controlled rate freezers:a comparison[J].Theriogenology,2003,60:101-113.
[12] Gadea J,Sellés E,Marco M A,et al.Decrease in glutathione content in boar sperm after cryopreservation:Effect of the addition of reduced glutathione to the freezing and thawing extenders[J].Theriogenology,2004,62:690-701.
[13] Sharma P,Reddy K,Franki N,et al.Native and oxidized low density lipoproteins modulate mesangial cell apoptosis[J].Kidney International,1996,50:1 604-1 611.
[14] Nan J X,Jiang Y Z,Park E J,et al.Protective effect of Rhodiola sachalinensis extract on carbon tetrachloride-induced liver injury in rats[J].Journal of Ethnopharmacology,2003,84:143-148.
[15] Peña F J,Saravia F,Johannisson A,et al.Detection of early changes in sperm membrane integrity pre-freezing can estimate post-thaw quality of boar spermatozoa[J].Animal Reproduction Science,2007,97:74-83.
[16] Sion B,Janny L,Boucher D,et al.Annexin V binding to plasma membrane predicts the quality of human cryopreserved spermatozoa[J].International Journal of Andrology,2004,27:108-14.
[17] Satorre M M,Breininger E,Beconi M T,et al.Alpha-tocopherol modifies tyrosine phosphorylation and capacitationlike state of cryopreserved porcine sperm[J].Theriogenology,2007,68:958-965.
[18] Cummins J M,Jequier A M,Kan R.Molecular biology of human male infertility:links with aging,mitochondrial genetics and oxidative stress[J].Molecular Reproduction and Development,1994,37:345-362.
[19] De Lamirande E,O'flaherty C.Sperm activation:Role of reactive oxygen species and kinases[J].Biochimica et Biophysica Acta,2008,1784:106-115.
[20] O'flaherty C,De Lamirande E,Gagnon C.Reactive oxygen species and protein kinases modulate the level of phospho-MEK-like proteins during human sperm capacitation[J].Biology of Reproduction,2005,73:94-105.
[21] Shang X J,Huang Y F,Xiong C L,et al.Ultrastructural ob-servation of normal spermatozoa incubated with ROS in vitro[J].Zhonghua Nan Ke Xue,2002,8:106-108.
[22] Jeulin C,Soufir J C,Weber P,et al.Catalase activity in hu-man spermatozoa and seminal plasma[J].Gamete Research,1989,24:185-96.

