草莓中甲型肝炎病毒检测
高世光,王海燕,郭 慧,冯华炜,于 洋,麻丽丹,*
(1.丹东出入境检验检疫局,辽宁 丹东 118000;2.大窑湾出入境检验检疫局,辽宁 大连 116600)
草莓中甲型肝炎病毒检测
高世光1,王海燕2,郭 慧1,冯华炜1,于 洋1,麻丽丹1,*
(1.丹东出入境检验检疫局,辽宁 丹东 118000;2.大窑湾出入境检验检疫局,辽宁 大连 116600)
目的:建立草莓中甲型肝炎病毒(hapatitis A virus,HAV)的有效富集方法及病毒RNA提取方法,用于草莓中HAV检测。方法:利用甲肝减毒疫苗对已知阴性的草莓样品进行人工污染,通过有效富集条件的优化及RNA提取后,采用实时荧光逆转录-聚合酶链式反应进行检测。结果:病毒富集选择Tris-甘氨酸-1 g/100 mL牛肉浸提物缓冲液洗脱、果胶酶30 U、氯仿-正丁醇为抑制剂去除剂、聚乙二醇沉淀、5 ℃孵育1 h等优化条件,检测灵敏度较高;最优RNA提取方法为美国ABI公司生产的RNA提取试剂盒。采用优化后的方法对草莓样品中HAV病毒的检测显示,该病毒粒子的检测灵敏度可以达31.36 CCID50/20 g样品。同时对50 份送检样品进行检测,结果均为阴性。结论:所建立的病毒富集方法和核酸提取方法更适合草莓样品中HAV的检测,灵敏度较高。
草莓;甲型肝炎病毒;病毒富集;RNA提取
食源性病毒感染是人类患病毒性疾病的重要原因[1-2],甲型肝炎病毒(hapatitis A virus,HAV)属微小RNA病毒科,HAV属,是一种常见的食源性病毒疾病。该病毒经粪-口途径传播,引起人肝肿大、肝功能受损以及黄疸等症状[3]。容易发生HAV感染的食物为生的、未煮熟的肉或海鲜(如贝类等)、方便食品以及水果和蔬菜等缺少热处理的食品[4-11]。无论是发展中国家还是发达国家,每年都会发生因感染HAV引起的急性胃肠炎和甲肝的爆发流行,其中食源性感染占很大比例。加拿大、美国、澳大利亚、芬兰、瑞典都曾发生过因食用草莓或木莓而引起的HAV爆发流行。感染的场所主要有老人院[12-13]、医院、游船、学校、餐馆和一些宴席上[14]。
农作物在生产、加工和包装等过程中,由于施肥、灌溉等生产环节易污染HAV以及携带有HAV操作人员的二次污染等皆可以造成该产品污染HAV[15]。然而,由于缺乏有效的检测方法以及病毒在食品样品中分布不均匀性、病毒含量低等特性使得HAV引起的食源性病毒感染很少能被检测到[16]。由于HAV细胞培养周期长,实验极为繁琐[17],故而实时荧光逆转录-聚合酶链式反应(reverse transcription polymerase chain reaction,RTPCR)方法成为临床、食物和环境样品中HAV检测的金标准。食品中HAV的检测比临床样品中HAV的检测更困难,原因为食品样品中病毒含量很低以及存在PCR检测抑制物质[18-19]。目前国内外对于食品中HAV的检测研究大部分针对的是贝类样品,对小浆果类样品报道很少,小浆果如草莓样品,由于其特殊的基质特性,必须采用有效的病毒富集和处理方法,才能高效提取样品中低浓度的病毒,因此本研究针对草莓样品中HAV检测的关键步骤进行了优化,包括草莓样品中病毒洗脱的最佳缓冲液、果胶酶的最适添加量、聚乙二醇(polyethylene glycol,PEG)沉淀病毒的最佳条件、RNA最佳提取方法和最佳PCR抑制剂去除剂等,以建立草莓中HAV的有效富集方法及病毒RNA提取方法,用于草莓中HAV检测。
1 材料与方法
1.1 材料、试剂与仪器
草莓样品来自出辽宁省丹东出入境检验检疫局出口样品以及丹东各大草莓种植基地监测样品。
Tris、甘氨酸 美国Sigma公司;三氯三氟乙烷天津市科密欧化学试剂有限公司;牛肉浸出粉 北京路桥科技有限公司;PEG8000 中国Biosharp公司;氯仿 北京化工厂;果胶酶(30U/g) 国药集团化学试剂有限公司;正丁醇 赛默飞世尔科技(中国)有限公司;MagMAX™-96 Viral RNA Isolation Kit(货号:AM1836)、AgPath-IDTMOne-step RT-PCR Kit(货号:AM1005) 美国应用生物系统公司;QIAamp Viral RNA Mini Kit(货号:74104) 德国凯杰生物技术公司;TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0(货号:DV819A) 宝生物工程(大连)有限公司;HAV减毒疫苗(滴定度为106.5CCID50/mL,阳性对照) 长春长生生物科技股份有限公司。
表1中所用的引物参照ISO/TS 15216—2[20]中的引物,由Invitrogen公司合成。
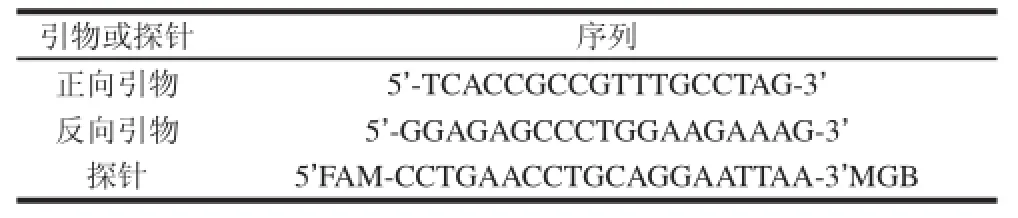
表1 HAV实时荧光RT-PCR检测的引物及探针Table 1 Primers and probes for RT-PCR amplification of HAV
3-18K台式高速冷冻离心机 德国Sigma公司;7300实时荧光定量PCR系统、MagMax Express核酸提取仪 美国ABI公司;SK-1快速混匀器 江苏省金坛市荣华仪器制造有限公司。
1.2 方法
1.2.1 人工污染样品的制备
剪取20 g已知HAV阴性的草莓样品(未完全解冻或冷藏样品[21])表皮放至离心管中,然后加入10 μL的甲肝减毒疫苗,生物安全柜中室温静置20 min,使得病毒与草莓样品充分吸附。
1.2.2 草莓样品中病毒富集方法的优化
1.2.2.1 草莓样品中HAV洗脱缓冲液的优化
本研究共对4 种不同的缓冲液进行评估,包括:1)蒸馏水;2)牛肉浸提物(Tris glycine 1g/100mL beef extract,TGBE)(0.1 mol/L Tris-0.05 mol/L甘氨酸-1 g/100 mL牛肉浸出粉,pH 9.5)[20];3)0.1 mol/L甘氨酸-0.3 mol/L NaCl(pH 9.5)[22];4)3 g/100 mL牛肉浸提物(pH 9.5)[4]。
按照1.2.1节的方法制备样品,分别加入35 mL上述4 种洗脱缓冲液及30 U的果胶酶,混匀,不要强烈振荡避免草莓样品中果汁和糖分大量溶出[23]。同时以已知阴性的草莓样品作为阴性对照。室温100 r/min孵育10 min后,用1 mol/L NaOH溶液调节至9.5,室温100 r/min孵育20 min;10 000×g,4 ℃离心30 min,将上清液转入干净的离心管中,并用1 mol/L盐酸溶液将pH值调节至7.0±0.2;加入0.25体积的5×PEG-NaCl溶液,振荡60 s混匀,5 ℃、100 r/min 孵育60 min;5℃、10 000×g离心30 min,弃去上清液,然后5 ℃、10 000×g离心5 min ,以压实沉淀物;弃上清液,加入500 μL PBS重悬沉淀;加入1 000 μL的氯仿-正丁醇,涡旋混合,然后在室温条件下孵育5 min;5 ℃、10 000×g离心15 min,将上层水相小心地转移到一个新的离心管中,保留用于提取RNA。
用ABI公司的MagMax Express核酸提取仪提取RNA,采用ABI OneStep RT-PCR kit进行RT-PCR扩增,共做两个平行。
采用优化后的缓冲液分别对10 份添加HAV减毒疫苗的草莓样品进行实验,通过其阳性检出率来评价缓冲液的稳定性。
1.2.2.2 果胶酶添加量的优化
按照1.2.2.1节方法进行优化实验,其中果胶酶的添加量分别为0、10、20、30、40、50 U,共做两个平行。
1.2.2.3 PEG沉淀剂的优化
按照1.2.2.1节方法进行优实验,对PEG(50 g/ 100 mL PEG8000,1.5 mol/L NaCl溶液)的优化包括两个方面:PEG沉淀剂作用时间和作用温度。采用优化后的洗脱缓冲液进行病毒洗脱,加入PEG沉淀剂后分别采取5 ℃孵育1 h、5 ℃孵育4 h、5 ℃孵育18 h、室温孵育1 h、室温孵育4 h、室温孵育18 h等条件进行孵育。
1.2.2.4 抑制剂去除剂的优化
按照1.2.2.1节方法进行优实验,采用抑制剂去除剂包括:氯仿-正丁醇(1∶1)和三氯三氟乙烷。以不加抑制剂去除剂的样品作为对照,研究抑制剂去除剂对HAV检测的影响。
1.2.3 病毒RNA提取方法比较
病毒RNA的提取分别为:1)美国应用生物系统公司的RNA提取试剂盒;2)QIAamp Viral RNA Mini Kit;3)TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0。按照其说明书进行RNA的提取,提取完毕的病毒RNA于-20 ℃保存备用。
1.2.4 实时荧光RT-PCR反应体系和反应参数
反应体系:总体积25 μL,包括模板RNA溶液5 μL,25×RT-PCR酶预混液1 μL,2×RT-PCR缓冲液12.5 μL,正向引物1.25 μL、反向引物2.25 μL、荧光探针0.625 μL,灭菌超纯水6.375 μL;其中各引物和探针的浓度均为10 ømol/L;以上各组分加入至0.2 mL实时荧光PCR反应管中,混匀,5 000 r/min离心10 s。
反应参数为:45 ℃反转10 min;95 ℃预变性10 min;40 个循环扩增(95 ℃、15 s,60 ℃、45 s)。
每次循环的退火时收集荧光,检测结束后,根据扩增曲线和Ct值判定结果。
结果判断:Ct值≥40,可判断样品中HAV核酸检测阴性;Ct值≤35,可判断该样品中HAV核酸检测阳性;35<Ct值<40,建议重做样本。重做结果Ct值≥40者为阴性,否则为阳性。
1.2.5 草莓样品中HAV灵敏度的测定
将提取的HAV病毒RNA样品分别按1∶10进行梯度系列稀释(100、10-1、10-2、10-3、10-4、10-5)后,按照1.2.4节的反应体系和参数进行多次RT-PCR反应,确定本方法的灵敏度。
1.2.6 样品检测
按照上述建立的快速检测体系,对送检的50 份草莓进行前处理,提取和纯化病毒核酸,设立阳性和阴性对照,参照1.2.4节进行实时荧光RT-PCR检测,以检验本实验方法的效果。
1.2.7 数据分析
所有的统计分析的完成均采用SPSS进行分析,差异显著为P<0.05。
2 结果与分析
2.1 草莓样品中HAV富集方法的优化
2.1.1 洗脱缓冲液优化
采用上述4 种缓冲液洗涤草莓表皮试样时,试样中大量的果汁会溶出,整个试样液的体积明显增加,果汁中的酸性物质会使得溶液的pH值下降,10 min孵育后,TGBE缓冲液(pH 9.5)维持pH值的能力最强(pH 8.8左右),3 g/100 mL牛肉浸提物(pH 9.5)和0.1 mol/L甘氨酸-0.3 mol/L NaCl (pH 9.5)次之(pH 8.0左右),蒸馏水则维持pH值在4.0左右。因此TGBE缓冲液更容易将病毒粒子与样品分开。
4 种洗脱缓冲液对人工污染HAV疫苗的草莓样品进行病毒洗脱测试结果(图1)表明:4 种洗脱缓冲液按照PCR后Ct值的大小,顺序为:TGBE缓冲液(25.43)<3 g/100 mL牛肉浸提物(26.22) <0.1 mol/L甘氨酸-0.3 mol/L NaCl(30.24)<蒸馏水(31.56)(P<0.05)。

图1 病毒洗脱缓冲液对草莓样品病毒富集的影响Fig.1 Effect of elution buffers on HAV enrichment
4 种洗脱缓冲液对10 份草莓样品的检测结果显示(图2),TGBE缓冲液的阳性检出率为100%,3g/100mL牛肉浸提物和甘氨酸缓冲液的阳性检出率为90%,而蒸馏水的阳性检出率为70%。表明TGBE缓冲液对草莓样品中HAV的缓冲效果最稳定。

图2 4 种洗脱缓冲液对草莓样品种HAV的阳性检出率的影响Fig.2 Effect of four elution buffers on HAV positive detection rate in strawberry
2.1.2 果胶酶添加量优化结果
果胶酶的加入有效消化杂质以减少PCR抑制剂,对果胶酶添加量的实验结果(图3)表明,果胶酶添加量为0 U时,Ct值最高,为35.36。随着果胶酶添加量的增加,Ct值越来越低,30 U时效果最佳,为24.75。果胶酶添加量在40 U和50 U时,Ct值(25.15和25.64)反而升高,其原因可能为剩余果胶酶形成的基质会增加PCR抑制剂的存在,并且添加量过多造成浪费,因此,草莓样品中病毒富集的果胶酶最佳添加量为30 U。

图3 果胶酶添加量对病毒富集的影响Fig.3 Effect of pectinase dosage on HAV enrichment
2.1.3 PEG沉淀剂优化结果
PEG是具有很强吸水性及凝聚和沉淀蛋白作用的高分子聚合物,是食品中病毒浓缩的有效方法[24]。本研究对PEG沉淀剂的作用时间和作用温度的结果(图4)表明,PEG 5 ℃孵育1 h,5 ℃孵育4 h和5 ℃孵育18 h没有差别,而室温孵育与5℃孵育相比较孵育效果较差,其中顺序为室温孵育4 h>室温孵育1 h>室温孵育过夜。综合以上结果,PEG沉淀时间选取1 h,有利于降低整个检测时限,故最佳PEG沉淀时间和温度为5 ℃孵育1 h。

图4 PEG孵育时间和温度对草莓样品中HAV病毒富集的影响Fig.4 Effect of incubation time and temperature in the presence ofPEG on the enrichment of HAV in strawberry
2.1.4 抑制剂去除剂优化结果

图5 PCR抑制剂去除剂对草莓样品中HAV富集的影响Fig.5 Effect of different PCR inhibitor removers on the enrichment of HAV in strawberry
采用氯仿-正丁醇(1∶1)和三氯三氟乙烷两种抑制剂去除剂对病毒富集效果进行实验,图5表明:氯仿-正丁醇的Ct值大于三氯三氟乙烷,但统计学分析没有显著差异。而根据环保要求,氯仿-正丁醇优于三氯三氟乙烷。采用氯仿-正丁醇和三氯三氟乙烷两种抑制剂去除剂对病毒富集效果进行实验,表2表明:10 份草莓样品(同一批次)中添加抑制剂去除剂后HAV的阳性检出率为100%,而不添加抑制剂去除剂的HAV阳性检出率为70%。由此可见,添加抑制剂去除剂能提高检测灵敏度。

表2 草莓样品中使用和不使用抑制剂去除剂时对HAV检测阳性率的影响Table 2 Effect of PCR inhibitor removers on the positive detection rate of HAV
2.2 RNA提取方法比较结果
采用美国应用生物系统公司的RNA提取试剂盒、QIAamp Viral RNA Mini Kit和TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0三种试剂盒对人工接种草莓样品中的HAV(稀释10-1)病毒进行RNA提取的结果如图6所示。

图6 不同RNA提取方法的比较Fig.6 Comparison of different RNA extraction methods
由图6可知,3 种方法提取RNA效果为美国应用生物系统公司的RNA提取试剂盒(ABI)> QIAamp Viral RNA Mini Kit(Qiagen)>TaKaRa MiniBEST ViRal RNA/DNA Extraction Kit Ver.4.0(TaKaRa),但是三者之间没有差异(P>0.1),没有统计学意义。
而在RNA提取过程中,3 种方法各有优缺点,TaKaRa的试剂盒在操作过程中较为繁琐,提取时间长;Qiagen的提取方法与之相比较为简化,但是二者提取RNA所需要的病毒悬液较多(均大于200 μL),所需时间也长(40 min左右),而且反复开盖容易引起污染。而ABI RNA提取试剂盒建立在全自动仪器设备配套的基础上,只需将所需提取试剂加入,封闭状态自动提取,避免了操作过程中的污染,提取RNA所需的病毒悬液只需50 μL,而且完成整个操作仅需要20 min左右。因此,本实验选取的最优方法为ABI RNA提取试剂盒。
2.3 灵敏度实验结果
HAV病毒RNA梯度稀释检测结果(图7)表明,在稀释度为10-3时,Ct值≤35(结果为阳性),且重复性和稳定性良好,稀释度分别为10-4~10-5无典型扩增曲线,Ct值≥40(结果为阴性),表明本研究对于草莓样品中HAV的检测灵敏度为31.36 CCID50/20 g。

图7 草莓样品中HAV检测灵敏度Fig.7 Sensitivity of RT-PCR for the detection of HAV
2.4 样品检测结果
按照优化的最佳条件,以添加HAV减毒疫苗的样品为过程控制,进行病毒RNA提取,对送检的50 份样品进行检测,结果见图8。由检测结果可以知道,所检样品均为阴性,阳性和阴性对照正常。结果证明本研究所建立的方法适用于草莓样品中HAV的检测。

图8 50 份草莓样品中HAV的检测结果Fig.8 Amplification curves of 50 strawberry samples using RT-PCR
3 讨 论
本实验对HAV病毒在草莓样品中病毒富集步骤和RNA提取方法进行优化。病毒富集是本检测方法的关键步骤,PEG沉淀作为一种快速和温和的方法用于浓缩病毒,它能够在中性pH值和不含其他化学物质的高离子浓度的溶液中进行作用[25],饶红[18]、莫雪梅[21]等采用PEG过夜孵育以浓缩病毒,进行HAV病毒的检测。本研究对PEG8000孵育时间和孵育温度对HAV病毒富集影响进行了研究,结果发现1 h孵育与过夜孵育具有同等的效果。优化后的方法较领域内普遍使用的方法而言,极大地缩短了检测时间,整个检测过程仅用时5~6 h。检测方法的灵敏度可达到31.36 CCID50/20 g,检测方法的特异性为100%。
莫雪梅等[21]对来自广州市的45 份草莓样品进行检测,结果显示,45 份中有3 份呈阳性,检出率为6.67%。但是,本实验对50 份草莓样品进行检测,结果均为阴性,这种检出率差异可能是由于地区差异和产业规范程度不同造成的。本实验样品均来自丹东地区,该地区气候条件良好,降雨量多,很大程度上避免了因灌溉引起的HAV污染问题。此外,该地区草莓种植管理较为规范,并且部分企业已获得欧盟认可,这也是造成本实验草莓样品HAV阳性检测率低的重要原因。
目前,国内尚未有草莓中HAV的标准检测方法,鉴于HAV在食源性疾病中的重要性,评价和优化食品中HAV的检测方法具有重要意义。本研究中优化的HAV检测的操作步骤可用于HAV相关的疾病爆发性检测。该方法对于食源性疾病的调查和食品的监测极其重要,下一个研究方向为其他重要食品基质中特别是小浆果中病毒洗脱和浓缩等操作条件的优化。
[1] MULLENDORE J L, SOBSEY M D, SHIEH Y C. Improved method for the recovery of hepatitis A virus from oysters[J]. Journal of Virological Methods, 2001, 94(1/2): 25-35.
[2] MYRMEL M, RIMSTAD E, WASTESON Y. Immunomagnetic separation of a Norwalk-like virus (genogroup Ⅰ) in artificially contaminated environmental water samples[J]. International Journal of Food Microbiology, 2000, 62(1/2): 17-26.
[3] 陈广全, 张慧媛, 曾静. 食品安全检测培训教材微生物检测[M]. 北京: 中国标准出版社, 2010: 480-481.
[4] KIM H Y, KWAK I S, HWANG I G, et al. Optimization of methods for detecting norovirus on various fruit[J]. Journal of Virological Methods, 2008, 153(2): 104-110.
[5] BOSCH A, SANCHEZ G, LE G F, et al. Human enteric viruses in Coquina clams associated with a large hepatitis A outbreak[J]. Water Science and Technology, 2001, 43(12): 61-65.
[6] DANIELS N A, BERGMIRE-SWEAT D A, SCHWAB K J, et al. A foodborne outbreak of gastroenteritis associated with Norwalklike viruses: first molecular traceback to sandwiches contaminated during preparation[J]. Journal of Infectious Diseases, 2000, 181(4): 1467-1470.
[7] GUEVREMONT E, BRASSARD J, HOUDE A, et al. Development of an extraction and concentration procedure and comparison of RT-PCR primer systems for the detection of hepatitis A virus and norovirus GII in green onions[J]. Journal of Virological Methods, 2006, 134(1/2): 130-135.
[8] HUTIN Y J, POOL V, CRAMER E H, et al. A multistate foodborne outbreak of hepatitis A[J]. The New England Journal of Medicine, 1999, 340: 595-602.
[9] le GUYADER F, DUBOIS E, MENARD D, et al. Detection ofhepatitis A virus, rotavirus, and enterovirus on naturally contaminated shellfish and sediment by reverse transcription-seminested PCR[J]. Applied and Environment Microbiology, 1994, 60(10): 3665-3671.
[10] POTASMAN I, PAZ A, ODEH M. Infectious outbreaks associated with bivalve shellfish consumption: a worldwide perspective[J]. Clinical Infectious Diseases, 2002, 35(8): 921-928.
[11] ROSENBLUM L S, MIRKIN I R, ALLEN D T, et al. A multifocal outbreak of hepatitis A traced to commercially distributed lettuce[J]. American Journal of Public Health, 1990, 80(9): 1075-1080.
[12] CALDERON-MARGALIT R S, HALPERIN R T, ORR N, et al. A largescale gastroenteritis outbreak associated with Norovirus in nursing homes[J]. Epidemiology and Infection, 2005, 133(1): 35-40.
[13] PARASHAR U D, DOW L, FRANKHAUSER R, et al. An outbreak of viral gastroenteritis associated with consumption of sandwiches: implications for the control of transmission by food handlers[J]. Epidemiology and Infection, 1998, 121(3): 615-621.
[14] RUTJES S A, LODDER-VERSCHOOR F, van der POEL W H, et al. Detection of noroviruses in foods: a study on virus extraction procedures in foods implicated in outbreaks of human gastroenteritis[J]. Journal of Food Protect, 2006, 69(8): 1949-1956.
[15] BAERT L, UYTTENDAELE M, STALS A, et al. Reported foodborne outbreaks due to noroviruses in Belgium: the link between food and patient investigations in an international context[J]. Epidemiology and Infection, 2009, 137(3): 316-325.
[16] CLIVER D O. Detection and control of food borne viruses[J]. Trends in Food Science and Technology, 1995, 6(11): 353-358.
[17] 陈广全, 饶红, 傅浦博, 等. 食品中诺沃克样病毒和甲肝病毒检测方法研究进展[J]. 检验检疫科学, 2005, 15(6): 51-54.
[18] 饶红, 陈广全, 冯骞, 等. 蔬菜及水果中NLVs和甲肝检测的研究[J].中国食品卫生杂志, 2007, 19(2): 131-134.
[19] 张其刚, 潘文良, 李想, 等. 猪胃黏蛋白偶联磁珠和聚乙二醇富集检测青葱和葡萄中诺如病毒的比较研究[J]. 食品科学, 2012, 33(16): 241-245.
[20] International Organization for Standards. ISO/TS 15216—2 Microbiology of food and animal feed—Horizontal method for determination of hepatitis A virus and norovirus in food using realtime RT-PCR—Part 2: Method for qualitative detection[S]. Geneva: International Organization for Standardization, 2013.
[21] 莫雪梅, 高东微. 运用SYBRGreen荧光实时RT-PCR法检测草莓中HAV[J]. 食品科学, 2010, 31(14): 153-157.
[22] 标准化管理委员会. GB/T 22287—2008 贝类中HAV检测方法: 普通RT-PCR方法和实时荧光RT-PCR方法[S]. 北京: 中国标准出版社, 2008.
[23] 周阳, 栾军, 蒋鲁言, 等. 实时荧光RT-PCR检测冷冻草莓中诺如病毒[J]. 食品安全质量检测学报, 2013, 4(2): 515-520.
[24] 周晓红. 食品中诺如病毒RT-PCR检测技术研究进展[J]. 国外医学:卫生学分册, 2009, 36(4): 234-237.
[25] LEWIS G D, METCALF T G. Polyethylene glycol precipitation for recovery of pathogenic viruses including hepatitis A virus and human rotavirus, from oyster, water and sediment samples[J]. Applied and Environment Microbiology, 1988, 54(8): 1983-1988.
An Optimized Method for the Detection of Hapatitis A Virus (HAV) in Strawberry
GAO Shi-guang1, WANG Hai-yan2, GUO Hui1, FENG Hua-wei1, YU Yang1, MA Li-dan1,*
(1. Dandong Entry-Exit Inspection and Quarantine Bureau, Dandong 118000, China; 2. Dayaowan Entry-Exit Inspection and Quarantine Bureau, Dalian 116600, China)
Objective: To establish the optimal enrichment and RNA extraction procedures for detecting hepatitis A virus (HAV) in strawberries. Methods: After artificial contamination of known negative samples, HAV enrichment under optimized conditions and RNA extraction were performed for analysis by real-time fluorescence PCR. Results: The virus was enriched by elution with Tris glycine 1 g/100 mL beef extract buffer (TGBE), removal of the inhibitors using 30 U of pectinase and a mixture of chloroform with n-butanol, precipitation with PEG, and 1 h incubation at 5 ℃. The detection method was sensitive. The best RNA extraction results were achieved with a RNA extraction kit from ABI. The sensitivity of the optimized method for detecting HAV particles was 31.36 CCID50/20 g of sample. Negative results were reported for all 50 samples tested. Conclusion: The established method is suitable for the detection of HAV in strawberry samples with high sensitivity.
strawberry; hepatitis A virus; virus enrichment; RNA extraction
R373.2;TS207.5
A
1002-6630(2014)24-0213-06
10.7506/spkx1002-6630-201424041
2014-07-29
国家质检总局科研项目(2014IK094);辽宁出入境检验检疫局科研项目(LK2013-18)
高世光(1981—),男,工程师,学士,主要从事病原微生物研究。E-mail:ddciq99@sohu.com
*通信作者:麻丽丹(1976—),女,高级工程师,硕士,主要从事病原微生物研究。E-mail:2212097@163.com

