H 7亚型禽流感病毒核酸标准品制备及双探针荧光RT-PCR检测研究
高志强,张鹤晓,蒲 静,张 伟,谷 强,乔彩霞,张利峰,汪 琳
(北京出入境检验检疫局检验检疫技术中心,北京 通州101113)
H7亚型禽流感病毒可引起高致病性禽流感,因此OIE手册将所有H7亚型禽流感列为需通报的疫病[1]。我国尚未发生由H7亚型禽流感引起的高致病性禽流感,但禽群中可能存在低致病性H7亚型禽流感病毒。2013年3月,我国发生人感染H7N9禽流感病毒的病例,病毒基因序列分析显示,该病毒为全球首次发现的新亚型流感病毒,目前尽管对该疫病的感染来源还不清楚,但已从活禽交易市场多次检测到H7N9亚型禽流感病毒。目前确诊本病除采用传统的鸡胚病毒分离方法外,常采用核酸检测方法进行禽流感病毒H7亚型快速分型检测。
为规范禽流感病毒核酸检测的质控问题,本研究参考相关标准物质的研制方法以及统计方法[2-3],针对H7亚型禽流感病毒最具有检测意义的HA片段,在扩增克隆的基础上,体外转录全长RNA。经联合定值和不确定分析制备出禽流感病毒H7亚型核酸检测的标准样品。此外,首次采用MGB修饰的双简并探针建立了Taq Man荧光RT-PCR检测技术,并使用制备的标准样品对方法的检测限进行了测定。
1 材料与方法
1.1 试剂
1.1.1 病毒核酸 本研究中涉及的病毒核酸包括A/Chicken/1/2002(H7N1),A/Shanghai/1/2013(H7N9),A/Swine/1/2003(H1N1),A/equine/HB/1/07(H3N8),A/Swine/2003/GD(H3),A/Swine/2003/2(H3),A/Chicken/JL(H3),A/Chicken/JL(H4),6株H5N1、1株H9亚型禽流感病毒核酸以及2株新城疫病毒核酸(LaSota和F48E9)。
1.1.2 主要试剂 TRIZol,购自Invitrogen公司;M-MLV反转录酶、Taq DNA聚合酶、dNTP、RNA酶抑制剂以及体外转录试剂盒,购自Promega公司。pMD20-T载体克隆试剂盒,One Step RNA PCR Kit,MiniBEST Plasmid Purification以及DNA Fragment Purification Kit,购自TaKaRa公司。
1.1.3 实时荧光定量PCR仪 LightCycler,Roche公司产品。
1.2 H7亚型禽流感病毒HA基因的扩增、克隆和序列分析 设计以下1对引物,用于扩增病毒含完整HA ORF的基因片段。

表1 扩增H7亚型禽流感病毒HA基因的引物名称、序列
应用One Step RNA PCR Kit经一步法RT-PCR扩增全长HA基因片段,反应条件为50℃30min,94℃2min;94℃30 s,50℃30 s,72℃2min,30个循环。将目的片段克隆于pMD20-T载体。
1.3 体外转录病毒RNA制备标准样品 选用Smal I对质粒线性化。经体外转录制备RNA纯品。根据260 nm和280 nm的吸光度值测算其RNA拷贝数,应用RNA保存液(TRIZol:水=3∶1)稀释RNA至108拷贝数/μL后分装,0.5m L/管。
1.4 标准样品的均匀性和稳定性检验 随机抽取10管制备的标准品,提取RNA。测定拷贝数,用单因子方差分析进行统计[2]。分别于0、0.5、6、12个月以及24个月随机抽取制备的标准品提取RNA。测定拷贝数,经回归分析确定其不确定度,采用t检验确定其稳定性[2]。
1.5 标准品协作标定和不确定度分析 联合8家实验室对制备的标准品进行定值,取其平均值作为定值结果。对标准品的各个不确定度分量进行合成[2]。
1.6 分型检测引物与探针的设计 在多重序列比对的基础上,设计1对引物和2条MGB探针,对设计的引物和探针经BLAST进行验证,序列见表2。

表2 引物、探针的名称及序列
1.7 H7亚型双探针荧光RT-PCR反应体系的建立与优化 使用1∶104稀释的H7亚型禽流感病毒RNA,对反应体系中的引物、探针、Mg2+以及dNTP浓度进行优化,确定最佳反应参数。
1.8 灵敏度、特异性和重复性试验 对制备的cRNA标准品以10倍梯度稀释后,按最佳条件进行测定,确定检测极限。对1.1.1中的病毒核酸样品进行检测,分析方法的特异性。选3个不同浓度的cRNA模板,用荧光RT-PCR方法连续检测3次,并计算变异系数,验证方法的重复性。
1.9 对临床样品的检测验证 对已知禽拭子样品586份进行检测。在实际样品中验证方法的可靠性。
2 结果
2.1 H7亚型禽流感病毒HA基因的扩增、克隆和测序 扩增HA基因结果见图1。扩增片段克隆入pMD20-T载体,测序鉴定后命名为pMD20-THA(H7N1)。

图1目的片段RT-PCR扩增结果
2.2 体外转录病毒RNA制备标准品 制备的体外转录RNA,经测定结果显示,A260和A280的比值均在2.0±0.1范围内,表明RNA纯度较高。
2.3 均匀性检验结果 采用单因子方差分析确定瓶间均匀性。管(瓶)间方差:

因此管(瓶)间标准偏差为:

2.4 稳定性研究结果 与斜率相关的不确定度为:

自由度为3和P=0.95(95%置信水平)的t分布值为3.18。
因 ||b1〈t0.95,n-2·s( ||b1)故斜率不显著,说明制备的标准物质候选物稳定。而-80℃保存24个月的长期稳定性的不确定度贡献为:
ults=sb·t=4.316×104×24=1.036×106Copies/μL。
2.5 联合定值研究 对8组独立的数据进行分析。总平均值为:

经单因子方差分析。总平均值的不确定度为:
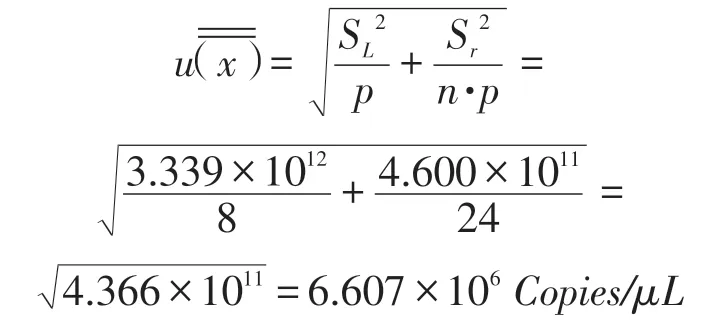
定值结果:H7亚型动物流感病毒HA基因RNA含量为1.015×108Copies/μL,测定不确定度为6.607×105。
2.6 标准样品的不确定度合成 通过合成测定、均匀性和稳定性的不确定度的贡献来估算H7亚型禽流感病毒核酸标准品候选物的总不确定度。

因此H7亚型禽流感核酸标准品候选物的量值可以表示为(1.015±0.016)×108Copies/μL。
2.7 荧光定量RT-PCR的反应条件的优化结果
最适反应总体积25μL,其中模板10.0μL;引物浓度为0.4μmol/L,探针浓度为0.15μmol/L,Mg2+浓度为6mmol/L;最适循环参数为42℃30min,94℃3min;之后92℃15 s,53℃10 s,60℃35 s,40个循环。
2.8 灵敏度、特异性和重复性试验结果 将标准品RNA稀释为105copies/10μL~101 copies/10μL进行检测,结果显示,建立的检测方法的检测限可达10 copies,图2为检测限测定结果。建立的方法与1.1.1所述病毒核酸不发生交叉反应。对3个不同浓度的cRNA标准模板,用所建立的荧光RT-PCR方法连续检测3次,统计各组Ct值的变异系数(CV%),均小于5%。

图2 H7检测方法的检测极限测定
2.9 建立方法对临床样品的检测结果 应用建立的方法对586份拭子样品进行检测。检出2份H7亚型阳性荧光RT-PCR样品,经与普通RTPCR检测方法(《SN/T 1182-2010禽流感检疫技术规范》)进行比较,结果一致。
3 结论与讨论
针对H7亚型禽流感病毒,目前国内外已经研制出许多核酸检测方法,但缺乏参比品进行评价和验证。本研究针对H7亚型流感病毒最具分型检测意义的HA基因全长核酸片段制备出标准品并进行了均匀性和稳定性研究。由于该标准品为RNA,在实际检测中具有很好的适用性。不仅可用于评定实验室鉴别诊断H7亚型禽流感病毒核酸的能力,还可用于实验室进行质量控制和量值传递提供参比品。
目前国内外已建立了一些基于Taq Man的荧光RT-PCR检测方法用于H7亚型分型检测[4-5]。在本研究中,通过对大量的序列比对,找出在禽流感病毒H7 HA基因间保守和特异的序列进行引物探针设计。由于HA基因的高度变异性,1套引物探针很难覆盖各种H7亚型毒株,因此使用1对简并引物和2条MGB探针来保证方法对不同来源H7亚型病毒的通用性,进而建立了H7亚型禽流感病毒Taq Man荧光RT-PCR检测方法。运用优化后的方法检测制备的标准样品,结果显示,检测极限可达10Copies,特异性和重复性良好,并使用临床样品进行了验证。
[1]Office International des Epizooties.Manual of Diagnostic Tests and Vaccines for Terrestrial Animals[M].Paris:Office International des Epizooties,2008:1128-1138.
[2]全国标准样品技术委员会.标准样品的工作导则(3)标准样品定值的一般原则和统计方法[M].北京:中国标准出版社,GB/T 15000.3-2008/ISO Guide 35:2006.
[3]Fronhoffs S,Totzke G,Stier S,et al.A method for the rapid construction of cRNA standard curves in quantitative real-time reverse transcription polymerase chain reaction[J].Molecular and Cellular Probes,2002,16:99-110.
[4]Spackman E,Senne D A,Myers T J,etal.Developmentof a realtime reverse transcriptase PCR assay for type A influenza virus and the avian H5 and H7 hemagglutinin subtypes[J].Clin Microbiol,2002,40(9):3256-3260.
[5]Van Borm S,Suarez D L,Boschmans M,et al.Rapid detection of Eurasian and American H7 subtype influenza A viruses using a single TaqMan MGB real-time RT-PCR[J].Avian Dis,2010,54(S1):632-638.

