猫杯状病毒感染性克隆的构建
郑翠玲,向 华,黄 元,陈 晶,王晓虎,宣 华
(1.广东省农业科学院动物卫生研究所,广东 广州510640;2.唐山职业技术学院,河北 唐山064003)
猫杯状病毒(Feline Calicivirus,FCV)是猫科动物的一种高度传染性病原,能引起猫的口腔或上呼吸道感染,有的毒株还能导致跛行。高玉伟[1]等从我国野生动物中分离到猫杯状病毒(FCV),这表明猫杯状病毒对野生珍稀动物的健康造成了极大的威胁。
FCV属于杯状病毒科(Caliciviridae)杯状病毒属(Calicivirus)。尽管此类病毒早已发现,但由于缺乏相应的细胞培养系统,导致对其分子生物学特性的研究进展缓慢。猫杯状病毒是杯状病毒科中惟一可在体外成功培养的病毒[2]。随着反向遗传学技术的发展,许多正链RNA病毒的研究取得重大进展[3]。本研究旨在建立FCV感染性克隆,构建嵌合载体,进而研究其他杯状病毒生物学特性和致病机理。
1 材料与方法
1.1 病毒、细胞、质粒及菌种 FCV病毒液和质粒PFCV+T由广东省农业科学院兽医研究所保存;La Taq DNA聚合酶、反转录酶AMVRT、限制性内切酶Sma I、Sph I Mlu I、DNA凝胶回收试剂盒均为大连TaKaRa公司产品;LipofectamineTM2 000 Reagent、LSTRIZol试剂为Invitrogen公司产品;高纯度质粒提取纯化试剂盒为TIANGEN公司产品;细胞培养用MEM、新生小牛血清均为GIBOCOBRL公司产品。
1.2 引物设计 参照已经获得的FCV CH-GD株全基因组序列[4],设计了扩增FCV全基因的2对引物,在其中1对引物中引入Sma I,Sph I酶切位点和T7启动子核心序列,在另1对引物中引入一个突变位点,形成一个新的酶切位点Mlu I,两对引物序列如下:
P1:5′-CAGCCCGGGTAATACGACTCACTATAG TAAAAGAAATTTGAGACAATG-3′;P2:5′-GGAACGCGTGTCTATATGCAAGC-3;P3:5-GGAACGCGTGTCTATATGCAAGC-3′;P4:5′CTGCATGCTTTTTTT TTTTTTTTTTTTTTTTTTTTTTTTTCCCTGGGGTTAGGCGC-3′。引物由上海Invitrogen生物技术有限公司合成。
1.3 聚合酶链式反应(PCR) 用已经获得的质粒PFCV+T为模板进行PCR扩增。FCV长片段P5.2的扩增:反应总体积为50μL。反应条件:预变性95℃5min,变性94℃30 s,退火58℃30 s,延伸72℃5 min 30 s,进行30个循环后,最后72℃延伸10min。FCV短片段P2.6的扩增:反应总体积为50μL。预变性94℃30 s,退火57℃30 s,延伸72℃5min 30 s,进行30个循环后,最后72℃延伸10min。1%琼脂糖凝胶电泳鉴定PCR产物。
1.4 重组PCR 以PCR产物P5.2和P2.6混合液为模板,P1和P4为上下游引物,用重组PCR方法扩增FCV的全基因组。反应总体积为50μL。预变性95℃7min,变性94℃30 s,退火58℃30 s,延伸72℃8min,进行30个循环后,最后72℃延伸10min。重组PCR产物用酶切鉴定,然后用1%琼脂糖凝胶电泳观察酶切结果。
1.5 连接、转化及阳性克隆质粒的鉴定 将鉴定正确的重组PCR产物与pMD20-T载体连接,转化大肠杆菌JM109感受态,并进行阳性克隆质粒的鉴定。阳性质粒命名为P′FCV+T,其菌液送Invitrogen公司进行序列测定。
1.6 体外转录 用Sma I酶将全长cDNA克隆质粒P′FCV+T切开使其线性化,用RibomaxTM体外转录试剂盒(Promega)进行体外转录反应。1组加Ribom7G Cap Analog,2组不加Ribom7GCap Analog。
1.7 体外转染 用1μg的RNA和10μL脂质体混合,分别加100μL Opti-MEMI细胞培养液,孵育30min,用800μLOpti-MEMI稀释后加到事先准备好的F81细胞上。37℃作用5 h,吸弃转染液,加入含10%FCSMEM培养液(不含抗生素)。在37℃,5%CO2下培养24~48 h,观察具有FCV致病特点的细胞病变(CPE)。同时作阴性、阳性对照。阴性对照设两个:1个为正常培养的细胞对照,1个为不加帽状物的转录产物的细胞对照。阳性对照病毒按100 TCID50接毒。观察结果。
1.8 FCV感染性克隆的鉴定 将转染后获得的病毒液接种新的F81细胞,当细胞100%出现病变时,收毒,再用获得的病毒液接种新的F81细胞,如此连续传5代。从最后一次收集的病毒液中提取病毒RNA。进行RT-PCR试验。PCR产物用Mlu I酶切鉴定。
2 结果
2.1 PCR结果 以质粒PFCV+T为模板,分别进行PCR扩增,经1%琼脂糖凝胶电泳,得到2.6 kb和5.2 kb两个片段,大小与预期相符。
2.2 重组PCR及酶切鉴定 用重组PCR方法扩增FCV的全基因组。经1%琼脂糖凝胶电泳后,获得7.6 kb的目的条带。用Mlu I酶酶切鉴定7.6 kb的条带,1%琼脂糖凝胶电泳后,出现2.6 kb和5.2 kb的两条带,与预期相符。
2.3 质粒的酶切鉴定 经重组PCR扩增获得的FCV全基因片段与pMD20-T载体连接,转化JM109感受态,提取重组质粒,用Sma I单酶切鉴定质粒。将获得的正向连接质粒命名为P′FCV+T。用Mlu I酶单酶切鉴定质粒,1%琼脂糖凝胶电泳,结果与预期值相符,得到一条10.3 kb的目的条带。
2.4 体外转录 用RibomaxTM体外转录试剂盒Promega对线性化的质粒进行体外转录反应。用RNase-Free DNase去除冗余的DNA,经分光光度计测定,RNA浓度为0.5μg/mL,转录成功。
2.5 体外转染 将体外转录获得的RNA用脂质体转染F81细胞。5′端加帽状结构的RNA所转染的F81细胞48 h后出现典型的FCV感染病变,而5′端不加帽状结构的RNA所转染的F81细胞则无病变发生(图2、3、4、5)。
2.6 感染性克隆的鉴定 为确定病毒来源于全长cDNA克隆,在5 121位引入一个突变,由此产生一个新的酶切位点Mlu I,构建含有突变点的全长cDNA克隆,基因序列测诱导突变成功。
3 讨论

图1 PCR及酶切鉴定
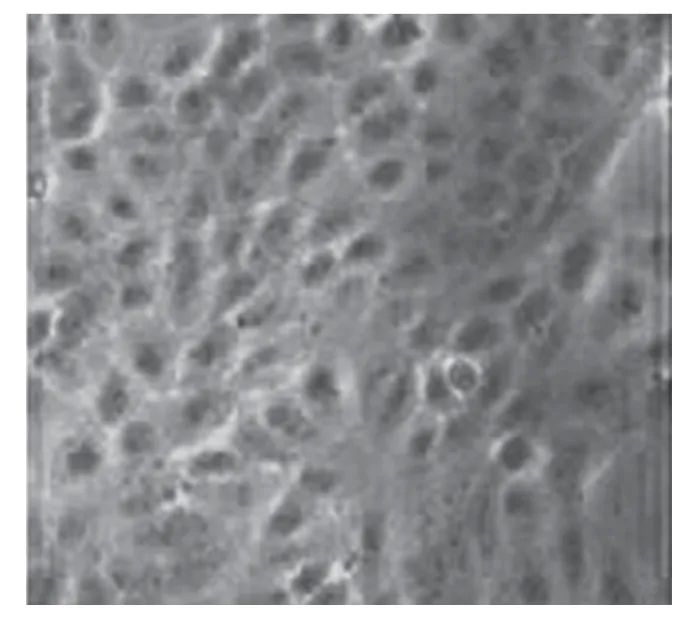
图2 阴性对照:正常F81细胞(200×)

图3 阴性对照:不加帽状结构(100×)

图4(A,B)阳性对照F81细胞(A:200×;B:400×)
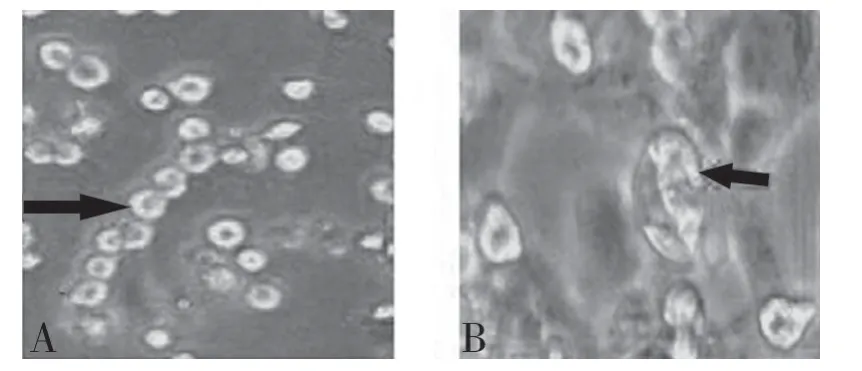
图5 转染48 h后细胞出现病变(A:400×;B:400×)
3.1 关于感染性克隆的构建 本研究的目的是构建FCV的感染性克隆载体。FCV是目前除猪水疱疹病毒(自1959年美国最后一次发生以来,除在海洋哺乳动物和鱼类中仍有这种病毒存在外,就再未发现过这种病毒,国内也未见报道)外,惟一可在细胞培养上增殖的杯状病毒。因此构建FCV感染性克隆对杯状病毒的研究有十分重要的意义。Kyeong-OK Chang[5]成功恢复了具有感染性的猪的杯状病毒。Jorg Oliver Thumfart[6]等采用体外转录的方法和构建真核表达质粒的方法,成功恢复了FCV病毒粒子。但国内对此报道甚少。
鉴于FCV基因组比较长,基因组结构复杂,因此在试验中采用先分段扩增,再用重组PCR法扩增全长的策略。重组PCR技术的使用成功解决了用分段扩增的各片段因无合适的酶切位点而无法用DNA聚合酶将其连接起来的难题。新引物序列上游序列中加入了单一的核酸内切酶Sma I酶切位点和T7启动子的核心序列,下游引物序列中加入了核酸内切酶Sph I的酶切位点。引物中引入的单一的核酸内切酶,使FCV cDNA克隆能方便的进行线性化,进而进行体外转录和转染。T7启动子的引入保证了转录的正确起始。本研究构建了FCV的感染性克隆,并对其病毒滴度进行了测定,其致细胞出现病变的时间及病毒滴度与野生型FCV相比无差异。这说明FCV感染性克隆构建成功,为下一步研究其生物学特性、毒力因子、致病机理以及嵌合载体的构建打下了基础。
3.2 关于VPg蛋白 杯状病毒基因组5′端无帽状结构,而是与小RNA病毒一样具有VPg蛋白。但与小RNA病毒不同的是杯状病毒的VPg为感染所必需。因而从FCV全长cDNA克隆体外转录的病毒RNA是否需要VPg样结构才具有感染性是一个非常关键的问题。本研究中将5′端加帽状物组与5′端不加帽状物组同时进行体外转录和转染,结果5′端加帽状物组在转染F81细胞48 h后出现典型的FCV感染病变,而未加帽状物组则无病变出现。这表明5′端帽状结构可以代替VPg起作用。体外转录的FCV RNA加5′端帽状结构就具有感染性,而不加此结构就不具有感染性。
[1]高玉伟,夏咸柱,扈荣良.猎豹与虎猫杯状病毒的分离及其超变区基因比较研究[J].中国预防兽医学报,2003,25(3):179-182.
[2] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:519-531
[3]祁国财,李平花,刘在新.反向遗传学技术在新型疫苗研制中的应用[J].中国预防兽医学报,2012,34(10):841-844.
[4]郑翠玲,向华,宣华,等.猫杯状病毒全基因组的克隆及序列分析[J].中国畜牧兽医,2010(3):109-111.
[5] Kyeong-OK Chang,Stanislav S.Sosnovtsev,et al.Reverse genetic system for porcine enteric calicivirus,a prototype sapovirus in the caliciviridae[J].Journal of virology,2005,79(3):1049-1416.
[6]Jorg Oliver Thumfart,Gregor Meyers.Feline calicivirus:recovery of wild-type and recombinant viruses after transfection of cRNA orcDNA constructs[J].Journal of virology,2002,76(12):6398-6407.

