91例耐多药肺结核患者抗结核药物不良反应发生情况分析
苏伟 阮云洲 赵津 成君 张灿有 王黎霞 李仁忠
结核病患者在应用抗结核药物进行治疗时,药物产生的不良反应是客观存在的,也是不可避免的[1]。如对不良反应没有正确和足够的认识,往往会导致停药或换药,甚至中断治疗乃至危及患者生命,影响患者的治疗效果。耐多药肺结核(MDR-TB)患者因对异烟肼和利福平2种目前最有效的一线抗结核药物产生耐药,需要接受4种以上有效抗结核药物治疗达24个月[2],应用的抗结核药物种类多,且绝大部分为二线抗结核药物,加之治疗时间长,导致不良反应的可能性较一线抗结核药物更大。世界卫生组织2013年全球结核病报告显示,2010年纳入治疗的MDR-TB患者治疗成功率全球平均只有48%[3],治疗过程中不良反应处理不当也是导致MDR-TB治疗成功率低的危险因素之一[2]。本研究通过对“十一五”国家重大科技专项4个研究地区的91例MDR-TB患者治疗过程中发生的药物不良反应情况进行分析,以期了解MDR-TB患者治疗过程中不良反应发生情况,评价抗结核药物不良反应对MDR-TB患者治疗效果的影响。
资料和方法
一、研究地区
本研究采用立意抽样的方法选择研究地区。根据全国各省耐药肺结核基线调查数据,综合考虑是否具有开展MDR-TB诊疗和管理服务的能力、地理位置、经济状况等因素,在全国选择天津市、黑龙江省、浙江省、河南省作为研究现场。每个研究省(直辖市)选择1个地市,地市的选择标准为具备耐药结核病诊断和治疗能力,临床和防治人员能够承担研究工作,最终选取天津市、黑龙江省大庆市、河南省濮阳市、浙江省衢州市4个地区作为研究地区。
二、研究对象
1.研究对象纳入时间:各研究地区于2010年3月开始纳入患者。研究对象为4个研究地区从项目启动开始2010年3月1日至2012年2月29日1年期间,留取痰标本并经传统药物敏感性试验(简称“药敏试验”)确诊且最终纳入治疗的91例MDR-TB患者,至2012年12月底现场调查时治疗已满6个月的患者有81例。
2.患者基本情况:91例MDR-TB患者中男64例(70.3%),女27例(29.7%);患者平均年龄为(42.9±14.7)岁,30~岁年龄组例数最多,为27例(29.7%),≥60岁组例数最少,为18例(19.8%);29例(31.9%)为初治患者,62例(68.1%)为复治患者(表1)。
三、治疗方案
纳入分析的MDR-TB患者初始治疗均采用标准化治疗方案,方案的制定和抗结核药物的选择结合世界卫生组织推荐和当地抗结核药品的可获得性。河南省濮阳市、黑龙江省大庆市和浙江省衢州市为全球基金项目地区,采用全球基金项目提供的进口抗结核药物。化疗方案为6 Z Km(Cm) Lfx(Mfx)PAS(E) Pto/18 Z Lfx(Mfx)PAS(E) Pto(Lfx:左氧氟沙星;Mfx:莫西沙星;PAS:对氨基水杨酸;Pto:丙硫异烟胺),其中病情严重、有并发症及合并症等情况的重症患者采用先住院再门诊治疗的管理方式,其他轻症患者采取全程门诊治疗。
天津市采用国产抗结核药物,来源为医院自行采购药物。化疗方案为6 Z Am(Cm) Lfx(Mfx)PAS(E) Pto/18 Z Lfx(Mfx)PAS(E) Pto(Am:阿米卡星),因定点医院不具备MDR-TB患者住院条件,全部患者采用全程门诊治疗的管理方式。
全球基金项目地区进口抗结核药物与国产药物的规格和剂量不尽相同,进口和国产抗结核药物种类、规格和剂量参见文献[4]。
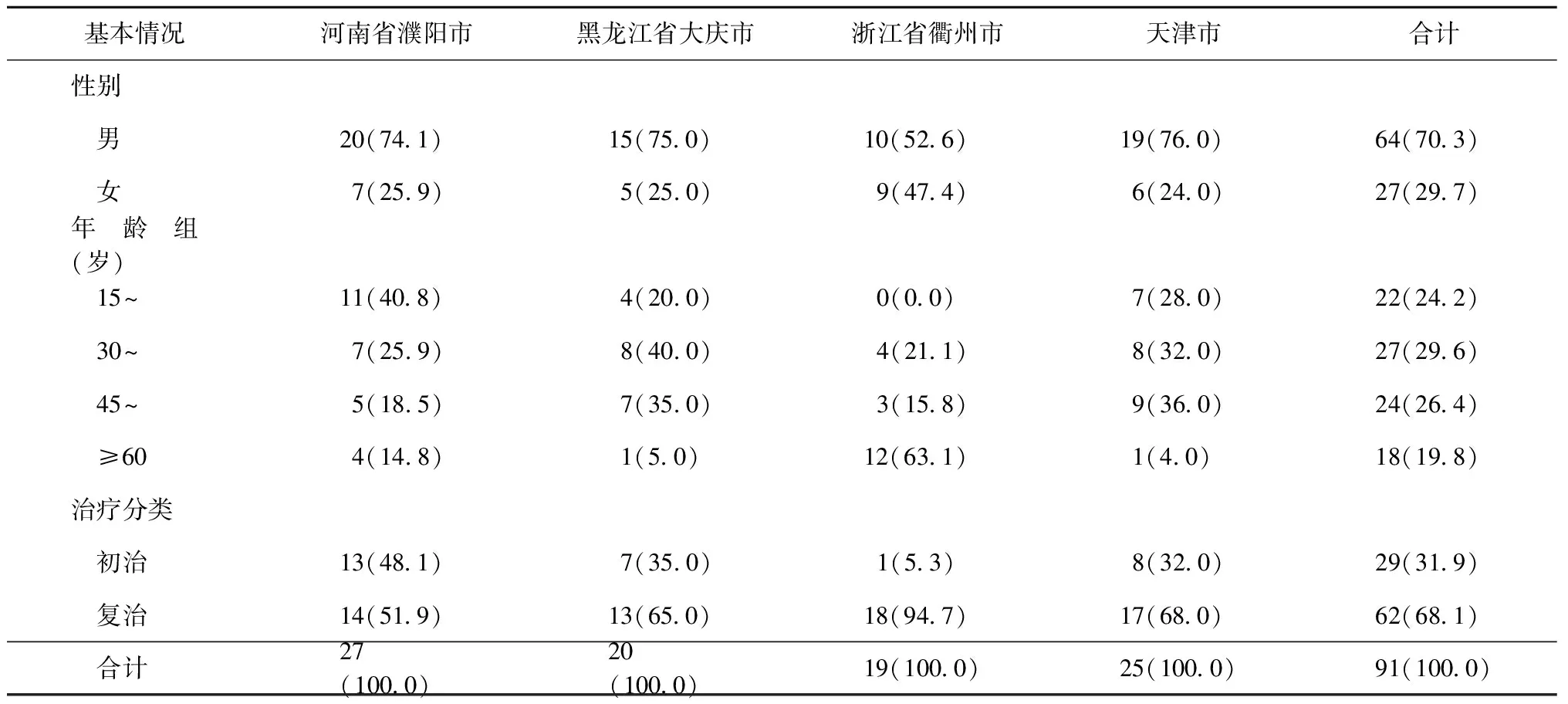
表1 91例MDR-TB患者的基本情况在4个城市中的分布
四、不良反应分类和判断标准
不良反应分类根据专家意见按胃肠道反应、肝脏毒性、电解质紊乱、耳毒性和前庭功能障碍、肾脏毒性、关节痛或肌肉痛、血液系统损害、外周神经炎、视神经炎、精神症状、甲状腺功能紊乱、超敏反应进行分类统计。其中肝脏毒性、电解质紊乱、肾脏毒性、血液系统损害、甲状腺功能紊乱的判断标准以患者病案中实验室检测结果出现异常为准,其余以病案记录为准。
胃肠道反应包括恶心、呕吐、腹泻、食欲不振、腹痛和胃炎等;耳毒性和前庭功能障碍包括耳鸣、经听力测定证实的听力障碍、平衡失调等;精神症状包括抑郁、焦虑、失眠、自杀倾向等。
因同一例患者可能出现2种及以上不良反应,故本研究中不良反应按发生不良反应的患者例次计算。
五、不良反应收集方法
通过专家咨询设计了统一的《耐多药肺结核患者抗结核药物不良反应情况调查表》(简称《调查表》),咨询专家均具有MDR-TB治疗经验,部分专家参与了《耐药结核病化学治疗指南(2009)》的编写。调查表内容包括患者姓名、性别、登记分类等基本情况,以及开始治疗时间、不良反应发生的种类、发生的时间、可能影响的药物、不良反应的处理等。采用回顾性调查的方式,由调查人员到4个项目地区现场查阅全部纳入分析的91例患者病案,根据《调查表》内容,记录MDR-TB患者治疗中的不良反应。
调查人员由经过统一培训的课题研究人员担任,现场调查时与当地治疗患者的临床医生共同查阅病案,以保证调查结果的准确性。
六、统计学分析
采用Excel表格建立MDR-TB患者不良反应数据库,运用SPSS 17.0软件进行相关统计分析,P<0.05为差异有统计学意义。
结 果
一、不良反应发生情况
91例MDR-TB患者中,81例患者出现了不良反应,不良反应发生率为89.0%。男性不良反应发生率(90.6%)略高于女性(85.2%);各年龄组不良反应发生率也有所不同,发生率最高是45~<60岁年龄组,达到95.8%,60岁及以上年龄组不良反应发生率最低,为77.8%;初治和复治患者不良反应发生率分别为93.1%和87.1%,初治MDR-TB患者不良反应发生率略高于复治患者;将4个研究地区按全球基金和非全球基金地区分类,非全球基金地区天津市不良反应发生率为96.0%,略高于濮阳市、大庆市、衢州市3个全球基金地区不良反应发生率。上述各组类别不良反应发生率经χ2检验,差异均无统计学意义(表2)。
二、不良反应发生的频次、对治疗的影响及发生的时间
1.不良反应发生的频次:全部患者共计发生147例次不良反应,不良反应发生频次位列前三位的依次为胃肠道反应、肝脏毒性和关节痛或肌肉痛,分别占35.4%、17.7%和13.6%;出现肾脏毒性、甲状腺功能紊乱和电解质紊乱的患者例数较少,均为1.4%;只有1例患者出现了视神经炎,占0.7%(表3)。
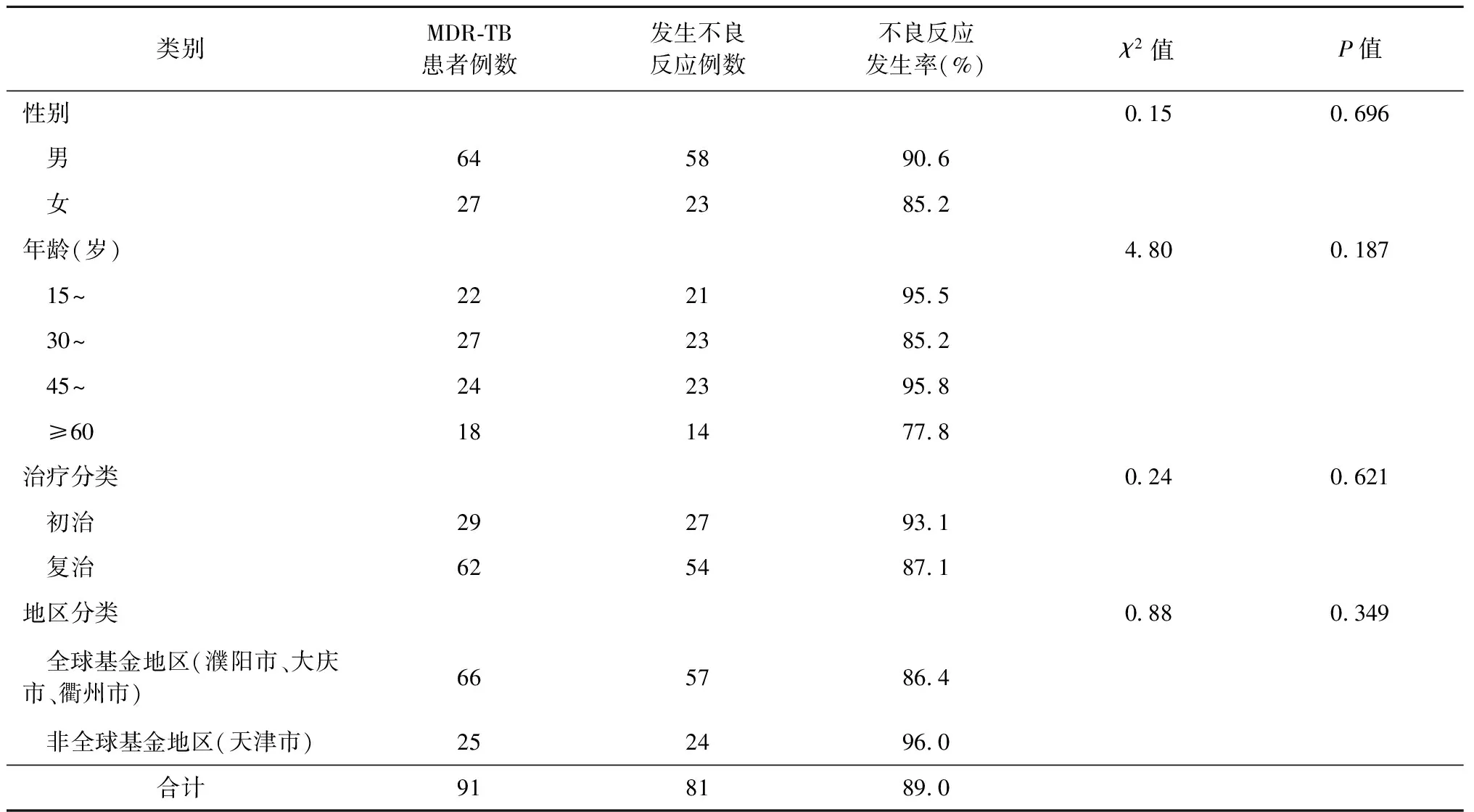
表2 不同类别在91例MDR-TB患者的不良反应发生情况
2.不良反应对治疗的影响:发生不良反应后,55.1%(81/147)的不良反应不需要处理,可以继续维持原治疗方案;32.7%(48/147)患者的不良反应需要更换或停用导致不良反应的药物;4.8%(7/147)患者的不良反应出现后调整了药物使用剂量;尚有7.5%(11/147)患者的不良反应导致中断了治疗;导致患者中断治疗较多的不良反应是超敏反应和胃肠道反应,没有患者因电解质紊乱、肾脏毒性、血液系统损害、甲状腺功能紊乱、耳毒性和前庭功能障碍,以及关节痛或肌肉痛而停止治疗者(表3)。
3.不良反应发生的时间:MDR-TB患者治疗期间发生不良反应的时间中位数为66 d,最短发生在治疗当日,最长的发生在治疗第313 d。其中49.0%(72/147)患者不良反应发生在治疗1个月内,76.2%(112/147)患者发生在治疗2个月内;不良反应发生时间较早的有视神经炎、电解质紊乱及胃肠道反应,出现的时间中位数分别为10 d、21 d和31 d;发生不良反应最晚的为甲状腺功能紊乱和血液系统损害等,出现的时间中位数分别为225 d和125 d(表3)。
4. 停用引起不良反应的主要药物:48例次患者因不良反应停用或更换了抗结核药物,其中18例次(37.5%)停用或更换了PAS,其次是Z和Pto,分别为12例(25.0%)和11例(22.9%);因使用卡那霉素注射剂(Km)出现不良反应而停止用药的患者例次最少,仅3例(6.3%)(表4)。
讨 论
一、MDR-TB患者不良反应发生率较高,因不良反应中断抗结核治疗较少
本研究有89.0%的MDR-TB患者在治疗过程中发生不同程度的不良反应。我国其他研究及各国报道的MDR-TB不良反应发生率不尽相同,徐彩红等[5]报道治疗MDR-TB患者过程中不良反应的发生率为48.1%;俄罗斯和印度学者报道治疗MDR-TB患者过程中不良反应发生率分别为73.3%和58%[6-7];而秘鲁学者报道的不良反应发生率高达100%[8]。尽管本研究不良反应发生率较高,但经过对症处理后,55.1%的不良反应不需特殊处理,可以维持原治疗方案,只有7.5%的患者最终因不良反应退出。因不良反应更换或停用可能引起不良反应的药物的比例较高,达到了32.7%。研究表明,完全因不良反应中断抗结核者治疗少见[2],本研究也支持此观点;Nathanson等[9]报道因严重不良反应而完全终止治疗者仅占2%。因此提示,尽管MDR-TB患者出现不良反应较常见,但只要及时监测不良反应的发生,掌握好更换或停用药物及中断治疗的标准和指征,不会导致严重不良反应,不要随意停药或中断治疗。
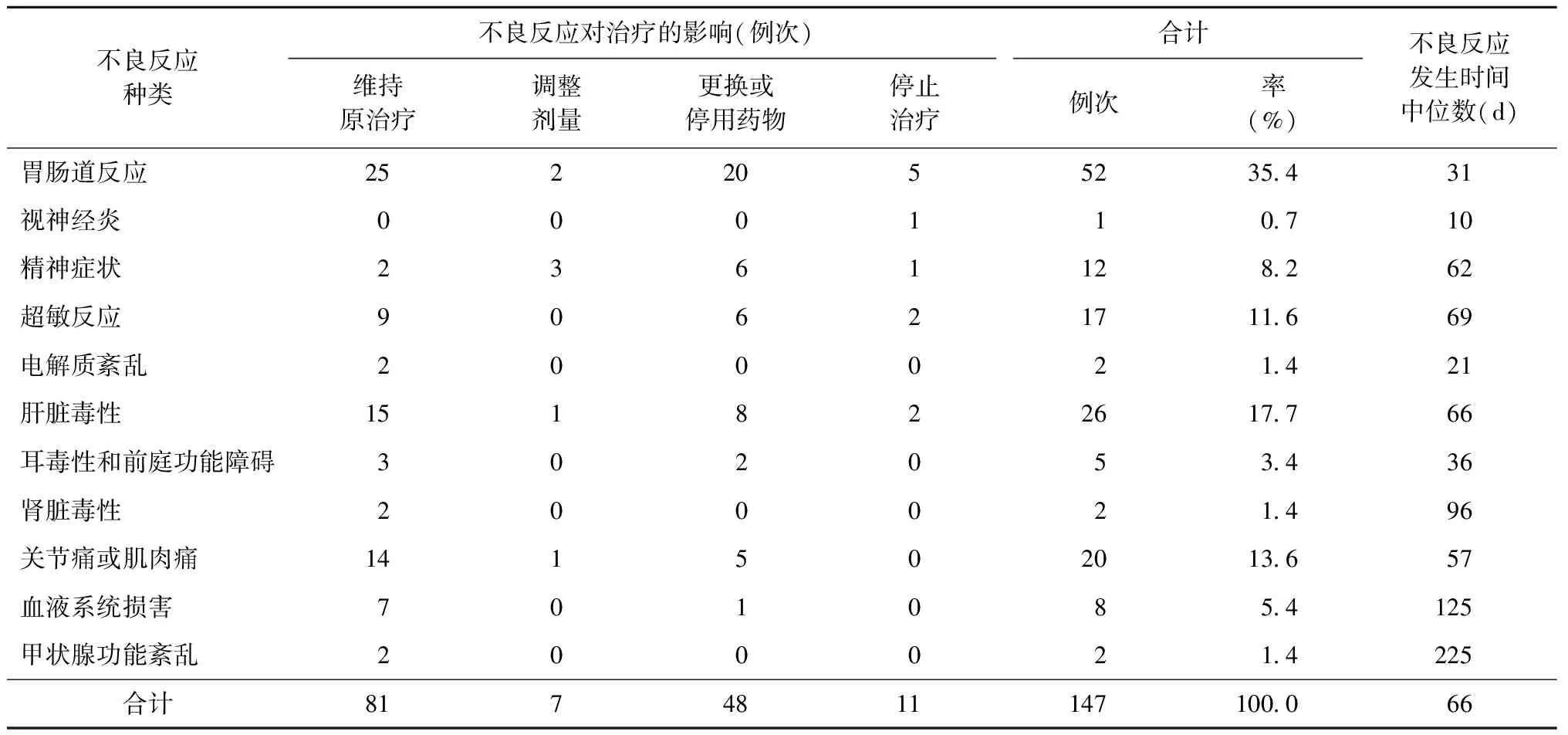
表3 不同种类不良反应在91例MDR-TB患者中的发生情况
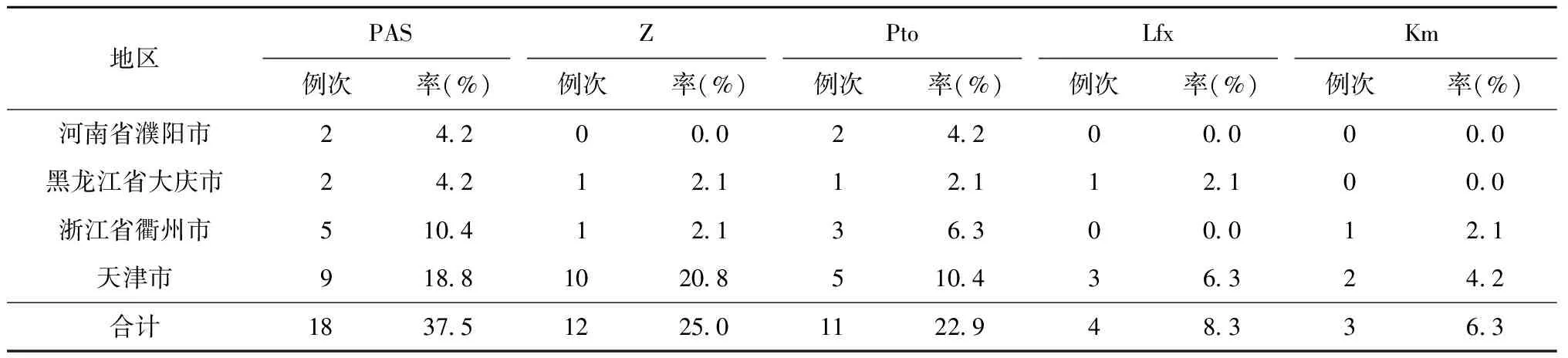
表4 4个研究地区48例次患者因不良反应停用或更换抗结核药物情况
二、不良反应的种类较多
本研究中出现的不良反应种类较多,也比较分散,发生频率最高的是胃肠道反应,视神经炎发生率最低,只发现1例。各国同类研究中不良反应发生率皆以胃肠道反应最为多见[6-11],本研究也以胃肠道不良反应出现频次最高,为35.4%(以例次计);与Nathanson等[9]报道恶心、呕吐发生率为32.8%相近;在俄罗斯的研究中不良反应发生率最高为胃肠道,占75.4%[6];Van Deun等[11]报道(孟加拉国)不良反应中胃肠道反应占了71%。
值得注意的是关节痛或肌肉痛的发生率在本研究中位列第3位(13.6%),但并未有患者因此中断治疗。俄罗斯报道其发生率为47.1%[6],在全部不良反应中列第2位。提示应及时监测患者尿酸水平,一旦患者出现关节痛等要及时给予对症治疗,不要轻易停药。
精神症状的不良反应发生情况也不容忽视,在研究地区数据收集阶段尚未有环丝氨酸的应用,精神症状的发生率已达8.2%。因此在患者治疗过程中心理支持十分重要。
三、不良反应绝大部分出现在治疗2个月内
不良反应出现的时间长短不一,最快者在治疗当日即开始出现不良反应,最长者达到313 d,可以看出不良反应的发生会伴随患者治疗的整个疗程。在治疗初期,视神经炎、胃肠道反应和电解质紊乱较早出现,随着治疗时间的推移,肾脏、血液和甲状腺功能紊乱开始出现。但76.2%例次的不良反应发生在开始治疗的2个月内,因此提示MDR-TB患者如能在开始治疗2个月内选择住院治疗,可以及时监测和处理不良反应,会在很大程度上减少因不良反应导致的停药或停止治疗的概率。
四、因不良反应停止或更换的药物
在全部不良反应中,停用药物最多的是PAS和Z,37.5%例次停用或更换的药物为PAS, Km注射剂和Lfx需要停用或更换药物的较少。提示应指导患者PAS正确的服药方法,可以减少不良反应的发生。二线注射剂和氟喹诺酮类药物为MDR-TB患者治疗的核心药物[2,12],其合理应用是MDR-TB患者治疗成功的关键。本研究显示较少的患者因应用二线注射剂和氟喹诺酮类药物出现不良反应导致停药,因此应鼓励患者坚持此2种药物的使用,以保证治疗效果。
五、进口和国产抗结核药物不良反应发生情况无差异
因目前进口和国产抗结核药物在剂型和剂量上均有不同,本研究曾试图比较两者不良反应发生的差异。研究发现,应用进口抗结核药物的3个全球基金项目地区与应用国产抗结核药物非全球基金项目地区的天津市发生不良反应率在本研究中差异无统计学意义(χ2=0.88,P=0.349)(表2)。因本研究中使用国产二线抗结核药物的只有1个地区,应用国产和进口抗结核药物发生的不良反应发生情况是否有差异还有待进一步观察。
六、小结
通过本研究提示,MDR-TB患者治疗时尽管不良反应发生率较高,发生的种类较多,持续时间也较长,但只有极少数患者需要停止治疗。面对这些不良反应的发生,只要及时监测,掌握好不良反应处理原则,不良反应处理均能达到较好的效果。不要轻易停药,尤其是停止二线注射剂和氟喹诺酮类这2种MDR-TB治疗的核心药物,甚至停止治疗,以减少因不良反应对治疗的影响,保证患者的治疗效果。
[1] 屠德华.正确认识和处理抗结核药品的不良反应. 中国防痨杂志,2008,30(4):269-270.
[2] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis: emergency update 2008. Geneva:WHO,2008:50-73.
[3] World Health Organization. Global tuberculosis report 2013[DB/OL]. Geneva:World Health Organization,2013(2013-10-28)[2014-05-10]. http://www.who.int/tb/publications/global_report/en/.
[4] 王宇. 耐多药肺结核防治管理工作方案. 北京:军事医学科学出版社,2012:16-17.
[5] 徐彩红,李仁忠,阮云洲,等.耐多药肺结核治疗不良反应发生情况分析.中华疾病控制杂志,2013,17(3):243-245.
[6] Shin SS, Pasechnikov AD, Gelmanova IY, et al. Adverse reactions among patients being treated for MDR-TB in Tomsk, Russia. Int J Tuberc Lung Dis, 2007, 11(12):1314-1320.
[7] Joseph P,Desai VB,Mohan NS, et al. Outcome of standar-dized treatment for patients with MDR-TB from Tamil Nadu, India. Indian J Med Res,2011,133(5):529-534.
[8] Furin JJ, Mitnick CD, Shin SS, et al. Occurrence of serious adverse effects in patients receiving community-based therapy for multidrug-resistant tuberculosis. Int J Tuberc Lung Dis, 2001, 5(7):648-655.
[9] Nathanson E,Gupta R, Huamani P, et al.Adverse events in the treatment of multidrug-resistant tuberculosis:results from the DOTS-Plus initiative. Int J Tuberc Lung Dis,2004,8(11):1382-1384.
[10] Törün T, Güngör G, Ozmen I, et al. Side effects associated with the treatment of multidrug-resistant tuberculosis. Int J Tuberc Lung Dis,2005,9(12): 1373-1377.
[11] Van Deun A, Salim MA, Das AP, et al. Results of a standardised regimen for multidrug-resistant tuberculosis in Bangladesh. Int J Tuberc Lung Dis, 2004, 8(5):560-567.
[12] 中国防痨协会.耐药结核病化学治疗指南(2009).中国防痨杂志,2010,32(4):181-198.

