抗菌肽HBD基因工程表达的研究近况
万 健,吴三桥,赵冠杰,陈 琛
抗菌肽(Antimicrobial Peptides,AMPs) 是生物体特定基因编码产生的一类小分子多肽,具有抵抗外界微生物侵害的作用,是生物天然免疫系统中的一个重要组成部分,与传统抗生素相比,抗菌肽具有分子量小、热稳定好、水溶性好、强碱性、广谱抗菌和作用机制独特等特点[1-4]。20世纪80年代瑞典科学家HG.Boman等从惜古比天蚕(Hyatophoracecropia)蛹中诱导分离出第一个抗菌肽—天蚕素(cecropin)[5]。此后,人们相继从细菌、真菌、两栖类、昆虫、高等植物、哺乳动物乃至人类中发现了2000多种抗菌肽。抗菌肽可以根据以上来源分类,也可以根据结构将其分为5种:(1)α-螺旋结构抗菌肽,如Cecropin A、Magainin;(2)β-折叠肽,如Tachyplesins;(3)富含半胱氨酸的抗菌肽,如HNP-1,-2和-3;(4) 富含特殊氨基酸的抗菌肽,该类型抗菌肽通常带有一个或多个占主导地位的氨基酸, 如从牛的嗜中性细胞里分离出来的Indolicidin 由13个氨基酸残基组成, 其中就含有5个色氨酸;(5)含稀有被修饰氨基酸的抗菌肽。人抗菌肽分为三类:防御素(defensins)、cathelicidins和富组蛋白(histatins)。
防御素是广泛存在于动植物体内的一类具有抵抗外界微生物侵袭的碱性阳离子抗菌肽。人防御素根据其一级结构及所含3对二硫键连接方式的不同可分为α-防御素(human α-defensin, or human defensin neutrophil peptide,HNP )和β-防御素。α-防御素的3对二硫键以1-6,2-4,3-5的方式连接,β-防御素的3对二硫键以1-5,2-4,3-6的方式连接(如表1),它们具有相似的3条反向平行β-片层结构。Bensch等[6]于1995年首次从肾功能衰竭病人的血液透析液中分离出HBD-1并获得其氨基酸序列,随后其他5个 HBD被相继发现,目前人β-防御素家族有6个主要成员,HBD-1~6。β-防御素主要表达于哺乳动物皮肤和粘膜上皮细胞,是机体抵御外界微生物侵害和参与免疫应答的重要成员,具有极强的抗菌[7]、抗病毒[8-9]、抗肿瘤活性[10]以及免疫学活性[11-13]。本文对HBD的结构、表达部位,原核、真核表达的系统,表达技术和方法进行了综述,以期对人β-防御素及其他抗菌肽的基因工程重组表达提供思路。
1 HBD的结构及表达部位
HBD基因定位于人染色体8p22~p23.1区小于1M的范围内,由2个外显子和1个内含子构成,HBD家族的六个主要成员均位于该区域内。HBD前体由93~95个氨基酸组成,包括信号肽、原片段和成熟肽3部分。在整个氨基酸序列中有2种高度保留的氨基酸,一种是位于N端的甘氨酸(2个),另一种是半胱氨酸(6个),保守的6个半胱氨酸残基配对形成3对二硫键,起稳定结构的作用。二硫键和β-片层结构可以使小分子防御素紧密连结以抵抗蛋白酶水解,即使在富含蛋白的吞噬溶酶体环境中仍能保持其活性,这也是防御素不同于其他抗微生物肽的主要原因。
HBD-1由36个氨基酸组成,约7.0 kb,其第一个外显子编码信号肽和原片段,第二个外显子编码成熟肽,在上皮细胞中是生理性表达。HBD-2由41个氨基酸组成,其中第一个外显子编码5′端非翻译区信号肽区和前导肽区,第二个外显子编码部分前导肽成熟肽和3′端非翻译区,HBD-2的各种生物活性都是由成熟肽来执行完成。HBD-2主要表达在受感染刺激后的皮肤和黏膜组织中,是一种诱导型防御素,在感染、炎症等状态下表达明显增强[14],且研究人员发现NF-kB与这种诱导表达密切相关[15-16]。HBD-3主要表达于皮肤、口腔粘膜和扁桃体中,在呼吸道、生殖道上皮细胞和胎盘中亦有表达,可被TNF-a、IL-1β-、TGF、γ-干扰素等诱导表达。与HBD-1表达方式不同,HBD-2和HBD-3主要为诱导型表达。HBD-4在睾丸中高表达,在胃窦中也有较高表达,而在甲状腺、肺、肾、子官和中性粒细胞中微表达。HBD-5和HBD-6仅在附睾细胞中有所表达。

表1 人β-防御素氨基酸序列、分子结构
2 HBD的基因工程重组及表达
由于抗生素的长期广泛使用,使得许多细菌都产生了耐药性,比较突出的有2010年新德里“超级细菌”事件[17]。与传统抗菌药物相比,人β-防御素热稳定性好,高效广谱抗菌,具有极强的抗菌、抗病毒、抗肿瘤活性以及免疫学活性[18],病原菌对其不易产生耐药性。HBD的这些优点决定其在医药卫生、畜牧业、食品工业等方面将发挥极为重要的作用。怎样大量获得HBD就成了首要问题,目前获取的主要途径有3条:从细胞或体液中提取、化学合成、基因工程表达。HBD在组织中的表达量极少,纯化工艺的难度与成本也较高,化学合成价格昂贵,且体内蛋白质往往需要翻译后的修饰才具有活性。因此,通过基因工程手段大量生产HBD成为一条非常有效的途径。
2.1HBD的原核表达 在各种表达系统中,原核表达系统是最早采用的,也是目前掌握最为成熟的表达系统。大肠杆菌具有培养条件简单、生长繁殖快、安全性好、可高表达外源基因等优点,是目前HBD表达采用最多的表达系统。
由于人β-防御素是一类阳离子小分子多肽,表达过程中极易在蛋白酶的作用下降解,而且对宿主细胞有细胞毒性作用,易造成宿主细胞的死亡。通常HBD基因在大肠杆菌中采用融合型表达,即目的蛋白HBD与一段融合标签序列如组氨酸标签蛋白(His-Tag)、硫氧化还原蛋白 (Thioredoxin, Trx)、类弹性蛋白(Elastin-like peptide, ELP)、小分子泛素样修饰蛋白(Small ubiquitin-related modifier, SUMO)等融合表达,这些融合标签可增加HBD mRNA的稳定性,为进一步的蛋白分离、纯化、检测等提供便利,同时也可以有效的抑制宿主蛋白酶的降解活性,其作用类似于天然抗菌肽产生过程中能够保护抗菌肽及宿主菌的前导肽部分[19]。HBD在大肠杆菌中的表达,国内外开展了大量的研究,具体见表2。
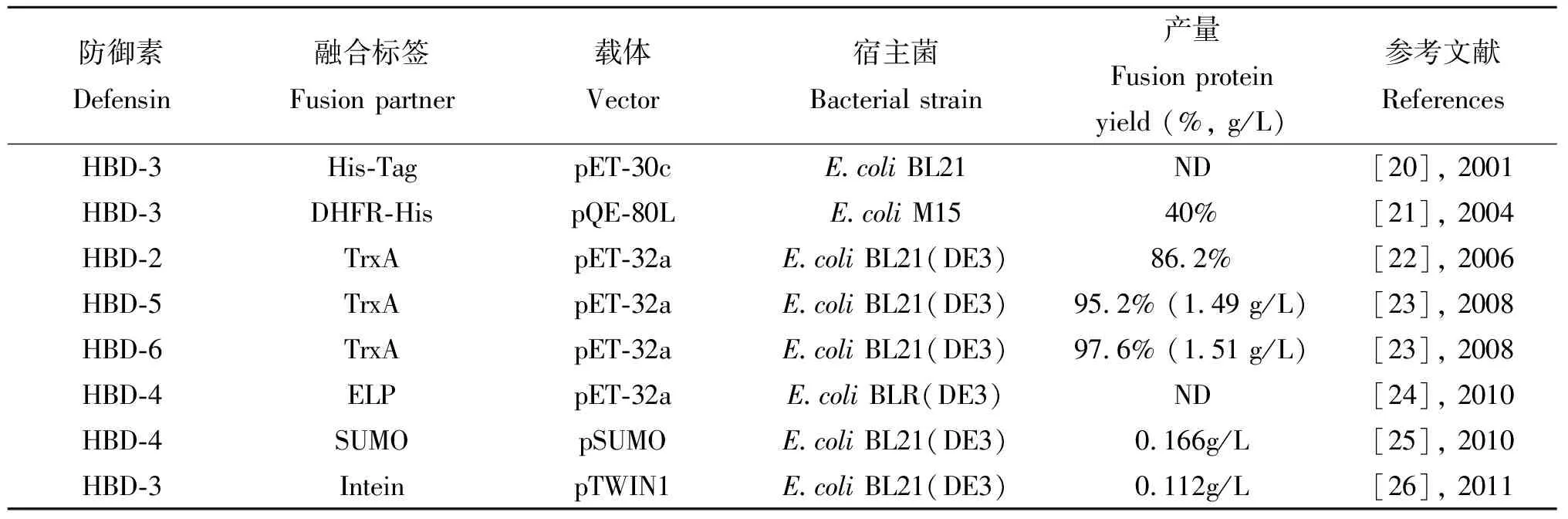
表2 人β-防御素在大肠杆菌中的表达
注:DHFR=运载蛋白 Intein=内含肽 ND= Not Determined
自Harder等[20]在原核细胞中采用了融合表达的方式,首次实现了HBD-3的体外表达以来,随着对基因表达调控机制的深入研究,及其在生物技术领域的发展,原核表达系统在功能上得到了进一步的改善,HBD的原核表达经历了一个从无到有,表达量由低到高,抗菌活性由弱到强,纯化过程由复杂到简便的历程。
虽然HBD在大肠杆菌中表达有诸多优点,但大肠杆菌表达体系与其他体系相比也有一些缺点:高效表达但易形成包涵体,不能进行翻译后的加工修饰,如糖基化、磷酸化、酰基化以及二硫键的形成等,而且E.coli表达的蛋白还会保留它们氨基末端的甲硫氨酸,这会影响到目的蛋白的稳定性,并产生免疫原性。最近有研究发现共表达折叠酶或者分子伴侣在一定程度上能克服包涵体的形成,分子伴侣本身不是功能蛋白的组成部分,但是能够阻止分子间和分子内不正确的折叠,进而帮助蛋白质折叠成正确的构象。Li等[25]利用小分子泛素蛋白(SUMO)融合表达系统,在大肠杆菌中表达HBD4-SUMO融合蛋白,可以促进HBD4的正确折叠,增加表达量,而且融合蛋白经过SUMO酶酶切去除SUMO标签后,N端没有残留氨基酸,得到纯度较高的目的蛋白。
最近几年,研究人员重点研究将目的蛋白与一些具有活性的小蛋白融合,进而促进目的蛋白在E.coil中的表达[27],或者通过改造现有的表达载体,构建各种促溶标签载体,进而使在E.coli中以包涵体形式表达的蛋白以可溶性形式表达[28]。
2.2HBD的真核表达 真核表达系统包括酵母表达系统、哺乳动物细胞表达系统、昆虫表达系统等。酵母是一类低等真核生物,它既有类似原核生物的生长特性,又有一般真核生物基因表达调控机制及对表达产物的加工修饰和分泌能力,并且不会产生内毒素,是目前HBD表达应用最为普遍的真核表达系统之一。
2.2.1在酵母中表达 酵母表达系统中以毕赤酵母表达系统最为人熟知,具有操作简单、高水平分泌表达外源蛋白、便于纯化、利于大规模工业化生产等优点。毕赤酵母可以在以甲醇为唯一碳源和能源的培养基上生长,而且甲醇能够诱导毕赤酵母合成大量的乙醇氧化酶(AOX1)。AOX1是强启动子,能够高水平诱导表达外源基因。酵母带有α分泌信号,可引导外源蛋白的分泌,减轻宿主细胞的代谢负荷以及宿主细胞蛋白水解酶的降解作用。近年来研究者开展了HBD在酵母中的表达,具体见表3。

表3 人β-防御素在酵母中的表达
虽然HBD在毕赤酵母中表达相对于在大肠杆菌表达起步比较晚,但毕赤酵母表达系统具有其他表达系统所无法比拟的优点: 如对营养要求低,易于高密度发酵,自身分泌的背景蛋白少,因酵母是真核生物,安全性高,提供翻译后加工和分泌的环境,不会形成包涵体,易于进行分离提纯等,使得人β-防御素在毕赤酵母中表达的研究有很大的优势。
尽管如此,HBD在毕赤酵母中表达也存在着一些问题,比如毕赤酵母的糖基化程度比哺乳动物偏大,而且糖基化途径与人不同,从而影响了HBD蛋白的结构和功能。过去的20多年里,有很多研究人员致力于毕赤酵母的N-糖基化改造过程中。王越等[34]成功构建了敲除α-1, 6-甘露糖转移酶基因的巴斯德毕赤酵母,和野生型相比,大大降低了蛋白质的糖基化程度,从而为酵母的糖基化工程提供了基础。另外,信号肽加工不完全以及内部降解等造成表达产物不均一,这在一定程度上限制了毕赤酵母的应用。酵母表面展示技术,利用酵母细胞壁蛋白(α-凝集素)与外源蛋白相融合,融合蛋白表达分泌中由于其糖基化蛋白与细胞壁的共价结合作用,将外源蛋白锚定在细胞壁上[35]。提示,也许以后HBD的表达也能应用这项技术,这样可以减少纯化工艺,提高回收率。
2.2.2在哺乳动物细胞中表达 HBD在哺乳动物细胞中表达也有报道,彭巍等[36]将HBD-3 cDNA插入到真核表达载体pEGFP-C1 中,构建乳腺特异性表达载体pEBCD,脂质体介导法转染奶牛胎儿成纤维细胞G418,之后检测到重组HBD-3蛋白可以在奶牛乳腺上皮细胞组织特异性表达。王慧等[37]构建HBD-2真核表达重组质粒pcDNA3.1-zeo(+)-HBD-2,经脂质体介导转染293细胞,RT-PCR检测到HBD-2基因成功转染293细胞,表达的HBD-2有较强的抗金黄色葡萄球菌活性。曹玉红等分别将重组真核表达载体pcDNA3.1+/HBD4和pEGFP-N2/HBD4导入COS-7和HEK293细胞,均检测到了HBD4蛋白的表达,并具有较强的杀菌作用[38-39]。
与其它真核细胞表达系统相比,HBD目的基因在哺乳动物细胞中表达与天然的结构、糖基化类型和方式几乎完全相同,并且在蛋白合成起始信号、加工、分泌等方面具有独特优势。但是哺乳动物表达系统成本相对较高,技术复杂,表达过程中存在着潜在的动物病毒的污染[40]。
3 展 望
人β-防御素因具有广谱的抗菌活性,在抵御病原微生物的侵袭、参与免疫反应中发挥着重要的作用,且病原菌对其不易产生耐药性,因此它们有望成为一类新型的抗菌药物,从而解决细菌的耐药性和抗菌素的毒副作用等问题。通过基因工程技术制备HBD的研究,将会为今后制备类似药物奠定基础,指导抗微生物肽类药物设计和开发,为其提供理想的分子设计骨架和模板。新型、高效、低毒、广谱的HBD将会在医药卫生、农业、食品、饲料添加剂、动植物抗病转基因等领域发挥出重要的作用,对人类的健康和生活产生深远的影响。
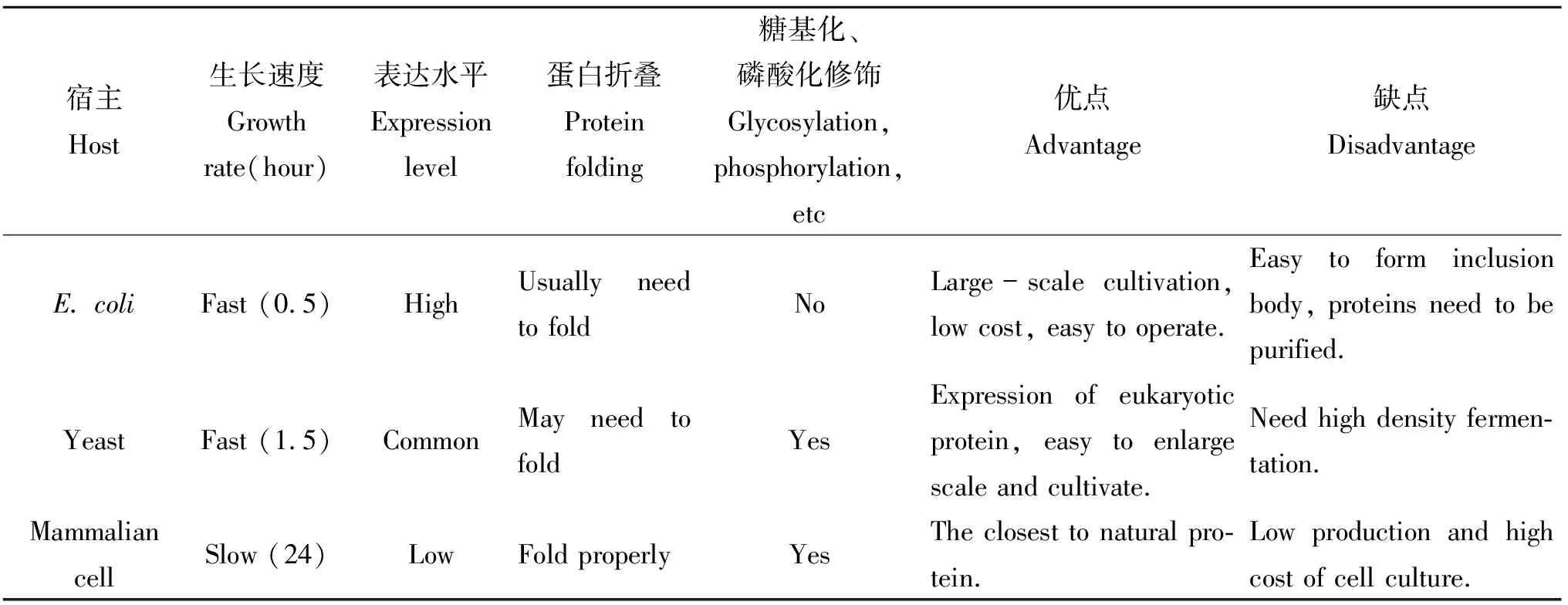
表4 各种表达系统比较
表4对HBD基因工程重组表达系统进行了比较,HBD在大肠杆菌中虽能高效表达但易形成包涵体,且后期分离纯化过程比较繁琐,表达后还需要活化才有生物活性;哺乳动物表达系统成本相对较高,技术复杂,表达过程中存在着潜在的动物病毒的污染;毕赤酵母表达系统因操作简单、高水平分泌表达外源蛋白、便于纯化、利于大规模工业化生产,表达产物HBD有较好的抑菌活性等优点。随着对基因表达调控机制的深入研究及其在生物技术领域的发展,所有的表达系统都可以在功能上有进一步的改善。但是,一些表达系统本身固有的缺陷也不能忽略,因此在选择HBD表达系统时应综合考虑表达水平、表达周期、安全性、蛋白质性质等因素。
参考文献:
[1]Zasloff M. Antimicrobial peptides of multicellular organisms[J]. Nature, 2002, 415(6870):389-395. DOI: 10.1038/415389a
[2]Chen C, Wang XH, Bo XW. Antibacterial peptides of the ovine reproductive tract[J]. Pro Biochem Biophys, 2009, 36(11): 1483-1489. DOI: 10.3724/SP.J.1206.2009.00011 (in Chinese)
陈琛, 王新华, 薄新文. 绵羊生殖道抗菌肽[J]. 生物化学与生物物理进展, 2009, 36(11): 1483-1489. DOI: 10.3724/SP.J.1206.2009.00011
[3]Chen C, Wu SQ, Li XS, et al. Structure, function and molecular design strategies of antibacterial peptide SMAP-29: a review[J]. Chin J Biotech, 2011, 27(6): 846-859. (in Chinese)
陈琛,吴三桥,李新生,等. 抗菌肽SMAP-29结构功能及分子设计策略[J]. 生物工程学报,2011,27(6): 846-859.
[4]Silva NC, Sarmento B, Pintado M. The importance of antimicrobial peptides and their potential for therapeutic use in ophthalmology[J]. Int J Antimicrob Agents, 2013, 41(1): 5-10. DOI: 10.1016/j.ijantimicag.2012.07.020
[5]Steiner H, Hultmark D, Engstrom A, et al. Sequence and specificity of two antibacterial proteins involved in insect immunity[J]. Nature, 1981, 292(5820): 246-248. DOI: 10.1038/292246a0
[6]Bensch KW, Raida M, Magert HJ, et al. HBD-1: a novel beta-defensin from human plasma[J]. FEBS Letters, 1995, 368(2): 331-335. DOI: 10.1016/0014-5793(95)00687-5
[7]Hu QJ, Zuo P, Shao B, et al. Administration of nonviral gene vector encoding rat beta-defensin-2 ameliorates chronicpseudomonasaeruginosalung infection in rats[J]. J Gene Med, 2010, 12(3): 276-286. DOI: 10.1002/jgm.1435
[8]Alfredo GD, Mark KL, Jennifer B, et al. Human beta-defensins induce APOBEC3G expression by interacting with chemokine receptors, protecting highly susceptible cells from HIV infection[J]. Retrovirology, 2012, 9(suppl 1): 8. DOI: 10.1186/1742-4690-9-S1-P8
[9]Corleis B, Gostic WG, Johnson JA, et al. Human intestinal beta defensins inhibit viral replication and are diminished in chronic untreated HIV infection[J]. Retrovirology, 2012, 9(suppl 2): 202. DOI: 10.1186/1742-4690-9-S2-P202
[10]Bullard RS, Gibson W, Bose S K, et al. Functional analysis of the host defense peptide human beta defensin-1: new insight into its potential role in cancer[J]. Mol Immunol, 2008, 45(3): 839-848. DOI: 10.1016/j.molimm.2006.11.026
[11]Francesca M, Sabrina P, Luisa C, et al. Effects on antigen-presenting cells of short-term interaction with the human host defence peptide β-defensin 2[J]. Biochem J, 2011, 436(3): 537-546. DOI: 10.1042/BJ20101977
[12]Fiona S, Sheila W, Li HN, et al. Human β-defensin 3 has immunosuppressive activityinvitroandinvivo[J]. Eur J Immunol, 2010, 40(4): 1073-1078. DOI: 10.1002/eji.200940041
[13]Laura KF, Yvonne KM, Alicia RM, et al. Human beta-defensin 3 induces maturation of human langerhans cell-like dendritic cells: an antimicrobial peptide that functions as an endogenous adjuvant[J]. J Invest Dermatol, 2013, 133(2): 460-468. DOI: 10.1038/jid.2012.319
[14]Hollox EJ. Beta-defensins and crohn's disease: confusion from counting copies[J]. Am J Gastroenterol, 2010, 105(2): 360-362. DOI: 10.1038/ajg.2009.573
[15]Paris S, Wolgin M, Kielbassa AM, et al. Gene expression of human beta-defensins in healthy and inflamed human dental pulps[J]. J Endod, 2009, 35(4): 520-523. DOI: 10.1016/j.joen.2008.12.015
[16]Yoon YM, Lee JY, Yoo D, et al. Bacteroides fragilis enterotoxin induces human beta-defensin-2 expression in intestinal epithelial cells via a mitogen-activated protein kinase/IkB kinase/NF-kB-dependent pathway[J]. Infect Immun, 2010, 78(5): 2024-2033. DOI: 10.1128/IAI.00118-10
[17]Yong D, Toleman MA, Giske CG, et al. Characterization of a new metallo-β-lactamase gene,b1aNDM-1, and a novel erythromycin esterase gene carried on a unique genetic structure inKlebsiellapneumoniaesequence type 14 from India[J]. Antimicrob Agents Chemother, 2009, 53 (12): 5046-5054. DOI: 10.1128/AAC.00774-09
[18]Prado-Montes de Oca E. Human β-defensin 1: A restless warrior against allergies, infections and cancer[J]. Int J Biochem Cell Biol, 2010, 42(6): 800-804. DOI: 10.1016/j.biocel.2010.01.021
[19]Vassilevski AA, Kozlov SA, Grishin EV. Antimicrobial peptide precursor structures suggest effective production strategies[J]. Recent Pat Inflamm Allergy Drug Discov, 2008, 2(1): 58-63. DOI: 10.2174/187221308783399261
[20]Harder J, Bartels J, Christophers E, et al. Isolation and characterization of human beta-defensin-3, a novel human inducible peptide antibiotic[J]. J Bio Chem, 2001, 276(8): 5707-5713. DOI: 10.1074/jbc.M008557200
[21]Chen S, He FT, Dong YL, et al. The cloning, high level expression inEscherichiacoliof human beta-defensin 3 and its antimicrobial activity analysis[J]. Chin J Biotechnol, 2004, 20(4): 490-495. DOI: 10.3321/j.issn:1000-3061.2004.04.004 (in Chinese)
陈姗,何凤田,董燕麟,等. 人β-防御素3融合蛋白在大肠杆菌中的表达、纯化与活性分析[J]. 生物工程学报,2004,20(4): 490-495.DOI: 10.3321/j.issn:1000-3061.2004.04.004
[22]Xu ZN, Peng L, Zhong ZX, et al. High-level expression of a soluble functional antimicrobial peptide, human β-defensin 2 inEscherichiacoli[J]. Biotechnol Prog, 2006, 22(2): 382-386. DOI: 10.1021/bp0502680
[23]Huang L, Ching CB, Jiang RR, et al. Production of bioactive human beta-defensin 5 and 6 inEscherichiacoliby soluble fusion expression[J]. Protein Expr Purif, 2008, 61(2): 168-174. DOI: 10.1016/j.pep.2008.05.016
[24]Shen Y, Ai HX, Song R, et al. Expression and purification of moricin CM4 and human beta-defensins 4 inEscherichiacoliusing a new technology[J]. Microbiol Res, 2010, 165(8): 713-718. DOI: 10.1016/j.micres.2010.01.002
[25]Li JF, Zhang J, Zhang Z, et al. Production of bioactive human beta-defensin-4 inEscherichiacoliusing SUMO fusion partner[J]. Protein J, 2010, 29(5): 314-319. DOI: 10.1007/s10930-010-9254-4
[26]Dong J, Yu HG, Zhang YL, et al. Soluble fusion expression and characterization of human beta-defensin 3 using a novel approach[J]. Protein Pept Lett, 2011, 18(11): 1126-1132. DOI: 10.2174/092986611797201020
[27]Leviatan S, Sawada K, Moriyama Y, et al.Combinatorial method for overexpression of membrane proteins inEscherichiacoli[J]. J Biol Chem, 2010, 285(31): 23548-23556. DOI: 10.1074/jbc.M110.125492
[28]Hu J, Qin HJ, Gao FP, et al.A systematic assessment of mature MBP in membrane protein production: overexpression, membrane targeting and purification[J].Protein Expr Purif, 2011, 80(1): 34-40. DOI: 10.1016/j.pep.2011.06.001
[29]Cipáková I, Hostinová E. Production of the human-beta-defensin usingsaccharomycescerevisiaeas a host[J]. Protein Pept Lett, 2005, 12(6): 551-554. DOI: 10.2174/0929866054395761
[30]ZhaoYH, Huang PL, Xu LX, et al. Expression of human β defensin 3 inpichiapastoris[J]. J Qufu Nor Uni:Nat Sci, 2006, 32(2): 107-111. DOI: 10.3969/j.issn.1001-5337.2006.02.027 (in Chinese)
赵亚华,黄蓬亮,徐来祥,等.人β-防御素3基因在巴斯德毕赤酵母细胞中的表达[J]. 曲阜师范大学学报:自然科学版,2006,32(2):107-111. DOI : 10.3969/j.issn.1001-5337.2006.02.027
[31]Tuo XY. Expression and purification of hBD3-BPI fusion protein inpastorispichayeast system and its bioactivity analysis[D]. Beijing: Chinese PLA Postgraduate Medical School, 2007. (in Chinese)
庹晓晔.hBD3-BPI融合蛋白在巴斯德毕赤酵母系统中的表达及其产物的纯化和生物学活性研究[D]. 北京:中国人民解放军军医进修学院,2007.
[32]Dai J. Study on the activity of human beta-defensin-3 expressing inPichiaPastoris[D]. Guangzhou: Sun Yat-sen University, 2010. (in Chinese)
代娟. 人β-防御素-3在毕赤酵母中的分泌表达及活性研究[D]. 广州:中山大学,2010.
[33]Bao YY, Zhao QJ, Xu TT, et al. Optimization mosaic gene of human β defensin 3 and plant des-pGlu1-Brazzein and its expression inPichiapastoris[J]. J Henan Agri Uni, 2013, 47(1): 77-82. DOI: 10.3969/j.issn.1000-2340.2013.01.015 (in Chinese)
暴元元,赵青君,徐婷婷,等. 人β-防御素3与植物巴西甜蛋白基因密码子的优化及其在毕氏酵母中的表达[J]. 河南农业大学学报,2013,47(1):77-82. DOI: 10.3969/j.issn.1000-2340.2013.01.015
[34]Wang Y, Gong X, Chang SH, et al. Apichiapastoriswith α-1, 6-mannosyltranferases deletion and its use in Expression of HSA/GM-CSF Chimera[J]. Chin J Biotechnol, 2007, 23(5): 907-914. DOI: 10.3969/j.issn.1001-5337.2006.02.027 (in Chinese)
王越,巩新,唱韶红,等. α-1,6-甘露糖转移酶基因敲除的毕赤酵母菌株构建及其用于融合蛋白HSA/GM-CSF表达的研究[J]. 生物工程学报,2007,23(5):907-914. DOI : 10.3969/j.issn.1001-5337.2006.02.027
[35]Han SY, Li HZ, Jin Z, et al. Yeast cell surface display and its application of enzymatic synthesis in non-aqueous phase[J]. Chin J Biotechnol, 2009, 25(12): 1784-1788. DOI: 10.3321/j.issn:1000-3061.2009.12.005 (in Chinese)
韩双艳,李华珍,金子,等. 酵母细胞表面展示技术及其在非水相酶催化合成中的应用[J]. 生物工程学报,2009,25(12):1784-1788. DOI: 10.3321/j.issn:1000-3061.2009.12.005
[36]Peng W, Lan ZG, Ma JJ, et al. Construction of HBD 3 gene mammary-specific expression vector and eukaryotic expression[J]. Chin J Biotechnol, 2009, 25(7): 968-974. DOI: 10.3321/j.issn:1000-3061.2009.07.002 (in Chinese)
彭巍,兰志刚,马晶晶,等. HBD-3基因的乳腺特异性表达载体的构建及真核表达[J]. 生物工程学报,2009,25(7):968-974. DOI: 10.3321/j.issn:1000-3061.2009.07.002
[37]Wang H, Dong PR, Zhou Y. Antimicrobial activities of the culture supernatant of 293 cells transfected with recombinant HBD-2 gene eukyriotic expressive plasmid [J]. J Biomed Eng, 2009, 2:371-373. DOI:10.3321/j.issn:1001-5515.2009.02.031 (in Chinese)
王慧,董碧蓉,周焱. 重组人源β-防御素-2基因真核表达质粒转染293细胞的表达产物抗菌活性的研究[J]. 生物医学工程学杂志,2009,26(2):371-373. DOI:10.3321/j.issn:1001-5515.2009.02.031
[38]Cao YH, Cheng SQ, Zhang GY, et al. Eukaryotic expression of human β defensin 4 gene in cos-7 cells[J]. Med J West China, 2012, 24(9): 1668-1670.DOI: 10.3969/j.issn.1672-3511.2012.09.007 (in Chinese)
曹玉红,张光运,成胜权,等. 人β-防御素4基因在COS-7细胞中的转染表达[J]. 西部医学,2012,24(9):1668-1670. DOI: 10.3969/j.issn.1672-3511.2012.09.007
[39]Cao YH, Cheng SQ, Zhang GY, et al. Eukaryotic expression of human β defensin 4 gene in HEK293 cells[J]. J Med Postgra, 2012, 25(10): 1020-1023. DOI: 10.3969/j.issn.1008-8199.2012.10.004 (in Chinese)
曹玉红,成胜权,张光运,等. 人β-防御素4基因在HEK293细胞中的转染表达[J]. 医学研究生学报,2012,25(10):1020-1023. DOI: 10.3969/j.issn.1008-8199.2012.10.004
[40]Fan CY, Feng LX, Fan JL, et al. Recent advances on the expression systems for recombinant protein production[J]. Biotechnology, 2012, 22(2): 76-80. DOI: 10.3969/j.issn.1004-311X.2012.02.049 (in Chinese)
范翠英,冯利兴,樊金玲,等. 重组蛋白表达系统的研究进展[J]. 生物技术,2012,22(2):76-80. DOI: 10.3969/j.issn.1004-311X.2012.02.049

