鸡致病性大肠杆菌qseC基因缺失突变株的构建及其生物学特性
元雪浈,刘淑莉,李新生,张素梅,商艳红,胡功政,杜向党
鸡大肠杆菌病是引起养鸡业的主要细菌性疾病之一,临床主要表现为鸡急性败血症,气囊炎,肝周炎,心包炎,卵黄性腹膜炎,肿头综合征,输卵管炎等[1-2]。不同日龄的鸡均可感染,其发病率高、死亡率高,给养鸡业造成了巨大的经济损失。
鸡大肠杆菌病的病原为鸡致病性大肠杆菌(Avian pathogenicEscherichiacoli, APEC),APEC在发挥致病性过程中,首先粘附于鸡粘膜上皮细胞表面,在此过程中APEC I型菌毛粘附素发挥重要作用。I型菌毛粘附素是APEC的重要致病因子,95%以上的APEC均可表达I型菌毛,通过与鸡气管粘膜上皮细胞表面的甘露糖受体特异性结合,使APEC粘附在上皮细胞上,不易被机体清除,在APEC侵染鸡体发挥致病性过程中起关键作用。I型菌毛的合成和表达需要多种基因的共同参与,主要包括fimA、fimG、fimH、fimF、fimB、fimE、fimC、fimD和fimI[3]。其中,fimA、fimG、fimH和fimF编码I型菌毛主要结构亚蛋白FimA和次要亚蛋白FimG,FimH和FimF。fimH是I型菌毛和甘露糖受体蛋白结合的粘附素;fimB和fimE编码的FimB和FimE共同调控FimA表达的相变开关;fimC和fimD编码的FimC和FimD蛋白与菌毛的生物合成以及在菌体上的定位密切相关[4]。
近年来,在肠出血性大肠杆菌(EnterohemorrhagicEscherichiacoli, EHEC)中发现QseBC双组份调控系统,参与大肠杆菌的毒力调控。由qseC基因编码的信号受体蛋白QseC感应环境中的信号分子自诱导物(Autoinducer-3, AI-3) /肾上腺素(Epinephrine, Epi)/去甲肾上腺素(Norepinephrine, NE),通过转录调节因子QseB调控细菌毒力基因的表达,在细菌致病过程中扮演着重要角色[5-6]。然而,QseBC双组份调控系统是否参与APEC毒力因子的调控目前还未见报道。因此,本研究拟构建鸡致病性大肠杆菌qseC基因缺失突变株(WTΔqseC)及其互补株(WTΔqseC:pBADqseC),并通过测定WTΔqseC和WTΔqseC:pBADqseC的生长、粘附能力和致病因子I型菌毛粘附素相关基因表达量的变化来探讨qseC基因缺失对其生物学特性的影响。
1 材料和方法
1.1材料
1.1.1菌株、质粒及引物 本试验所用的菌株、质粒和引物分别见表1和表2,引物由上海生工生物工程公司和大连宝生物公司合成。

表1 本试验所用菌株和质粒
1.1.2主要试剂和仪器 Taq酶、dNTP、T4连接酶、DNA限制性内切酶、Primestar高保真酶均购自大连TaKaRa公司;琼脂糖凝胶 DNA 回收纯化试剂盒、质粒小提试剂盒、细菌RNA提取试剂盒购自北京天根生化科技有限公司;Southern杂交试剂盒购自德国Roche公司;反转录试剂盒购自大连TaKaRa公司;荧光定量试剂盒购自美国Promega公司;2720型PCR仪,美国ABI公司;UV-2000紫外分析仪,天能科技(上海)有限公司;电穿孔仪购自Biorad公司;荧光定量PCR仪,德国Eppendorf公司。
1.2WTΔqseC的构建与鉴定
1.2.1构建重组敲除质粒pT-zeocin-qseC分别以细菌基因组和pGAPZαA质粒为模板,以qseC-F/qseC-R和zeocin-F∕zeocin-R为引物进行PCR,扩增产物分别和pGEM-TREasy Vector连接,在DNA限制性内切酶和T4连接酶的作用下得到pT-zeocin-qseC重组质粒。

表2 本试验中所用的引物
1.2.2WTΔqseC的筛选与鉴定 酶切pT-zeocin-qseC重组质粒得到qseC上-zeocin-qseC下片段,制备WT感受态。将qseC上-zeocin-qseC下片段电转化入WT感受态中,在50 mg/L博来霉素LB琼脂平板中37 ℃培养,初步筛选。进一步用zeocin2-F/zeocin2-R引物进行PCR,并测序确证突变菌株WTΔqseC。
进一步鉴定突变株,分别提取WT和WTΔqseC的基因组DNA,以zeocin基因的PCR产物作阳性对照,进行Southern blot杂交分析。以地高辛标记的zeocin抗性基因为探针,将各基因组DNA经EcoRI酶切过夜,1.0%琼脂糖凝胶电泳分离各片段,转膜,80 ℃烘烤2 h固定。预杂交、洗膜及显影均严格按照说明书上操作步骤进行。
1.3WTΔqseC:pBADqseC的构建与鉴定
1.3.1构建重组表达载体pBAD/gIIIC-qseC以野生菌基因组为模板,mq-qseC-F/mq-qseC-R为引物进行PCR,扩增产物和pBAD/gIIIC连接,在DNA限制性内切酶和T4连接酶的作用下得到pBAD/gIIIC-qseC重组表达载体。进一步用PCR、酶切和测序确证重组表达载体pBAD/gIIIC-qseC。
1.3.2WTΔqseC:pBADqseC的筛选与鉴定 制备WTΔqseC感受态,将pBAD/gIIIC-qseC重组载体电转化入WTΔqseC感受态,用耐药平板初步筛选。进一步用mq-qseC-F/mq-qseC-R引物进行PCR,并且提取转化菌总蛋白,跑SDS凝胶电泳,使用考马斯亮蓝染色,以确证互补菌株WTΔqseC:pBADqseC。
1.4生物学特性
1.4.1体外试验 取相同数量的WT、WTΔqseC和WTΔqseC:pBADqseC分别接种于LB液体培养基,37 ℃恒温振荡培养至三者的OD600值均为0.5,各取0.5 mL加入新鲜的LB液体培养基中,37 ℃恒温振荡培养,每间隔0.5 h测取OD600值,重复试验3次,取平均值,并绘制生长曲线。
为测定qseC对大肠杆菌生长能力的影响,进行体外竞争实验。细菌培养同1.4.1,分别将WT与WTΔqseC, WT与WTΔqseC:pBADqseC以1∶1的比例混匀,接种于LB肉汤37 ℃静置培养4 h。培养完成后,经105稀释,分别用有zeocin抗性的和无抗性的LB固体培养基进行细菌计数,37 ℃培养18 h,观察结果,按照参考文献计算竞争指数(Competition index, CI)值[7]。
1.4.2血凝试验 本试验采用豚鼠红细胞,按照文献的方法,进行血凝实验(Hemagglutination, HA),测定WTΔqseC和WTΔqseC:pBADqseCI型菌毛粘附能力的变化[8]。
1.4.3荧光定量PCR 为了进一步验证WTΔqseC和WTΔqseC:pBADqseCI型菌毛相关基因表达量的变化,提取WT、 WTΔqseC和WTΔqseC:pBADqseC的总RNA,测定其浓度和含量,并反转录为cDNA,以I型菌毛相关基因为模板设计引物fimA-F/fimA-R,fimD-F/fimD-R,fimF-F/fimF-R,fimH-F/fimH-R 和fimG-F/fimG-R, 以大肠杆菌管家基因gapA为内参基因进行荧光定量PCR。采用2-ΔΔCt法进行数据分析,细菌总RNA提取,反转录反应和荧光定量PCR均严格按照试剂盒说明书操作。
2 结 果
2.1WTΔqseC的构建与鉴定
2.1.1重组敲除质粒pT-zeocin-qseC的鉴定 pT-zeocin-qseC质粒的PCR扩增产物(1.8 kb)、pT-qseC质粒的PCR扩增产物(1.6 kb)及其酶切鉴定分别见图1和图2,条带大小与预期符合。

图1qseC上-zeocin-qseC下片段的PCR扩增电泳图(a)和T-qseC质粒和T-zeocin-qseC质粒的EcoRI酶切鉴定(b)
Fig.1ElectrophoresismapforPCRamplificationofqseCup-zeocin-qseCdownfragment(a)andEcoRIdigestionidentificationofT-qseCplasmidandT-zeocin-qseCplasmid(b)
M: DNA marker; 1, 2: pT-zeocin-qseCplasmid;
3: T-qseCplasmid.
2.1.2WTΔqseC的PCR、Southern杂交及测序鉴定 提取WTΔqseC基因组,以zeocin2-F/zeocin2-R为引物,PCR扩增zeocin基因,与预期大小一致(图略),PCR测序正确。
使用地高辛标记的zeocin抗性基因作为探针,WTΔqseC显示阳性,WT显示阴性,与预期相符,见图2。
2.2WTΔqseC:pBADqseC的构建与鉴定
2.2.1重组表达载体pBAD/gIII-qseC的鉴定 重组表达载体pBAD/gIII-qseC的PCR扩增产物(图略)及其酶切鉴定见图3,条带大小与预期符合,PCR测序正确。

图2WT和WTΔqseC基因组酶切图谱(A)及Southern杂交图谱(B)
Fig.2GenomeDNAofWTandWTΔqseCdigestedbyEcoRI(A)andSouthernblotusingzeocingeneasprobe(B)
M: DS5000 DNA marker; 1: Positive control;
2: Genome DNA of WTΔqseCdigested byEcoRI;
3: Genome DNA of WT genome DNA byEcoRI.

图3pBAD/gIII-qseC质粒的NcoI和PstI酶切鉴定
Fig.3TheelectrophoresismapforNcoIandPstIdigestionidentificationofpBAD/gIII-qseCplasmid
M: DS5000 DNA marker; 1: pBAD/gIII-qseC;
2: pBAD/gIII-qseCdigested byNcoI andPstI.
2.2.2WTΔqseC:pBADqseC的筛选与鉴定 提取WTΔqseC:pBADqseC质粒,用mq-qseC-F/mq-qseC-R为引物进行PCR,条带与预期相符合(图略);制备WTΔqseC:pBADqseC蛋白样品,跑电泳,条带与预期相符合。
2.3生物学特性
2.3.1体外生长试验 WT、WTΔqseC和WTΔqseC:pBADqseC的生长曲线见图4,突变株WTΔqseC在各个时间段的平均OD600值相对于野生株WT均较低,说明WTΔqseC生长相对缓慢,互补株WTΔqseC:pBADqseC的生长曲线介于两者之间,说明WTΔqseC:pBADqseC的生长速度有所提高。
体外竞争试验获得CI1=0.67,说明 WTΔqseC在体外的生长能力被轻度致弱,CI2=1.14,说明WTΔqseC:pBADqseC在体外的生长能力恢复至野生株水平。

图4WTΔqseC、WTΔqseC:pBADqseC和WT的生长曲线
Fig.4GrowthcurvesofWTΔqseC,WTΔqseC:pBADqseCandWT
2.3.2血凝试验 HA试验中,WT、WTΔqseC和WTΔqseC:pBADqseC的平均滴度分别为1.6、0.8和1.66,统计分析显示WT和WTΔqseC差异显著(P<0.05),WT和WTΔqseC:pBADqseC差异不显著(P>0.05)。说明WTΔqseCI型菌毛粘附能力下降, WTΔqseC:pBADqseC的粘附能力恢复。
2.3.3荧光定量PCR 本试验提取WT 总RNA 的A260/A280为2.02,浓度为129.4 ng/μL;提取WTΔqseC总RNA的A260/A280为1.86,浓度为127.5 ng/μL;提取WTΔqseC:pBADqseC总RNA的A260/A280为2.1,浓度为552.2 ng/μL。荧光定量PCR结果见图5(图中为ΔΔCt值的标准偏差)。通过组内重复可以得出,每个组内的Ct值具有很高的可重复性,说明试验结果准确可信;熔解曲线表明荧光定量PCR扩增产物解链温度稳定,扩增产物单一,引物设计合理,没有非特异性产物,试验结果准确。
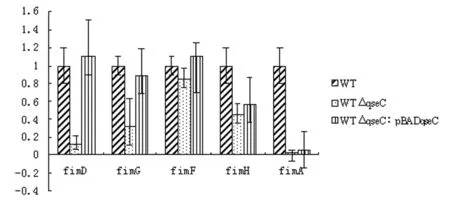
图5I型菌毛相关基因相对表达量变化
Fig.5RelativefoldchangeoffimD,fimG,fimF,fimH,andfimAinWTΔqseCandWTΔqseC:pBADqseCcomparedwithWT
3 讨 论
近年来,鸡大肠杆菌病已经上升为养鸡业中最主要的一种细菌性疾病之一。其血清型众多、耐药状况复杂,给其防控带来了巨大困难和挑战。
病原菌双组份调控系统参与众多病原菌的毒力调控。因此,深入认识病原菌双组分调控系统可为病原菌的致病性干扰提供新型思路与策略[9]。QseBC双组份调控系统目前已发现广泛存在于革兰氏阴性细菌(如大肠杆菌、伤寒沙门氏菌、爱德华氏菌等)中,其与病原菌的致病性调控密切相关[5,10-11]。
在肠出血性大肠杆菌EHEC中,QseC可感应 AI-3、Epi和NE信号分子[6,12],发生自磷酸化,随后将QseB磷酸化,磷酸化的QseB同鞭毛调节器flhDC基因启动子结合,通过调控鞭毛调节器FlhDC的表达,调控鞭毛生物合成,增加菌群运动力,从而增加细菌对宿主的感染能力。此外,QseC还可通过对KdpE和QseF两种转录调控因子磷酸化作用以及qseEF基因转录的调控,间接调控肠细胞擦抹基因座(LEE)内编码的ler基因、编码III型分泌系统效应蛋白的espFu基因和LEE基因座的转录,调控粘附抹平损伤(Attaching and effacing, AE)的形成和志贺毒素的产生。研究表明,在qseC基因缺失突变株中,不能激活上述毒力基因表达。在兔感染模型中,qseC基因缺失突变株的感染能力显著下降[13,16]。
尿道大肠杆菌(UropathogenicEscherichiacoli, UPEC)是引起尿道感染的主要病原菌,通过定植和侵袭膀胱细胞感染宿主。依靠I型菌毛粘附素定植于宿主膀胱细胞上皮,以胞内细菌群落(intracellular bacterial communities,IBCs)实现对宿主的感染。在UPEC中,QseC通过对QseB的磷酸化作用调控UPEC毒力相关基因的表达;当qseC基因缺失时,非QseC途径磷酸化的QseB,抑制包括鞭毛相关基因、I型菌毛相关基因、卷曲菌毛相关基因和S菌毛相关基因等在内的毒力相关基因表达,使细菌毒力减弱。试验表明,qseC基因缺失UPEC 的IBC形成量减少,感染小鼠能力减弱[6,17]。
为了研究QseC对鸡致病性大肠杆菌毒力的调控作用,我们成功地构建了鸡致病性大肠杆菌qseC基因缺失突变株。试验表明,qseC基因缺失会引起鸡致病性大肠杆菌生长能力减弱,粘附能力下降,I型菌毛相关基因表达量下降。这些初步研究为鸡大肠杆菌病的防控提供了重要的思路。
鉴于以QseC为靶标的小分子化合物已取得了积极的进展[9],我们期待QseBC双组份调控系统在众多病原毒力调控中发挥的作用得到越来越清楚的阐明。
参考文献:
[1]Gao S, Liu XF, Zhang RK, et al. The isolation and identification of pathogenicEscherichiacoliisolaes of chicken origin from some region in China[J]. Chin J Anim Vet Med, 1999, 30(2): 164-171. (in Chinese)
高崧, 刘秀梵, 张如宽, 等. 我国部分地区禽病原性大肠杆菌的分离与鉴定[J]. 畜牧兽医学报, 1999, 30(2):164-171.
[2]Zhang JL, Wang SS. Study on the control effects of Chinese Herbal Medicine on Colibacilosis in broilers by artificial infection[J]. J Anhui Agr, 2008, 36(18): 7646-7647. (in Chinese)
张敬礼, 王双山.中草药对人工感染肉仔鸡大肠杆菌病的防治效果研究[J].安徽农业科学,2008,36(18):7646-7647.
[3]Gerlach GF, Clegg S, Allen BL. Identification and characterization of the genes encoding the type 3 and type 1 fimbrial adhesins of Klebsiella pneumoniae[J]. J Bacteriol, 1989, 171(3): 1262-1270.
[4]He SF. Construction of the type I fimbriae fimH deletion mutant form avian pathogenicEscherichiacoliand some related biological funtion[D]. Jiangsu: Yangzhou University, 2008. (in Chinese)
何素芬. 禽致病性大肠杆菌I型菌毛fimH基因缺失突变株的构建及其相关功能性分析[D].江苏:扬州大学, 2008.
[5]Sperandio V, Torres AG, Kaper JB. Quorum sensing Escherichia coli regulators B and C (QseBC): a novel two-component regulatory system involved in the regulation of flagella and motility by quorum sensing inE.coli[J]. Mol Microbiol, 2002, 43(3): 809-821.
[6]Clarke MB, Hughes DT, Zhu C, et al. The QseC sensor kinase: a bacterial adrenergic receptor[J]. Proc Natl Acad Sci U S A, 2006, 103(27): 10420-10425.
[7]Dozois CM, Fairbrother JM, Harel J, et al. Pap-and pil-related DNA sequences and other virulence determinants associated withEscherichiacoliisolated from septicemic chickens and turkeys[J]. Infect Immun, 1992, 60(7): 2648-2656.
[8]Hadjifrangiskou M, Kostakioti M, Chen SL, et al. A central metabolic circuit controlled by QseC in pathogenicEscherichiacoli[J]. Mol Microbiol, 2011, 80(6): 1516-1529. DOI: 10.1111/j. 1365-2958. 2011.07660.x
[9]Rasko DA, Moreira CG, Li de R, et al. Targeting QseC signaling and virulence for antibiotic development[J]. Science, 2008, 321(5892): 1078-1080. DOI: 10.1126/science.1160354
[10]Bearson BL, Bearson SM, Lee IS, et al. TheSalmonellaentericaserovar Typhimurium QseB response regulator negatively regulates bacterial motility and swine colonization in the absence of the QseC sensor kinase[J]. Microb Pathog, 2010, 48(6): 214-219. DOI: 10.1016/j.micpath.2010.03.005
[11]Wang Q, Yang M, Xiao J, et al. Genome sequence of the versatile fish pathogenEdwardsiellatardaprovides insights into its adaptation to broad host ranges and intracellular niches[J]. PLoS One, 2009, 4(10): e7646. DOI: 10.1371/journal.pone.0007646
[12]Sperandio V, Torres AG, Jarvis B, et al. Bacteria-host communication: the language of hormones[J]. Proc Natl Acad Sci U S A, 2003, 100(15): 8951-8956.
[13]Hughes DT, Clarke MB, Yamamoto K, et al. The QseC adrenergic signaling cascade in EnterohemorrhagicE.coli(EHEC)[J]. PLoS Pathog, 2009, 5(8): e1000553. DOI: 10.1371/journal.ppat.1000553
[14]Reading NC,Torres AG, Kendall MM, et al. A novel two-component signaling system that activates transcription of an enterohemorrhagicEscherichiacolieffector involved in remodeling of host actin[J]. J Bacteriol, 2007, 189(6): 2468-2476.
[15]Clarke MB, Sperandio V. Transcriptional autoregulation by quorum sensingEscherichiacoliregulators B and C (QseBC) in enterohaemorrhagicE.coli(EHEC)[J]. Mol Microbiol, 2005, 58(2):441-455.
[16]Clarke MB, Sperandio V. Transcriptional regulation of flhDC by QseBC and sigma (FliA) in enterohaemorrhagicEscherichiacoli[J]. Mol Microbiol, 2005, 57(6): 1734-1749.
[17]Kostakioti M, Hadjifrangiskou M, Pinkner JS, et al. QseC-mediated dephosphorylation of QseB is required for expression of genes associated with virulence in uropathogenicEscherichiacoli[J]. Mol Microbiol, 2009, 73(6): 1020-1031. DOI: 10.1111/j.1365-2958.2009.06826.x

