PSGL-1基因敲除小鼠血中MIP-1γ和TNF-α的表达
李江超,周泽启,叶 杰,韩 露,叶宇翔,刘 影,何晓东,陈 卉,袁俏冰,黎 帅,张静丽,王丽京
(广东药学院 血管生物学研究所,广东 广州 510006)
PSGL-1基因敲除小鼠血中MIP-1γ和TNF-α的表达
李江超,周泽启,叶 杰,韩 露,叶宇翔,刘 影,何晓东,陈 卉,袁俏冰,黎 帅,张静丽,王丽京
(广东药学院 血管生物学研究所,广东 广州 510006)
目的研究PSGL-1缺失对遗传基因工程小鼠外周血血常规的影响,并检测外周血中炎症因子IGFBP-6、TNF-α和MIP-1γmRNA表达水平。方法用血常规检测方法检测正常C57/BL/6小鼠和PSGL-1基因缺失的基因工程小鼠(PSGL-1-/-小鼠)的外周血中血常规的差异;其次,提取两种鼠的血液的mRNA,逆转录为cDNA,采用real-time PCR方法,检测C57小鼠与PSGL-1-/-小鼠外周血中炎症因子TNF-α和MIP-1γmRNA的差异。结果与对照组C57小鼠相比,PSGL-1-/-基因工程小鼠在12周龄时外周血中中性粒细胞(*P<0.05)、淋巴细胞(**P<0.01)和白细胞细胞(***P<0.001)总数显著增加炎症因子TNF-α以及MIP-1γ表达增加(P<0.05)。结论PSGL-1的缺失改变了小鼠细胞因子并影响了外周血的血细胞组成,MIP-1γ和TNF-α炎症因子上调,有可能影响了小鼠的免疫功能。
PSGL-1;TNF-α;MIP-1γ,基因工程动物
P-选凝素糖蛋白配体1(P-selectin glycoprotein ligand 1,PSGL-1)是20世纪90年代初期发现的一种黏附分子,具有同源二聚体结构的跨膜糖蛋白,表达于白细胞的膜表面。PSGL-1是P-选凝素的配体,同时也是L-选凝素和E-选凝素的配体,研究表明其在炎症反应中发挥重要作用。在炎症环境中,PSGL-1与P-选凝素的相互作用在白细胞黏附的起始阶段发挥重要作用,促进白细胞与内皮细胞的紧密连接和穿越血管壁到炎症部位[1]。PSGL-1在介导白细胞黏附的同时,也可以作为信号分子转导胞外信号,促进白细胞活化并使其稳定黏附[2]。另外研究表明PSGL-1对T细胞归巢有着显著影响,从而影响T细胞的发育[3]。而最近的报道,PSGL-1表达在转移的前列腺癌细胞上,所以其分子机制和功能有待进一步研究[4]。
遗传基因工程小鼠模型是生命科学研究手段中具人类疾病模拟性的实验模型之一,小鼠是哺乳类实验动物,具有体型小,繁殖力强,饲养成本低,能较好模拟人体等多种优点,所以我们采用PSGL-1敲除的基因工程小鼠,在动物水平验证了PSGL-1对免疫功能得影响,比细胞水平有着显著优势。因为细胞水平无法模拟免疫学的改变。利用基因工程小鼠建立各种肿瘤模型是当今肿瘤学研究的新趋势。基因敲除小鼠模型在肿瘤学研究上具有其它模型无法比拟的优势:在不伴有药物副作用的条件下,基因产物的作用被完全消除[5-6]。
在本研究中,为了进一步了解PSGL-1的作用和功能,我们采用PSGL-1基因工程敲除小鼠,进一步在动物体内了解PSGL-1缺失后对免疫细胞和炎症因子的影响。结果发现,PSGL-1敲除后,小鼠的血常规发生改变,重要的炎症因子TNF-α和趋化因子MIP-1γ显著上升。这些实验结果为进一步研究PSGL-1如何在机体内介导炎症从而发挥作用有着重要意义。
1 材料和方法
1.1 材料
PSGL-1-/-小鼠(B6.Cg-Selplgtm1Fur/J)购买自美国Jackson实验室,SPF环境中饲养扩群。蛋白酶K及dNTP等PCR体系为Sigma公司产品,Trizol购自Invitrogen,PCR引物由Invitrogen公司合成,Taq酶、Tris饱和酚及氯仿、异丙醇为广州康龙公司产品。
1.2 方法
1.2.1 建系及扩群:PSGL-1+/-与同笼PSGL-1+/-小鼠杂交,得到的子代有三种情况PSGL-1+/-、PSGL-1+/+、PSGL-1-/-,经鉴定后得到PSGL-1-/-即目的实验的小鼠,PSGL-1+/+即为正常小鼠(C57小鼠),作为对照,PSGL-1+/-用来繁殖和配种。
1.2.2 PSGL-1-/-基因工程小鼠鉴定:PSGL-1-/-小鼠鉴定引物序列为:野生型:P1:5'-AGC TTC CTT GTG CTG CTG AC-3':P2:5'-TCA AAA TCG TCA TCC CCA AC-3',扩增条带为140bp;PSGL-1基因突变型:P1:5'-TCA AAA TCG TCA TCC CCA AC-3':P2:5-'CCT TCT ATC GCC TTC TTG ACG-3',扩增条带为500bp。PCR反应条件为:94℃预变性5min,94℃/30s、65℃/1min、72℃/1min,35个循环;72℃延伸2min。用1%琼脂糖凝胶电泳分析PCR结果,紫外灯下观察结果并拍照。
1.2.3 外周血血常规的检测:取同批周龄大小的C57、PSGL-1-/-小鼠(11周,雌雄比例均衡),每组4只,眼眶取血,检测外周血中变化情况,采用临床血常规仪器计数各类细胞的百分比和绝对值。
1.2.4 荧光定量PCR:对上述分组小鼠,眼眶取血法取C57、PSGL-1-/-,500μL血中加入1mL Trizol,12 000r/min,4℃离心10min;吸取上清液至一新的EP管中,静置5min,使之充分裂解;加入200μL氯仿,剧烈震荡15s,然后放置3min;13 400r/min,4℃离心15min,离完后分为3层,取最上层(中间一层为蛋白)至一新的EP管中,加入等体积异丙醇,颠倒数次,室温沉淀10min;13 400r/min,4℃离心10min,弃上清液;加入75%乙醇(DEPC水溶解),颠倒数次混匀;8 300r/min,4℃5min,弃上清液,小心吸尽液体(此时可以看到白色沉淀即为RNA);RNA略干后加入20μL DEPC水。用TaKaRa公司的逆转录试剂盒逆转录成cDNA,用得到cDNA进行real-time PCR,(Tiangen kit货号FP205)95℃预变性15min,94℃/10min、60℃/32s,反应40个循环,融解曲线分析引物特异性,Ct值标准化后计算相对拷贝数。
2 结果
2.1 PSGL-1基因繁殖和鉴定
根据PCR后电泳条带结果,可以区分出条带为500bp的为PSGL-1基因突变的小鼠,即PSGL-1-/-小鼠,如图1第二泳道(从左向右)即是;PCR扩增条带为500bp和140bp为杂合子PSGL-1+/-,图1中第一泳道即是,野生型PCR扩增产物条带为140bp。其中长度约500 bp的条带为PSGL-1基因突变的小鼠特有的条带;140bp的条带为正常小鼠以及PSGL-1基因突变的杂合小鼠都应该具有的条带。

注:Marker:DNA marker 2000。图1 鉴别PSGL-1缺失的基因小鼠Note:Marker:DNA marker 2000.Fig.1 Identification of the PSGL-1-/-mice
2.2 PSGL-1基因工程小鼠中外周血常规异常
取C57小鼠和PSGL-1-/-小鼠的外周血进行血常规检验,与正常小鼠对比,结果发现PSGL-1-/-外周血中中性粒细胞(P<0.05)、淋巴细胞(P<0.01)和白细胞细胞总数显著增加(P<0.001)(图2),在本实验中BASO为噬碱细胞绝对值、EO为噬酸细胞绝对值、LYMPH为淋巴细胞绝对值、MONO为单核细胞绝对值、NEUT为分叶细胞(中性粒细胞)绝对值、WBC为白细胞绝对值。嗜酸性细胞和单核细胞数量的绝对值有差异趋势,但是没有统计意义(P>0.05)(图2)。
2.3 MIP-1γ和IGFBP-6 mRNA水平显著上调
上述结果提示淋巴细胞等细胞数量绝对值增加,TNF-α是重要的炎症因子,而IGFBP-6和MIP-1γ在我们以前的蛋白芯片结果提示上调,而这些炎症因子对淋巴细胞和中性粒细胞以及碱性淋巴细胞调节有着重要意义,所以我们对IGFBP-6,MIP-1γ和TNFα mRNA水平进行检测。提取两种鼠的血液得到总mRNA,获得cDNA,进行real-time PCR检测,结果如图所示(图3)小鼠血液中IGFBP-6、TNF-α、MIP-1γ均以GAPDH为内参,结果显示TNF-α(P<0.01)、MIP-1γ升高(P<0.05)(图3)。

图2 PSGL-1基因工程小鼠中外周血中血细胞变化情况Fig.2 Changes of blood cell counts in peripheral blood of the PSGL-1 knockout mice
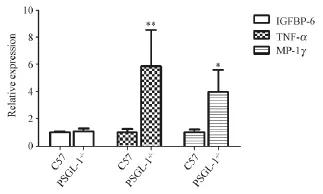
图3 相关炎症细胞因子的检测Fig.3 The relative expression of cytokine factors in peripheral blood
3 讨论
PSGL-1主要表达在白细胞上,其配基是 P-selectin、L-selection及E-selection,它是一种I型跨膜糖蛋白[7]。介导白细胞在内皮上粘附、聚集及活化并释放炎症递质,参与炎症过程,也存在白细胞粘附、活化的反馈机制[8-10]。静息的血小板和内皮细胞很少表达P-选择素,在凝血酶、组胺、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素1β(interferon-1β,IL-1β)、脂多糖(lipopolysacchride,LPS)、氧自由基、补体C5a、高血糖等剌激下,发生脱颗粒反应,颗粒膜与细胞膜迅速融合,可使已储存的P-选择素于数分钟内在细胞表面表达,从而介导白细胞的俘获,顺血流方向沿内皮细胞表面向损伤部位滚动,这是白细胞牢固粘附和移行外渗的最初亦是最关键的阶段。另外,PSGL-1还可能与胸腺的内皮细胞结合,影响T细胞的定位和T细胞在胸腺内的发育。最近的报道,一些白血病肿瘤细胞表达PSGL-1,而且最近报道PSGL-1表达在肿瘤细胞有助于前列腺癌的转移。
我们的研究提示PSGL-1缺失后,影响了外周血的改变,淋巴细胞和中性粒细胞等增加,我们推测可能PSGL-1影响了白细胞的发育或者影响了白细胞的迁移,其不能趋化到其他器官,导致血液中白细胞增加,另外,我们还检测到CD3下调(未展示),而外周血中总淋巴细胞是显著升高的,淋巴细胞还包括NK细胞,B淋巴细胞等,另外,血常规仪原理是根据血细胞非传导的性质和引起的电阻变化进行检测为基础所进行血细胞计数和体积测定。而流式细胞的检测原理基于正电或负电的液滴通过高压偏转板时发生向阴极或向阳极的偏转,从而达到了分类收集细胞的目的。
进一步的mRNA水平检测,也证实PSGL-1缺失的基因工程小鼠中MIP-1γ的变化和TNFα表达发生改变,而NCBI生物信息学提示MIP-1γ主要表达在髓细胞和单核细胞,从外周血中的变化(图2)也证实了PSGL-1可能影响了髓细胞的分化或其它信号通路,大量研究的证明PSGL-1影响了炎症的发生和免疫的稳态调控[1]。但是PSGL-1如何影响MIP-1γ的变化还不是很清楚,需要我们更进一步的探索。
肿瘤坏死因子-α最初发现抑制肿瘤的生长以及可以诱导小鼠内皮细胞P选凝素的表达,是一种涉及到系统性炎症的细胞因子。主要由巨噬细胞分泌,其它类型的细胞也能产生。肿瘤坏死因子α的主要作用是调节免疫细胞的功能。作为一种内源性致热原,它能够促使发热,引起细胞凋亡,通过诱导产生IL-1和IL-6,引发炎症,或阻止肿瘤发生和病毒复制。但是,当机体中TNF-α超过一定量时,TNF-α与其他多种炎性因子一起,反而能促进癌症的发生发展及产生多种病理性损伤[11-14]。而本研究结果证实PSGL-1的缺失会使TNF-α升高,文献报道,Wnt途径参与白细胞在炎症中的反应,如调节单核细胞向内皮细胞的迁移作用[15]。上述结果提示PSGL-1的缺失可能与炎症的发生和发展有关系。
综上所述,PSGL-1作为白细胞上的膜蛋白,参与白细胞的活化、胞内信号转导,从而参与了炎症的形成和发展。我们以前发现PSGL-1缺失的肠道肿瘤恶化加剧,其PSGL-1通过炎症促进肿瘤发展的机制有待深入研究。
[1]Carlow DA,Gossens K,Naus S,et al.PSGL-1 function in immunity and steady state homeostasis[J].Immunol Rev,2009,230(1):75-96.
[2]Wang HB,Wang JT,Zhang L,et al.P-selectin primes leukocyte integrin activation during inflammation[J].Nat Immunol,2007,8(8):882-92.
[3]Sultana DA,Zhang SL,Todd SP,et al.Expression of functional P-selectin glycoprotein ligand 1 on hematopoietic progenitors is developmentally regulated[J].J Immunol,2012,188(9):4385-4393.
[4]Dimitroff CJ,Descheny L,Trujillo N,et al.Identification of Leukocyte E-selectin ligands,P-selectin glycoprotein ligand-1 and E-selectin ligand-1,on human metastatic prostate tumor cells[J].Cancer Res,2005,65(13):5750-5760.
[5]Blake JA,Richardson JE,Bult CJ,et al.MGD:the Mouse Genome Database[J].Nucl Acids Res,2003,31(1):193-195.
[6]Bult CJ,Blake JA,Richardson JE,et al.The Mouse Genome Database(MGD):integrating biology with the genome[J].Nucl Acids Res,2004,32:D476-D481.
[7]Raes G,Ghassabeh GH,Brys L,et al.The metastatic T-cell hybridoma antigen/P-selectin glycoprotein ligand 1 is required for hematogenous metastasis of lymphomas[J].Int J Cancer,2007,121(12):2646-2652.
[8]Goda MA,Tanaka T,Monden M,et al.Characterization of an apparently conserved epitope in E-and P-selectin identified by dual-specific monoclonal antibodies.Eur J Immonol,1999,29:1551-1560.
[9]Vadas MA,Harlan J.The selection[M].New York,Harward,1997:1.
[10]Gout S,Huot J.Role of cancer microenvironment in metastasis:focus on colon cancer[J].Cancer Microenviron,2008,1(1):69-83.
[11]Roy Fleischmann R,Yocum D.Does safety make a difference in selecting the right TNF antagonist[J].Arthritis Res Ther.2004;6(Suppl 2):S12-S18.
[12]Egberts JH,Cloosters V,Noack A,et al.Anti-tumor necrosis factor therapy inhibits pancreatic tumor growth and metastasis[J].Cancer Res,2008,68(5):1443-50
[13]Stathopoulos GT,Kollintza A,Moschos C,et al.Tumor necrosis factor-α promotes malignant pleural effusion[J].Cancer Res,2007,67(20):9825-34
[14]Scott KA,Moore RJ,Arnott CH,et al.An anti-tumor necrosis factor-α antibody inhibits the development of experimental skin tumors[J].Mol Cancer Ther,2003,2(5):445-451.
[15]Lara T,Joachim S,Anke S,et al.Wnt signaling regulates transendothelial migration of monocytes[J].J Leuk Biol.2006,79:1306-1313.
Expression of MIP-1γ and TNF-α in PSGL-1 knockout mice
LI Jiang-chao,ZHOU Ze-qi,YE Jie,HAN Lu,YE Yu-xiang,LIU Ying,HE Xiao-dong,CHEN Hui,YUAN Qiao-bing,LI Shuai,ZHANG Jing-li,WANG Li-jing
(Institute of Vascular Biology,Guangdong Pharmaceutical University,Guangzhou 510006,China)
ObjectiveTo investigate the effect of loss of PSGL-1 on routine blood test results in PSGL-1 knockout(PSGL-1-/-)mice,and to detect the expression levels of cytokines IGFBP-6,TNF-α and MIP-1γ mRNA in their peripheral blood.MethodsTo detect the differences in routine blood test results of normal C57/BL/6 mice and PSGL-1-/-mice.To prepare cDNA from isolated blood mRNA,and to analyze the differences in expression of cytokines TNF-α and MIP-1γ mRNA in peripheral blood of the C57 mice(control)and PSGL-1-/-mice by real-time PCR.Results Compared with the C57 control mice,the 12-week old PSGL-1-/-mice showed significantly increased neutrophils(P<0.05),lymphocytes(P<0.01)and total leukocyte counts(P<0.001),and increased expression levels of TNF-α and MIP-1γ mRNA in the peripheral blood(P<0.05).ConclusionsOur findings suggest that the loss of PSGL-1 changes the cell counts of peripheral blood in mice.The up-regulation of cytokines MIP-1γ and TNF-α may influence the immune function of the mice.
PSGL-1;TNF-α;MIP-1γ;Transgenic mice;Peripheral blood
王丽京(1962-),女,博士,教授,研究方向:肿瘤分子生物学。E-mail:wanglijing62@163.com。
R33
A
1671-7856(2014)02-0070-04
10.3969.j.issn.1671.7856.2014.002.015
国家自然基金(31271455)广东省医学科研基金(A2013312)。
李江超,男,博士。E-mail:lijiangchao@gdpu.edu.cn。
2013-12-11
技术方法

