一种新型的生物素诱导的真核基因表达调控系统的建立
叶玲玲,刘红,李世崇,王启伟,蓝三春,陈昭烈
1 军事医学科学院生物工程研究所,北京 100071
2 军事医学科学院附属医院,北京 100071
生物技术与方法
一种新型的生物素诱导的真核基因表达调控系统的建立
叶玲玲1,刘红1,李世崇1,王启伟1,蓝三春2,陈昭烈1
1 军事医学科学院生物工程研究所,北京 100071
2 军事医学科学院附属医院,北京 100071
为建立一种适用于生物制药工业和基因治疗领域的基因表达调控系统,构建枯草芽胞杆菌生物素连接酶 (BS-BirA) 与转录激活结构域的融合蛋白,以其表达载体为调控载体;在弱化的CMV启动子上游连接BS-BirA特异的操纵子序列,获得响应载体,从而得到响应于生物素的真核基因表达调控系统BS-Biotin-On。以增强型绿色荧光蛋白 (EGFP) 为报告基因对该系统进行考察,结果表明,与现有的类似调控系统相比,该系统具有良好的诱导率;可通过调节培养体系中生物素的浓度,实现对目的基因表达水平快速、较高效的调节。上述结果表明,BS-Biotin-On系统可能为外源基因的调控表达提供新的选择。
生物素,基因表达调控系统,诱导率,BirA
基因表达调控系统能够在时空上控制目的基因的表达,现已广泛应用于基础研究和应用研究中,例如,功能基因组研究、组织工程、系统生物学、药物研发、基因治疗、生物药物生产和功能材料的设计等[1-4]。最初开发的适用于哺乳动物细胞的基因表达调控系统采用的诱导剂分子包括抗生素、免疫抑制剂或激素及其衍生物等,这些调控系统在培养体系和转基因动物中表现出了良好的调控效果,但是由于具有生理活性的诱导剂分子具有某些临床副作用,使得它们在基因治疗和生物药物生产中的应用受到了限制[5-6]。新一代的基因表达调控系统使用临床上惰性的诱导剂分子,如精氨酸、维生素H (亦称生物素) 以及光等[7-9]。
Weber等于2007年和2009年分别建立和改造了以生物素为诱导剂的外源基因表达调控系统,以SEAP为报告基因验证了该系统在HEK293-T、COS-7和CHO-K1细胞中的有效性[10-11]。该系统的一个重要组分是来自大肠杆菌Escherichia coli的生物素连接酶BirA,BirA是一种双功能蛋白,既可在ATP存在下激活生物素并将其与特异的蛋白受体相连接,又可与激活的生物素相结合,发生构象变化,进而结合位于生物素合成操作元上游的特异操纵子序列 (OBirA),抑制该操作元的转录。该系统利用BirA的上述特性,将其与单纯疱疹病毒转录激活因子VP16的转录激活结构域构建成人工转录激活因子BirA-VP16,获得的BirA-VP16可在生物素存在下,结合并激活含有3个拷贝OBirA的最小CMV启动子,从而激活下游目的基因的转录 (图1)。受上述研究启发,本文用来自于枯草芽胞杆菌Bacillus subtilis的生物素连接酶 (BS-BirA) 代替来自大肠杆菌的生物素连接酶 (EC-BirA),构建了BS-BirA与VP16核心转录激活结构域的4个串联重复 (称VP4) 的融合转录激活因子,建立了一种新型的以生物素为诱导剂的基因表达调控系统,实现了对目的基因表达水平快速、较高效的调节,为外源基因的调控表达提供了新的选择。

图1 生物素诱导表达系统示意图[11]Fig. 1 Molecular configuration of the biotin-inducible expression system[11].
1 材料与方法
1.1 菌株、质粒和细胞
大肠杆菌DH5α菌株购自盖宁公司;TOP10感受态细胞购自北京全式金生物技术有限公司;枯草芽胞杆菌BS168基因组由本所熊向华惠赠;pcDNA3.1(+) 载体购自Invitrogen公司;pTRE载体由本所熊福银惠赠;人工转录因子GVP4表达载体pc-Hy-GVP4、组成型表达EGFP基因的pc-Hy-E载体均为本课题组构建;HEK293细胞购自Gibco公司。
1.2 培养基和试剂
常规DMEM/F12 (1∶1) 液体培养基和无生物素DMEM/F12 (1∶1) [称为DF (Bio-)] 液体培养基购自北京钮因华信公司;新生牛血清(NBS) 购自兰州民海生物工程有限公司;脂质体Lipofectamine 2000购自Invitrogen公司;G418和潮霉素B购自Merck公司;Streptavidin agarose购自Novagen公司;生物素 (Biotin) 购自Amresco公司;兔抗GFP多抗购自南京碧云天生物科技有限公司;DNA序列全合成由南京金斯瑞生物科技有限公司完成。
1.3 细胞培养、转染和筛选
HEK293细胞正常贴壁培养于添加5% (V/V) NBS的DMEM/F12 (1∶1) 培养基中,37 ℃,5% CO2。
转染步骤依脂质体说明书、在24孔板中进行,共转染的两种质粒摩尔比为1∶1,每孔总计1 μg,每种转染重复2孔。转染后的细胞用含400 μg/mL G418和300 μg/mL 潮霉素B的筛选培养基进行筛选。
1.4 基于BS-BirA、以生物素为诱导剂的基因表达调控系统BS-Biotin-On的构建
1.4.1 BS-Biotin-On系统调控载体的构建
各引物序列见表1。从BS 168基因组中克隆BS-BirA基因,引物为BS-BirA-5和BS-BirA-3,将BS-BirA与酶切自pc-Hy-GVP4载体的VP4片段进行重叠PCR,引物为BS-BirA-5和VP-3,获得的融合转录激活因子BS-BV连入pcDNA3.1 (+) 载体,得到BS-Biotin-On系统的调控载体pc-BS-BV。

表1 本文中涉及的核苷酸序列Table 1 Nucleotide sequences involved in this article
1.4.2含不同拷贝数操纵子的BS-Biotin-On系统响应载体的构建
通过引物BSOB-5和BSOB-3退火获得BS-BirA特异的操纵子 (BSOB) 片段,自pTRE质粒克隆最小CMV启动子 (PminCMV),引物为minCMV-5和minCMV-3,将BSOB和PminCMV依次连入EGFP表达载体pc-Hy-E野生型CMV启动子的位置,得到含1个拷贝BSOB的BS-Biotin-On系统的响应载体pc-Hy-BSOB-minE。
通过全合成获得4个串联重复的BSOB序列4BSOB (表1),经NruⅠ/MluⅠ酶切后连入同样酶切的pc-Hy-minE载体,得到含4个拷贝BSOB的BS-Biotin-On响应载体,命名为pc-Hy-4BSOB-minE;该载体再分别经Bgl Ⅱ和MfeⅠ酶切后自连,得到含3个和2个拷贝BSOB的BS-Biotin-On响应载体,分别命名为pc-Hy-3BSOB-minE和pc-Hy-2BSOB-minE。
1.4.3基于EC-BirA的EC-Biotin-On系统的构建
从大肠杆菌DH5α中克隆EC-BirA基因,引物为EC-BirA-5和EC-BirA-3,与酶切自pc-Hy-GVP4载体的VP4片段一起连入pcDNA3.1(+) 载体,得到融合转录激活因子EC-BV的表达载体,命名为pc-EC-BV,此为EC-Biotin-On系统的调控载体;EC-BirA特异的操纵子 (ECOB) 序列为:5′-CTAATTGTTAACC TTTGAATATAATTGGTTAACAATTTAG-3′,通过全合成获得3个串联重复的ECOB,5′和3′末端分别为MfeⅠ和MluⅠ酶切位点,双酶切后连入同样酶切的pc-Hy-minE载体,得到响应于生物素的EGFP诱导表达载体pc-Hy-3ECOB-minE,此为EC-Biotin-On系统的响应载体。
1.5 BS-Biotin-On系统的考察和评价
1.5.1 BS-Biotin-On系统与EC-Biotin-On系统诱导率的比较
向NBS中加入0.5% (V/V) 链亲和素琼脂糖珠,室温孵育15 min,用0.22 μm滤膜过滤除去珠子及除菌,得到去除生物素的NBS [称为NBS (Bio-)]。
将pc-BS-BV/pc-Hy-3BSOB-minE和pc-ECBV/pc-Hy-3ECOB-minE分别共转染HEK293细胞,经抗生素筛选获得稳定转染的细胞混合克隆,分别称为HEK-3BSE和HEK-3ECE。将这两种细胞分别接种24孔细胞培养板,待细胞贴壁后,更换为无生物素和含200 μmol/L生物素两种培养基继续培养3 d,借助流式细胞仪检测EGFP荧光强度情况。
1.5.2操纵子数目对BS-Biotin-On系统效果的影响
将pc-BS-BV和含1−4个拷贝BSOB的EGFP诱导表达载体pc-Hy-(1-4)BSOB-minE分别共转染HEK293细胞,经筛选得到混合细胞克隆。以组成型表达EGPF的载体pc-Hy-E和pc-Hy-BSOB-minE载体单转染的细胞分别作为阳性对照和阴性对照,考察无生物素和200 μmol/L生物素两种培养条件下培养3 d后EGFP的相对荧光强度。
1.5.3 Western blotting检测EGFP蛋白表达
Western blotting实验由北京康为世纪生物科技有限公司完成。GFP抗体稀释度为1∶5 000,β-actin抗体稀释度为1∶5 000。
2 结果与分析
2.1 BS-Biotin-On系统的构建
2.1.1 BS-Biotin-On系统调控载体的构建
枯草芽胞杆菌生物素连接酶 (BS-BirA) 基因全长978 bp,克隆自枯草芽胞杆菌BS168基因组 (图2A)。BS-BirA与VP4 (单纯疱疹病毒VP16蛋白核心转录激活结构域的4个串联重复,长度约150 bp,图2B) 经重叠PCR获得融合转录激活因子BS-BV (图2C),BS-BV连入pcDNA3.1(+)载体,得到BS-BV的组成型表达载体pc-BS-BV,为BS-Biotin-On系统的调控载体 (图3A)。
2.1.2含不同拷贝数BSOB的BS-Biotin-On响应载体的构建
将BS-BirA特异的操纵子BSOB片段 (184 bp,全合成获得) 和最小CMV启动子 (PminCMV,约120 bp,图4) 依次连入EGFP组成型表达载体pc-Hy-E,代替其野生型CMV启动子的位置,得到含1个拷贝操纵子的BS-Biotin-On系统响应载体pc-Hy-BSOB-minE (图3B)。

图2 BS-BV融合基因的获得Fig. 2 Procedure to obtain BS-BV fuse-gene. (A) PCR amplification of BS-BirA. 1: DNA marker; 2: PCR product of BS-BirA. (B) Enzyme digestion to obtain VP4 fragment. 1: digestion of pc-Hy-GVP4; 2: DNA marker. (C) Overlapping PCR to obtain BS-BV fuse-gene. 1: PCR product of BS-BV; 2: DNA marker.

图3 BS-Biotin-On系统质粒示意图Fig. 3 Diagrams of plasmids comprised of BS-Biotin-On systems. (A) Regulatory vector. (B) Response vector.
图4 PCR扩增最小CMV启动子Fig. 4 PCR amplification of minimal CMV promoter. 1: DNA marker; 2: PCR product of PminCMV.
通过全合成获得4个串联重复的BSOB序列,连入pc-Hy-minE载体的PminCMV启动子上游 (图5A),得到含4个拷贝BSOB的BS-Biotin-On响应载体pc-Hy-4BSOB-minE;该载体再分别经BglⅡ和MfeⅠ酶切后 (图5B) 自连,得到含3个和2个拷贝BSOB的BS-Biotin-On响应载体pc-Hy-3BSOB-minE和pc-Hy-2BSOB-minE。

图5 含不同数目BSOB的响应载体的构建Fig. 5 Construction of response vectors with different copies of BSOBs. (A) Construction of response vector with four BSOBs. 1: enzyme digestion to obtain 4BSOB fragment; 2: DNA marker DL5 000; 3: enzyme digestion of pc-minE vector. (B) Construction of response vectors with two and three copies of BSOBs. 1: enzyme digestion to remove two copies of BSOBs; 2: DNA marker DL5 000; 3: enzyme digestion to remove one copy of BSOB.
2.1.3 EC-Biotin-On系统的构建
大肠杆菌生物素连接酶 (EC-BirA) 基因全长966 bp,克隆自大肠杆菌DH5α基因组 (图6)。EC-BirA与VP4片段一起,连入Nhe/ⅠNotⅠ酶切的pcDNA3.1(+) 载体,得到融合基因EC-BV的表达载体pc-EC-BV,为EC-Biotin-On系统的调控载体。EC-Biotin-On系统的响应载体与BS-Biotin-On系统类似,为了便于比较,本研究构建了含3个拷贝ECOB的响应载体,3ECOB片段由全合成获得,连入pc-Hy-minE载体的PminCMV上游,得到的载体命名为pc-Hy-3ECOB-minE。
2.2 BS-Biotin-On系统的考察和评价
2.2.1 BS-Biotin-On系统与EC-Biotin-On系统效果的比较
将pc-BS-BV/pc-Hy-3BSOB-minE和pc-ECBV/pc-Hy-3ECOB-minE分别共转染HEK293细胞,经抗生素筛选获得稳定转染的细胞混合克隆,分别称为HEK-3BSE和HEK-3ECE。将这两种细胞分别接种24孔细胞培养板,待细胞贴壁后,更换为无生物素和含200 μmol/L生物素两种培养基继续培养3 d,借助流式细胞仪检测EGFP荧光强度情况 (图7)。结果表明,含3个拷贝BSOB的BS-Biotin-On系统的诱导率 (诱导后目的基因表达与本底表达的比率) 为3.8,显著高于含3个拷贝ECOB的EC-Biotin-On系统 (诱导率为2.8)。
图6 PCR扩增EC-BirA基因Fig. 6 PCR amplification of EC-BirA gene. 1: PCR product of EC-BirA; 2: DNA marker.
2.2.2操纵子数目对BS-Biotin-On系统效果的影响
将pc-BS-BV和含1−4个拷贝BSOB的EGFP诱导表达载体pc-Hy-(1-4)BSOB-minE分别共转染HEK293细胞,经筛选得到混合细胞克隆。以组成型表达EGPF的载体pc-Hy-E和pc-Hy-BSOB-minE载体单转染的细胞分别作为阳性对照和阴性对照,考察无生物素和
200 μmol/L生物素两种培养条件下培养3 d后EGFP的相对荧光强度 (图8)。结果表明,含1−4个拷贝BSOB的BS-Biotin-On系统的诱导率逐渐升高,依次为1.5、2.1、4.1和6.2;同时,随着BSOB拷贝数的增加,无生物素时的EGFP背景表达略有升高,相对荧光强度由93.69升高至128.95,但均与pc-Hy-BSOB-minE单转染情况下的EGFP表达无明显差别。含4个拷贝BSOB的响应载体经诱导后的EGFP相对荧光强度与野生型CMV启动子驱动的EGFP (pc-Hy-E)表达强度接近。另外,pc-Hy-E转染的细胞在不同的生物素浓度条件下的EGFP相对荧光强度接近,表明生物素存在与否对EGFP的表达水平无显著影响。
从背景表达和诱导强度两方面综合考虑,在目前考察的BSOB拷贝数中,认为含4个拷贝BSOB的响应载体效果最好。

图7 BS-Biotin-On系统和EC-Biotin-On系统诱导率的比较Fig. 7 Comparison of induction ratio between BS-Biotin-On and EC-Biotin-On systems. *statistically different with the control.
2.2.3 BS-Biotin-On系统的诱导动力学
选取调控质粒和含4个拷贝BSOB的EGFP诱导表达载体共转染的HEK293细胞 (称为HEK-4BSE) 为研究对象,进一步考察在不同浓度的生物素存在下BS-Biotin-On系统的响应情况,以及EGFP荧光强度随诱导剂存在时间的变化情况。将HEK-4BSE培养于含不同浓度生物素的培养体系中,3 d后检测EGFP荧光强度(图9A),结果显示,随着生物素浓度的增加,EGFP表达显著升高,在生物素浓度为10−100 μmol/L时达到最高,当生物素浓度高于500 μmol/L后,进一步增加生物素浓度,EGFP表达略有降低。在200 μmol/L生物素存在时,HEK-4BSE细胞EGFP诱导表达随时间变化的动力学曲线 (图9B) 显示,诱导后EGFP表达水平迅速升高,至48−72 h达到最高并趋于稳定。Western blotting检测诱导后不同时间EGFP蛋白表达情况显示了类似的结果 (图9C)。
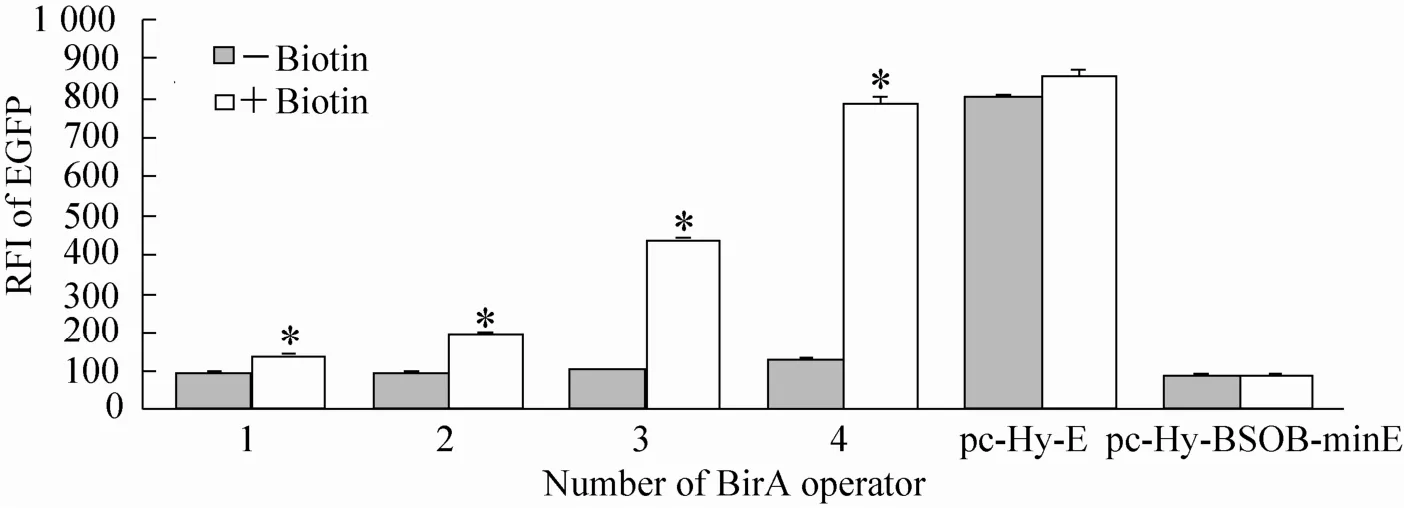
图8 不同操纵子数目对BS-Biotin-On系统效果的影响Fig. 8 Effect of operator number on the efficiency of BS-Biotin-On systems.

图9 BS-Biotin-On系统的诱导动力学Fig. 9 Inductive kinetics of BS-Biotin-On system. (A) Response of BS-Biotin-On system to different concentrations of biotin. (B) Time course of induced EGFP intensity. (C) EGFP expression at different time points identified by Western blotting.
3 讨论
大肠杆菌生物素连接酶BirA是发现最早、研究得最清楚的生物素连接酶,含321 Aas,分子量33.5 kDa[12]。EC-BirA能够结合位于生物素合成操纵元启动子上游的特异操纵子序列,抑制生物素合成操纵元的转录[13-14]。突变实验表明,EC-BirA的DNA结合结构域位于N-末端,而酶活性和生物素结合位点位于中间结构域,BirA以两个单体的形式结合于一个40 bp不完全对称的回文序列上[15]。另一个研究得较多的生物素连接酶来自革兰氏阳性细菌枯草芽胞杆菌,BS-BirA含325 Aas,分子量为36.2 kDa。该蛋白具有与EC-BirA类似的双功能特性,是枯草芽胞杆菌生物素操作元的抑制因子,并且具有生物素连接酶活性,能够补偿大肠杆菌的条件致死birA突变[16]。但是,BS-BirA的氨基酸序列与EC-BirA仅有27%的同源性,在与该蛋白的转录抑制因子功能有关的3个关键位点中,DNA结合结构域与EC-BirA同源性较低,这与二者相应的操纵子序列不同有关;生物素结合位点二者一致;ATP结合位点有所不同(BS-BirA中为GRGRMS,EC-BirA中为GRGRRG)[17]。以上差异可能会造成BS-BirA与EC-BirA在操纵子序列结合的特异性及对生物素响应的灵敏性等方面的不同。
在上述理论的基础上,本研究以BS-BirA与单纯疱疹病毒转录激活结构域核心序列的4个串联重复的融合蛋白 (BS-BirA-VP4) 为转录激活因子,建立了一种响应于生物素的诱导表达系统——BS-Biotin-On,并比较了其与文献报道的基于EC-BirA的生物素诱导表达系统在目的基因诱导率方面的差异,结果表明,同样在3个拷贝操纵子存在下,BS-Biotin-On系统的诱导率 (3.8) 显著高于EC-Biotin-On系统 (2.8),且二者EGFP本底表达强度接近。本研究进一步考察了BS-Biotin-On系统中操纵子数目对诱导效果的影响,在考察的1−4个BSOB数目范围内,随着操纵子数目的增加,诱导率显著增加,同时,EGFP背景表达强度也有所升高,但均与单转染pc-Hy-BSOB-minE的阴性对照无显著差别。对含4个BSOB的BS-Biotin-On系统的进一步研究表明,该系统对生物素响应灵敏,诱导后6 h EGFP表达即升高1倍,至48−72 h达到最高,并且在较低的生物素浓度下 (10 μmol/L)即可达到较高的诱导率。
与其他类似的研究不同的是,本研究采用EGFP,而不是通常使用的SEAP作为考察诱导表达效果的报告基因,其优势在于:1) 可以通过流式细胞仪来检测其表达强度,操作方便快速,结果可靠,而SEAP的表达水平则需较繁琐的ELISA方法来测定;2) 可通过流式细胞分选技术从混合细胞克隆中挑选不同诱导强度的单细胞,节省时间和精力,极大地提高建立细胞系的效率[18-19]。对于EGFP荧光强度与其蛋白表达水平的关系,目前还没有定量的报道,但从Hicham等[20]的报道来看,二者应不是简单的正比关系,本研究中流式细胞仪检测的荧光强度与Western blotting获得的EGFP蛋白水平的对应关系也显示了类似的结果,故本研究得到的诱导率与以SEAP为报告基因的系统的对比还需进一步实验的验证。
对于最适合生物制药应用的外源基因表达调控系统目前有公认的标准[21-22]:1) 抑制条件下产物基因的泄漏表达不应影响培养过程;2)在充分诱导条件下的最高表达水平可与标准组成型启动子的情况相比;3) 简洁的基因设计,便于改造和筛选生产细胞系;4) 诱导剂分子应是生理上惰性的,是获批的生产培养基的成分或宿主细胞代谢的组成部分;5) 系统对诱导剂分子的响应足够迅速。我们的实验结果证明,本研究建立的BS-Biotin-On系统能够符合上述标准,可以初步用于工程细胞系的增殖控制等需要对基因表达进行调控的工艺。
4 小结
本研究建立了一种基于枯草芽胞杆菌生物素连接酶、响应于生物素的外源基因表达调控系统,该系统设计简洁、应用方便、背景表达较低、诱导率较高、响应迅速,使用的诱导剂生物素为用于生物制药的生产用培养基的组分之一,绝对无毒,价格低廉,并且对细胞生长和产物表达无明显影响,基于以上优点,该系统在基础研究、生物制药、基因治疗和组织工程等领域具有潜在的应用价值。
REFERENCES
[1] Malleret G, Haditsch U, Genoux D, et al. Inducible and reversible enhancement of learning, memory, and long-term potentiation by genetic inhibition of calcineurin. Cell, 2001, 104(5): 675–686.
[2] Deans TL, Cantor CR, Collins JJ. A tunable genetic switch based on RNAi and repressor proteins for regulating gene expression in mammalian cells. Cell, 2007, 130(2): 363–372.
[3] Weber W, Fussenegger M. Inducible product gene expression technology tailored to bioprocess engineering. Curr Opin Biotechnol, 2007, 18(5): 399–410.
[4] Horner M, Weber W. Molecular switches in animal cells. FEBS Lett, 2012, 586(15): 2084–2096.
[5] Weber W, Fux C, Daoud-El Baba M, et al. Macrolide-based transgene control in mammalian cells and mice. Nat Biotechnol, 2002, 20(9): 901–907.
[6] Aarestrup FM. Veterinary drug usage and antimicrobial resistance in bacteria of animal origin. Basic Clin Pharmacol Toxicol, 2005, 96(4): 271–281.
[7] Hartenbach S, Daoud-El Baba M, Weber W, et al. An engineered L-arginine sensor of Chlamydia pneumoniae enables arginine-adjustable transcription control in mammalian cells and mice. Nucleic Acids Res, 2007, 35(20): e136.
[8] Weber W, Bacchus W, Gruber F, et al. A novel vector platform for vitamin H-inducible transgene expression in mammalian cells. J Biotechnol, 2007, 131(2): 150–158.
[9] Polstein LR, Gerbach CA. Light-inducible spatiotemporal control of gene activation by customizable zinc finger transcription factors. J Am Chem Soc, 2012, 134(40): 16480–16483.
[10] Weber W, Stelling J, Rimann M, et al. A synthetic time-delay circuit in mammalian cells and mice. Proc Natl Acad Sci USA, 2007, 104(8): 2643–2648.
[11] Weber W, Lienhart C, Daoud-El Baba M, et al. A biotin-triggered genetic switch in mammalian cells and mice. Metab Eng, 2009, 11(2): 117–124.
[12] Barker DF, Campbell AM. Genetic and biochemical characterization of the birA gene and its product: evidence for a direct role of biotin holoenzyme synthetase in repression of the biotin operon in Escherichia coli. J Mol Biol, 1981, 146(4): 469–492.
[13] Chapman-Smith A, Mulhern TD, Whelan F, et al. The C-terminal domain of biotin protein ligase from E. coli is required for catalytic activity. Protein Sci, 2001, 10(12): 2608–2617.
[14] Chakravartty V, Cronan JE. Altered regulation of Escherichia coli biotin biosythesis in BirA superrepressor mutant strains. J Bacteriol, 2012, 194(5): 1113–1126.
[15] Streit WR, Entcheva P. Biotin in microbes, the genes involved in its biosynthesis, its biochemical role and perspectives for biotechnological production. Appl Microbiol Biotechnol, 2003, 61(1): 21–31.
[16] Bower S, Perkins J, Yocum RR, et al. Cloning and characterization of the Bacillus subtilis birA gene encoding a repressor of the biotin operon. J Bacteriol, 1995, 177(9): 2572–2575.
[17] Rodionov DA, Mironov AA, Gelfand MS. Conservation of the biotin regulon and the BirA regulatory signal in eubacteria and archaea, Genome Res, 2002, 12(10): 1507–1516.
[18] Robert JS, Peter PG, Martin NM, et al. Accelerated cell line development using two-color fluorescence activated cell sorting to select highly expressing antibody-producing clones. Biotechnol Bioeng, 2008, 99(3): 578–587.
[19] Oberbek A, Matasci M, Hacker DL, et al. Generation of stable, high-producing CHO cell lines by lentiviral vector-mediated gene transfer in serum-free suspension culture. Biotechnol Bioeng, 2011, 108(3): 600–610.
[20] Hicham B, Reinhard F, Jurgen H. Improvement of reporter activity by IRES-mediated polycistronic reporter system. Nucleic Acid Res, 2008, 36(5): e28.
[21] Weber W, Fussenegger M. Inducible product gene expression technology tailored to bioprocess engineering. Curr Opin Biotechnol, 2007, 18(5): 399–410.
[22] Auslander S, Fussenegger M. From gene switches to mammalian designer cells: present and future prospects. Trends Biotechnol, 2013, 31(3): 155–168.
(本文责编 陈宏宇)
Establishment of a novel biotin-inducible eukaryotic gene regulation system
Lingling Ye1, Hong Liu1, Shichong Li1, Qiwei Wang1, Sanchun Lan2, and Zhaolie Chen1
1 Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
2 Affiliated Hospital of Academy of Military Medical Sciences, Beijing 100071, China
To establish a gene regulation system compatible with biopharmaceutical industry and gene therapy, weconstructed a fusion protein of biotin ligase from Bacillus subtilis (BS-BirA) and the trans-activation domain, and used its expression vector as the regulatory vector. Meanwhile, BS-BirA-specific operators were ligated upstream of attenuated CMV promoter to obtain the response vector. In this way, a novel eukaryotic gene regulation system responsive to biotin was established and named BS-Biotin-On system. BS-Biotin-On system was further investigated with the enhancing green fluorescent protein (EGFP) as the reporter gene. The results showed that our system was superior to the current similar regulation system in its higher induction ratio, and that the expression of interest gene could be tuned in a rapid and efficient manner by changing the biotin concentrations in the cultures. Our results show that the established system may provide a new alternative for the exogenous gene modulation.
biotin, gene regulation system, induction rate, BirA
September 22, 2013; Accepted: October 12, 2013
Zhaolie Chen. Tel: +86-10-66948818; E-mail: chenzl23@sina.com
叶玲玲, 刘红, 李世崇, 等. 一种新型的生物素诱导的真核基因表达调控系统的建立. 生物工程学报, 2014, 30(8): 1256–1265.
Ye LL, Liu H, Li SC, et al. Establishment of a novel biotin-inducible eukaryotic gene regulation system. Chin J Biotech, 2014,30(8): 1256–1265.
Supported by: National Major Special Program of New Drug Research and Development (No. 2011ZX09401-019), National Natural Science foundation of China (No. 81302689).
“重大新药创制”科技重大专项课题 (No. 2011ZX09401-019),国家自然科学基金 (No. 81302689) 资助。

