紫外与亚硝基胍复合诱变选育高产多糖罗耳阿太菌
李鸿梅,苗琇岩,魏 明,赵 慧,闵伟红
(吉林农业大学食品科学与工程学院,吉林长春 130118)
罗耳阿太菌(Athelia rolfsii)属半知菌亚门小菌核属,有性世代为齐整小核菌(Sclerotium rolfsii)[1-2]。该菌所分泌的多糖具有优良的增稠性[3]、假塑性[4]、抗菌性[5]、抗肿瘤活性、免疫活性[6],广泛应用于食品[7]、药品、陶瓷、石油等领域[8]。目前,德国Cargill公司、美国Pillshury公司已有小菌核属多糖工业化产品,而我国对该多糖的需求主要依赖进口,主要原因是缺乏高产多糖的优良菌株。
诱变是改良菌种的基本方法。常用诱变方法包括物理诱变(如紫外线、X射线、γ射线、快中子)和化学诱变(如碱基类似物诱变剂、移码突变剂、烷化剂等)[9]。由于单独使用一种诱变方法,诱变效率低,且易发生回复突变。目前国内外学者通常采用紫外线或亚硝基胍诱变方法改良真菌菌种[10]。1976年,小菌核属多糖由法国CECA S.E.公司商业化,商品名为Biopolymer CS,随后法国赛诺菲生物公司收购了CECA S.E.公司,成为国际上生产小菌核属多糖的主要生产者,并为该种多糖取商业名为Polytran[11]。目前我国还没有该多糖的工业化产品,而且缺乏对罗耳阿太菌及其相近菌属的菌种改良研究工作。本文通过响应面设计紫外线(UV)和亚硝基胍(NTG)复合诱变罗耳阿太菌,根据目标致死率优化诱变条件,获得高产多糖的正向突变菌株,提高多糖产量[12],为该多糖在国内的工业化生产奠定一定的科学基础。
1 材料与方法
1.1 材料与仪器
罗耳阿太菌(Sclerotium rolfsii) 吉林农业大学发酵实验室保藏菌种;亚硝基胍(NTG)溶液 称取10mg亚硝基胍于棕色瓶中,加1.0mL丙酮使其溶解,溶解后加10mL水,配制成1.0mg/mL亚硝基胍溶液[12-13];PBS溶液 称7.9g NaCl,0.2g KCl,0.24g KH2PO4、1.8g K2HPO4,溶于800mL蒸馏水中,用HCl调pH至7.4,用蒸馏水定容至1L,保存于4℃冰箱中备用;PDA斜面培养基(g/L) 马铃薯200、葡萄糖20、琼脂20,pH自然;种子培养基(g/L) 葡萄糖30.0、NaNO33.0、KH2PO41.0、酵母浸粉1.0、KCl 0.5、MgSO4·7H2O 0.5,pH4.0;发酵基础培养基(g/L) 葡萄糖35.0、NaNO33.0、KH2PO41.0、酵母浸粉1.0、KCl 0.5、MgSO4·7H2O 0.5、柠檬酸1.4,pH4.5。
HZC-Q空气浴振荡器 哈尔滨市东联技术开发有限公司;HPX-9082 MBE数显电热培养箱 上海博迅实业有限公司;pH计 上海雷兹仪器厂;高速低温离心机Z-36HK 德国HERMLE;HH-8水浴锅 国华电器有限公司;MP6001电子天平 上海恒平有限公司。
1.2 实验方法
1.2.1 菌种选育程序 出发菌株→制备菌丝体悬液→稀释→诱变处理→涂平板→挑取单菌落斜面培养→摇瓶复筛→测定多糖产量。
1.2.2 培养条件 菌种斜面活化:29℃培养3d。种子摇瓶培养:100mL种子液,29℃,200r/min,2d。发酵摇瓶培养:100mL发酵液,接种量7%,29℃,200r/min,5.5d。
1.2.3 多糖提取 向培养结束的液体培养基中加3倍体积蒸馏水,用1mol/L NaOH调pH为7.0,80℃水浴处理40min,8000r/min离心30min,取300mL上清液,加入等体积95%乙醇,4℃静置醇沉8h,5000r/min离心20min,取沉淀80℃烘干至恒重,称量。
1.2.4 诱变方法
1.2.4.1 紫外诱变 将斜面培养基保存的菌种接种到种子培养液中,29℃下培养24h,匀浆,稀释至10-3,转移到培养皿中,在15W紫外灯下20cm处照射30s(紫外灯预热30min),取0.1mL菌液涂平板。将平板置于29℃的恒温培养箱中避光培养3d,计算致死率:

式中,S1—诱变处理前菌落面积;S2—诱变处理后菌落面积。
按上述方法固定其他因素,选择紫外照射时间为20、30、40、50、60、70s,菌液稀释梯度为10-1、10-2、10-3、10-4、10-5,培养时间为12、18、24、30、36h,分别进行单因素实验。在突变株中选取7个长势较好的菌株,分别命名UV1、UV2、UV3、UV4、UV5、UV6、UV7,进行发酵培养,提取并测定多糖产量。
1.2.4.2 亚硝基胍(NTG)诱变 将斜面培养基保存的菌种接种到种子培养液中,29℃培养24h,8000r/min离心10min,收集菌丝体,用PBS冲洗1次,加入0.5mL PBS制成菌丝体悬液,加入0.4mg/mL NTG溶液0.5mL,29℃处理40min后离心,用PBS冲洗菌丝体沉淀3次,除去残留的NTG,转移至100mL种子培养基中29℃培养2d,匀浆振荡2min,稀释10-3,涂平板,29℃培养3d,计算致死率。
按上述方法固定其他因素,选择亚硝基胍浓度0.1、0.2、0.3、0.4、0.5、0.6mg/mL,诱变时间10、20、30、40、50、60min,分别进行单因素实验。根据单因素实验结果选择亚硝基胍诱变条件为:亚硝基胍浓度0.4mg/mL,亚硝基胍处理时间40min,进行亚硝基胍诱变。在突变株中选取7个长势较好的菌株,分别命名为NTG1、NTG2、NTG3、NTG4、NTG5、NTG6、NTG7,进行发酵培养,提取并测定多糖产量。
1.2.4.3 紫外线与亚硝基胍复合诱变 将斜面培养基保存的菌种接种到种子培养液中,29℃培养24h,匀浆,稀释10-3。15W紫外灯下20cm处照射菌丝体悬浮液一段时间(响应面设计),8000r/min离心10min,收集菌丝体,用PBS冲洗1次,加入0.5mL PBS制成菌丝体悬液,加入一定浓度的NTG(响应面设计),浸泡紫外诱变后的菌丝体,29℃诱变处理一段时间(响应面设计)后离心,离心后用PBS冲洗菌丝体沉淀3次,除去残留的NTG,转移菌丝体至100mL种子培养基中,29℃下培养2d,匀浆,稀释10-3,涂平板,29℃培养3d,计算致死率。从平板上随机选取16个长势较好的菌株,进行发酵培养,提取并测定多糖产量。
1.2.4.4 响应面实验设计复合诱变 紫外与亚硝基胍复合诱变响应面设计因素见表1。
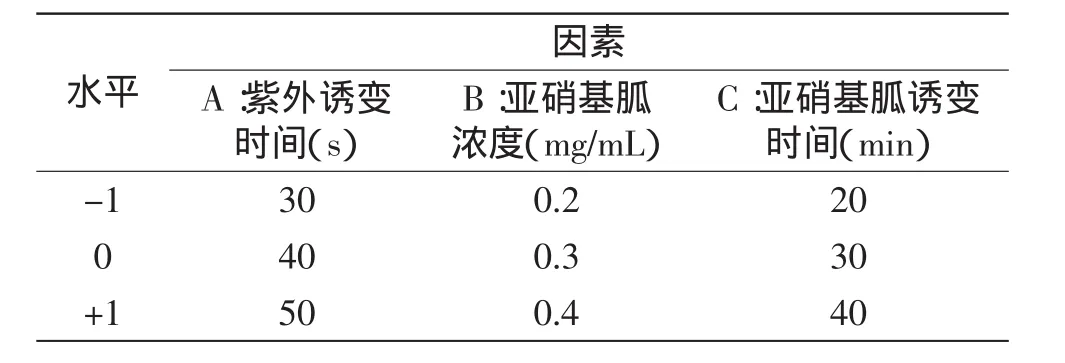
表1 紫外与亚硝基胍复合诱变响应面因素表Table 1 Response surface factors and levels on UV and NTG mutagenize
1.2.5 遗传稳定性实验 选取诱变后得到的多糖产量较高的变异菌株连续传代5次,每代分别进行摇瓶发酵培养,提取并测定多糖产量。
2 结果与分析
2.1 紫外(UV)诱变
2.1.1 紫外照射时间对致死率的影响 按1.2.4.1采用不同的照射时间对菌体进行处理,以未经紫外照射的菌株为对照,计算致死率,结果见图1。由图1可知,随照射时间的延长,致死率逐渐增加。较高的诱变指标(致死率)有利于筛选优良菌株,但由于紫外线有杀菌的效果,如果处理时间过长,一些高活性菌株也可能致死,不利于筛选。因此,选择70%~80%为目的致死率。从图1中可看出当处理时间为50s时,致死率达71.65%,因此选取50s为紫外照射时间。

图1 照射时间对UV诱变致死率的影响Fig.1 Effect of UV radiation time on lethality rate
2.1.2 菌液稀释梯度对致死率的影响 稀释梯度对致死率的影响见图2,从图2中可以明显看出,菌液稀释梯度对致死率影响较大。当稀释梯度为10-1时,紫外诱变致死率较低,仅为17.32%,这可能是由于菌丝体密度过大影响了紫外线的穿透能力,使诱变效果不明显;随着菌液浓度的增大,紫外线的穿透能力随之增强,菌种致死率明显增加。但是菌液浓度过低时,菌丝体含量较少,紫外线穿透量过大,紫外照射会杀死大量菌体,所以当稀释梯度为10-5时,致死率接近100%。稀释梯度为10-3时,致死率为68.32%,接近目标致死率。因此,稀释梯度选择为10-3。

图2 菌液稀释梯度对UV诱变致死率的影响Fig.2 Effect of diluted Athelia rolfsii liquid gradient on lethality rate by UV
2.1.3 种子培养基培养时间对致死率的影响 选择种子培养基中培养不同时间的菌种进行紫外诱变,致死率结果见图3。从图3中可以看出,在种子培养基中培养12h时的菌种经紫外照射后,在平板培养基中基本没有菌落出现,这可能是由于经过12h的培养,菌种生长还停留在适应期,紫外照射引起成大量菌种死亡;而经过种子培养基培养36h的菌种,紫外诱变后致死率仅为34.79%,可能是由于菌体生长处于对数期末期或稳定期,此期间菌体生长状况基本稳定,紫外照射诱变后的菌种致死率较低。培养24h的菌种经紫外诱变后致死率为74.68%,符合目的致死率。因此,选择培养24h的菌种进行紫外诱变处理。

图3 种子培养时间对UV诱变致死率的影响Fig.3 Effect of Athelia rolfsii incubation time in seed culture medium on lethality rate by UV
2.1.4 紫外诱变对多糖产量的影响 紫外诱变对多糖产量的影响如图4所示,采用单因素实验获得的最佳条件(紫外照射时间50s、稀释梯度10-3、培养时间24h)对罗耳阿太菌进行紫外诱变,突变株多糖产量有明显变化。正向突变株多糖产量明显增加,其中UV1、UV2、UV6和UV7多糖产量相对出发菌株增长率均高于10%。UV7多糖产量最高,达17.759g/L,比出发菌株16.042g/L增长了10.70%。

图4 紫外诱变菌株的多糖产量Fig.4 Polysaccharide production from different mutant strains treated by UV
2.2 亚硝基胍诱变
2.2.1 亚硝基胍浓度对致死率的影响 亚硝基胍是有效的化学诱变剂,可以使DNA分子上的碱基及磷酸部分烷化,导致DNA复制时碱基配对错误而引起突变。不同浓度亚硝基胍诱变菌体所得致死率结果见图5,亚硝基胍浓度为0.1mg/mL时,致死率仅为13.16%。随着亚硝基胍浓度的增加,致死率明显升高,当亚硝基胍浓度达到0.4mg/mL时,致死率为71.35%,在目标致死范围之内。继续提高亚硝基胍浓度,菌体致死率迅速提高,浓度为0.6mg/mL时,菌体基本完全死亡。所以在亚硝基胍诱变中选择亚硝基胍浓度为0.4mg/mL。
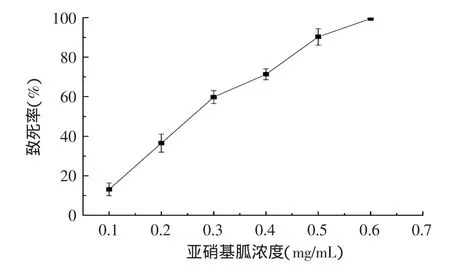
图5 亚硝基胍浓度对致死率的影响Fig.5 Effect of NTG concentration on lethality rate

图6 亚硝基胍处理时间对致死率的影响Fig.6 Effect of treated time by NTG on lethality rate
2.2.2 亚硝基胍处理时间对致死率的影响 一般来说,延长亚硝基胍的处理时间,会增大菌体DNA突变的几率,从而提高致死率。真菌诱变致死率一般要求控制在70%~80%之间,为了获得这样高的致死率,通常控制亚硝基胍的处理时间在20~70min之间。亚硝基胍诱变时间对菌体致死率的影响结果见图6。由图6可知,亚硝基胍处理10min,菌体的致死率为26.32%;随着诱变时间的增加,菌体致死率显著提高。诱变时间为40min时,致死率达到79.65%,在目标致死范围之内。诱变时间为60min时,菌体基本死亡。因此在亚硝基胍诱变中处理时间选择40min。
2.2.3 亚硝基胍诱变对多糖产量的影响 亚硝基胍诱变对多糖产量的影响如图7所示,采用单因素实验获得的最佳条件(亚硝基胍浓度0.4mg/mL,亚硝基胍处理时间40min)对罗耳阿太菌进行亚硝基胍诱变,突变株多糖产量有明显变化。正向突变株多糖产量明显增加,其中NTG1、NTG2、NTG5和NTG7多糖产量相对于出发菌株增长率均高于14%。其中NTG7多糖产量最高,达18.573g/L,比出发菌株16.042g/L增长了15.78%。

图7 亚硝基胍诱变突变株的多糖产量Fig.7 Polysaccharide production from different mutant strains treated by NTG
2.3 紫外与亚硝基胍复合诱变
2.3.1 复合诱变条件 根据表1进行紫外与亚硝基胍复合诱变,实验结果见表2,响应面结果分析、回归模型参数方差分析见表3。
以致死率为响应值回归拟合所得各因素函数表达如下:Y=79.20+4.40A+13.35B+4.03C-7.03AB-0.23AC-3.32BC-0.63A2-1.64B2+3.62C2。
由方差分析得出p值,模型极显著,模型的失拟性不显著,回归决定系数R2=0.9897,修正决定系数R2Adj=0.9764,说明方程拟合性较好,可对培养条件分析预测。采用Design Expert 8.0.5对结果分析,目标致死率选择75%,确定复合条件见表4。
2.3.2 复合诱变对多糖产量的影响 按表4中修正条件对罗耳阿太菌进行复合诱变,突变株多糖产量如图8所示,每组选取四株长势较好的突变株进行发酵培养,都能筛选出正向突变菌株,其中X2、X3、X13菌株的多糖产量均达到19g/L以上。紫外照射40s,浓度为0.28mg/mL的亚硝基胍处理25min的突变菌株X2多糖产量最高,达19.868g/L,比出发菌株16.042g/L增长了23.85%。
2.4 遗传稳定性实验结果
将图8中X2突变株连续传代培养5次,发酵测定多糖产量,多糖产量遗传稳定性结果见表5。由表5可知,在几次传代中,多糖产量基本相同,均达到19.6g/L以上。对传代5次的多糖产量进行方差分析,计算方差为0.001,表明经过传代后的X2菌株多糖产量基本稳定。实验结果表明X2菌株产多糖的遗传稳定性较好。

表2 响应面实验设计及结果Table 2 Process variables and levels of UV and NTG in response surface central composite design and experimental results

表3 复合诱变回归模型方差分析Table 3 Variance analysis for regression model of composite mutation

图8 紫外与亚硝基胍复合诱变菌株多糖产量Fig.8 Polysaccharide production from different mutanted strains treated by UV and NTG

表4 优化复合诱变条件Table 4 Variance analysis for regression model of composite mutation
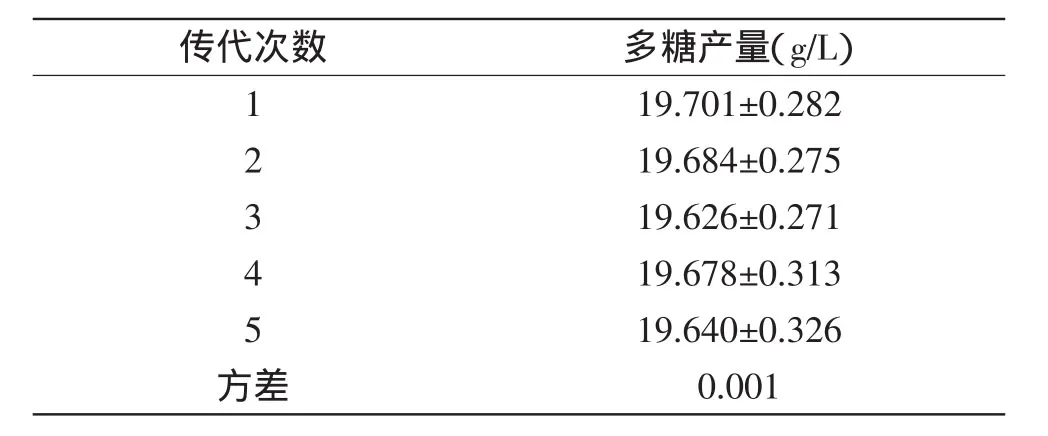
表5 突变菌株X2产多糖遗传稳定性Table 5 Stablity of polysaccharide production from X2
3 结论
分别采用紫外线和亚硝基胍诱变罗耳阿太菌,UV7突变株多糖产量为17.759g/L,NTG7突变株多糖产量为18.573g/L。紫外线和亚硝基胍复合诱变条件为:紫外照射40s,亚硝基胍浓度0.28mg/mL,亚硝基胍处理时间25min,筛选得到X2突变株,多糖产量最高为19.868g/L,比出发菌株16.042g/L增长了23.85%。以X2为出发菌株,连续传代5次,多糖产量基本一致,表明通过亚硝基胍与紫外复合诱变得到的X2菌株遗传稳定性较好。
[1]魏景超.真菌鉴定手册[M].上海:上海科学科技出版社,1979.
[2]喻璋,张猛.半知菌分属图册[M].北京:科学出版社,2009.
[3]PRETUS H,ENSLEY H,MCNAMEE R,et al.Isolation,physicochemical characterization and preclinical efficacy evaluation of soluble scleroglucan[J].Journal of Pharmacology and Experimental Therapeutics,1991,257(1):500-510.
[4]贾薇,郑志永,刘汝冰,等.一种新型微生物多糖流变学初探[J].食品科学,2009,30(1):135-138.
[5]MASTROMARINO P,PETRUZZIELLO R,MACCHIA S,et al.Antiviral activity of natural and semisynthetic polysaccharides on the early steps of rubella virus infection[J].Journal of Antimicrobial Chemotherapy,1997,39(3):339-345.
[6]JAMAS S,EASSON JR D D,OSTROFF G R.Use of aqueous soluble glucan preparations to stimulate platelet production:U.S.Patent 5,532,223[P].1996.
[7]VINARTA S,MOLINA O,FIGUEROA L,et al.A further insight into the practical applications of exopolysaccharides fromSclerotium rolfsii[J].Food hydrocolloids,2006,20(5):619-629.
[8]VI ARTA S C,YOSSEN M M,VEGA J R,et al.Scleroglucan compatibility with thickeners,alcohols and polyalcohols and downstream processing implications[J].Carbohydrate Polymers,2012,chap,2.
[9]冯云,任路静,魏萍,等.微生物发酵产二十二碳六烯酸代谢机理的研究进展[J].生物工程学报,2010,26(9):1225-1231.
[10]张春玲.紫外线与亚硝基胍复合诱变选育高产海藻糖菌株的研究[J].食品科学,2009,30(21):188-191.
[11]Survase S A,Saudagar P S,Bajaj I B,et al.Scleroglucan:fermentative production,downstream processing and applications[J].Food Technology and Biotechnology,2007,45(2):107-118.
[12]杨欢欢,胡中泽.红曲菌的复合诱变及其固态发酵条件的优化[J].食品科学,2012,33(11):247-251.
[13]吴慧昊,牛锋.乳酸菌低温菌株的复合诱变选育[J].微生物学通报,2013,40(4):631-645.

