海带岩藻多糖的提取工艺优化及初步结构分析
李国莹,袁 方,罗 玮,李汉广,余晓斌,*
(1.江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏无锡 214122;2.齐鲁工业大学食品与生物工程学院,山东济南 250353)
岩藻多糖(fucoidan)一种复杂的硫酸酯多糖,主要成分为L-岩藻糖(fucose)、硫酸基团,还包括半乳糖、木糖和甘露糖等成分[1],存在于褐藻的细胞壁基质中[2]。它具有多种生物学活性[3],如抗凝血、抗氧化、抗血栓、抗癌等功效[4-7],成为中外学者的研究热点。海带一种大型褐藻且资源丰富,可为岩藻多糖的研究与开发提供原料保证。
由于褐藻中岩藻多糖含量低且结构复杂,高纯度岩藻多糖价格昂贵,为使优质岩藻多糖生产进一步产业化,岩藻多糖的提取工艺一直备受关注[8],采取传统提取过程中添加辅助提取步骤,从而提高多糖提取率,如酶法[9]、超声波[10]、微波[11]超滤[12]等技术应用于多糖的提取。程仕伟等[13]水提制备海带岩藻多糖提取率为4.99%,而崔艳丽等[14]利用复合酶酶解法提取岩藻多糖提取率为13.9%,可见辅助方法的添加与传统提取工艺相比,具有更高的提取率。
本实验采用高压均质与酶法结合提取岩藻多糖,采用高压均质处理原料提取岩藻多糖的报道鲜有。高压均质与酶共同作用,促使细胞间质中多糖充分溶出。在单因素实验基础上,利用响应面优化提取工艺进一步提高得率,利用红外及色谱技术初步检测自制岩藻多糖的成分及结构,为岩藻多糖的研究提供依据。
1 材料与方法
1.1 材料与仪器
海带 市售;葡聚糖标准品、10种单糖标准物Sigma公司;纤维素酶、木瓜蛋白酶 南宁东恒华道生物科技有限公司;所用其他试剂 均为分析纯。
粉碎机 常州五谷农场食品有限公司;胶磨机上海正奥泵业制造有限公司;可见光分光光度计 上海精科;紫外分光光度计 海优尼科;冷冻离心机Thermo公司;冷冻干燥机 Virtis公司;FEI Quanta 200扫描电子显微镜 FEI公司;HPGLC Waters公司;ICS-5000离子色谱仪 Dionex公司。
1.2 实验方法
1.2.1 海带预处理 海带洗净晒干,粉碎,酒精∶三氯甲烷∶水(4∶2∶1)脱脂,过滤,烘干。将粉碎机、胶磨机、高压均质机处理得到不同的海带浆分别提取岩藻多糖,考察不同预处理方式对多糖得率的影响,选取最佳的海带处理方法。
1.2.2 岩藻多糖提取 取适量海带浆,水浴55℃,加入酶(纤维素酶、木瓜蛋白酶)适量,酶解2h,温度升至90℃,10min使酶失活,离心取上清液,上清液加CaCl2溶液,离心取上清,加乙醇,使其终浓度为60%,4℃过夜,离心,弃上清。沉淀依次用乙醚,丙酮洗涤,冷冻干燥,岩藻多糖粗糖。
1.2.3 单因素及响应面优化实验 单因素实验基本条件为:料水比1∶20,酶用量1.0%,酶解pH5.0,酶解温度50℃。改变其中一个条件,固定其他条件分析所选因素对岩藻多糖得率的影响。各因素梯度分别为:料水比:1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40;酶用量:1%、1.5%、2%、2.5%、3%;酶解pH:4.0、4.5、5.0、5.5、6.0、7.0;酶解温度(℃):35、40、45、50、55、60。
根据单因素实验结果,利用响应面分析软件Box-Behnken Design(BBD)模型,设料水比(A)、酶解pH(B)、酶用量(C)三因素为自变量,岩藻多糖得率Y为响应值,设计三因素三水平实验,确定提取工艺的最佳参数,实验因素与水平取值见表1。

表1 Box-Behnken实验因素与水平Table 1 Factors and levels of Box-Behnken
1.3 测定方法
1.3.1 粗多糖得率的测定 粗岩藻多糖得率(%)=粗多糖质量/海带粉质量×100
1.3.2 岩藻糖标准曲线的绘制 以岩藻糖浓度为横坐标,吸光值为纵坐标绘制标准曲线[15],标准曲线方程y=0.0135x+0.0066,R2=0.9991。
1.3.3 多糖含量的测定 取适量一定浓度的海带粗多糖待测液于试管中,按标准曲线的测定方法测定吸光值,计算粗糖中多糖的含量。岩藻多糖含量(%)=多糖质量/粗多糖总质量×100
1.4 岩藻多糖初步结构分析
1.4.1 粗多糖纯化 取上述粗多糖溶于水,等体积加入CaCl2溶液,室温放置,4000r/min离心10min,取上清Sevage法脱蛋白,直到中间层无沉淀产生为止,收集上层液,加乙醇至浓度为60%,4℃放置过夜,8000r/min离心10min,收集沉淀,加水,透析(透析袋截留分子量8000~14000u),冷冻干燥得岩藻多糖,所得多糖用于以下多糖成分分析实验。
1.4.2 岩藻多糖红外光谱分析[16]取多糖1mg与干燥的溴化钾研磨混匀,压片,用红外光谱仪初步分析岩藻多糖结构。
1.4.3 岩藻多糖分子量的测定 采用高效凝胶过滤色谱法[17](HPGFC),色谱条件:色谱柱:UltrahydrogelTMLinear 300mm×7.8mm id×2;流动相:0.1mol/L NaNO3;流速:0.9mL/min;柱温:45℃;葡聚糖标准品作为标样,绘制分子量校正曲线。所用葡聚糖分子量(Mw)分别为33800、41100、1000、2500u。样品的前处理:取纯化多糖溶解于流动相中,用微孔过滤膜过滤后供进样。
1.4.4 岩藻多糖单糖组分分析:离子色谱-脉冲安培法[18](IC-PAD)色谱条件:色谱柱:CarboPac PA20;流动相:H2O,250mmol/L NaOH,1mol/L NaAc;流速:0.5mL/min;检测器:脉冲安培检测器。
样品前处理:称取多糖样品1mg,溶于1.0mL 4mol/L三氟乙酸,充氮气封管,90℃水解1h,冷却后用氮气吹干,加水10mL溶解,用微孔过滤膜过滤后供进样。
1.5 数据处理
采用Design Expert 8.0,Origin 8.5和Excel 2010进行数据处理。
2 结果与分析
2.1 海带粉的处理方法的选择
以经过不同处理的海带浆为原料,提取岩藻多糖,结果如图1所示。由图1可知仅经粉碎机处理的海带粉颗粒大,得率较低;经胶体磨处理后,颗粒较细,得率有所提升;高压均质处理,得率进一步提升,可能是由于高压均质具有破壁效果[19]与酶作用使细胞间质的多糖充分溶出因而得率提高,但过高的机械作用也会破坏多糖结构,如糖链的断裂,SO42-的脱落等。故本实验参考Rosa M等的研究结果[20],选择高压均质的压力为200Bar与酶相结合处理海带粉,以期获得更高的得率。

图1 不同海带浆的多糖提取结果Fig.1 polysaccharide extraction result of different kelp
2.2 单因素实验结果
2.2.1 料水比对岩藻多糖得率的影响 由图2可知,随料水比的增加,岩藻多糖得率明显提高。是由于加入溶剂量少时,材料本身吸水膨胀,影响细胞与酶充分结合;随着溶剂量的增大,细胞内物质溶出,多糖得率随之增大。但随着溶剂量的继续增加,多糖得率增加趋于稳定,选择1∶30为自变量料水比的零水平。
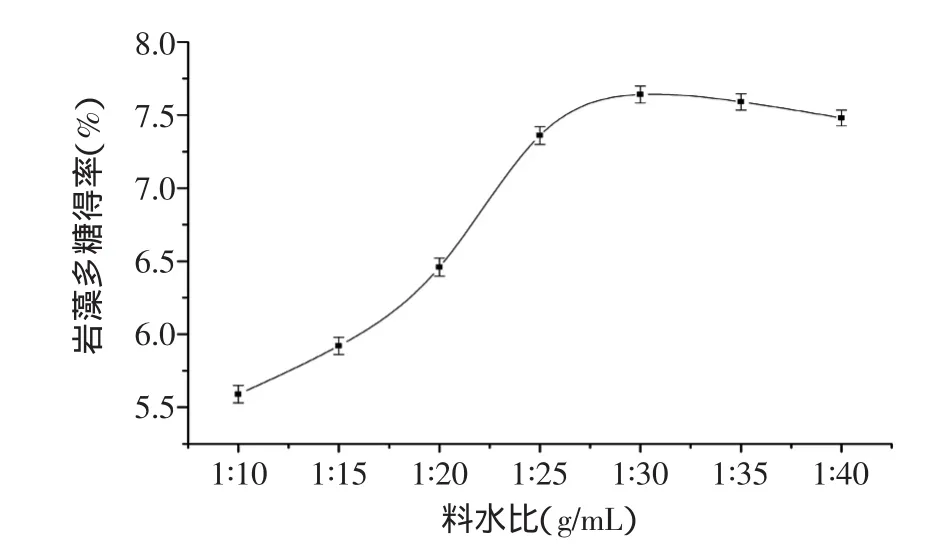
图2 料水比对岩藻多糖提取的影响Fig.2 Effect of alga/water ratio on extraction of fucoidan
2.2.2 酶用量对岩藻多糖提取的影响 由图3可知,未添加酶与添加酶处理相比较,多糖得率提高较明显,当用量达2.5%时多糖得率达最大值,继续增大用量得率几乎无变化,由于加酶浓度达到一定值,酶分子饱和,底物水解速度增加不再显著,故选择2.5%为自变量酶用量的零水平。

图3 酶用量对岩藻多糖提取的影响Fig.3 Effect of enzyme dosage on extraction of fucoidan
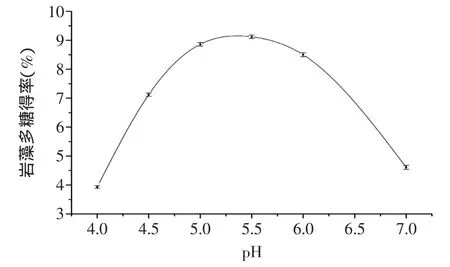
图4 pH对岩藻多糖提取的影响Fig.4 Effect of pH on extraction of fucoidan
2.2.3 pH对海带岩藻多糖提取的影响 pH是影响酶活力的重要因素。纤维素酶的最适pH4.0~5.5,木瓜蛋白酶的最适pH6~7。本实验采用两种酶复合作用,结果如图4所示,pH<4.0或pH>7.0时,酶的活性降低,多糖得率低;两种酶混合后最适pH范围为5.0~6.0,其中pH为5.5时多糖提取最为理想,选择5.5为自变量pH的零水平。
2.2.4 温度对海带岩藻多糖提取的影响 温度是影响酶活力的另一重要因素。纤维素酶的最适温度在45~65℃,而木瓜蛋白酶的最适合温度55~65℃。由图5可知,两种酶混合后的适合温度范围为45~55℃,其中温度为50℃时多糖提取最为合适。

图5 温度对岩藻多糖提取的影响Fig.5 Effect of temperature on extraction of fucoidan
2.3 响应面Box-Behnken实验设计与结果
单因素实验中,温度与pH均为酶学性质参数,但pH对得率的影响要大于温度,故在单因素实验确定的中心点的基础上,以酶解温度50℃,酶解时间2.0h为条件,设计3因素3水平实验,结果见表2。

表2 Box-Behnken实验设计及结果Table 2 Test design and results of Box-Behnken
2.3.1 数据分析 以多糖得率为响应值,根据表3的实验结果,Design Expert 8.0软件对数据进行二次回归分析,该数学模型的R2=0.9570,说明该数学模型与实验拟合较好且可靠性高,可用于预测岩藻多糖的得率及其优化提取条件。
回归方程为:Y1=14.51+2.26A+1.32B-0.32C+0.83AB-1.07AC+0.6BC-2.39A2-1.30B2-1.32C2,其方差分析见表3。由表3可知,A和B对Y1的影响均为显著,尤其因素料水比(A)的影响极为显著,与文献[15]报道相吻合;由F值可知,3个因素对Y影响的排序为:料水比>酶用量>酶解pH。

表3 模型方差分析结果Table 3 The results of variance analysis
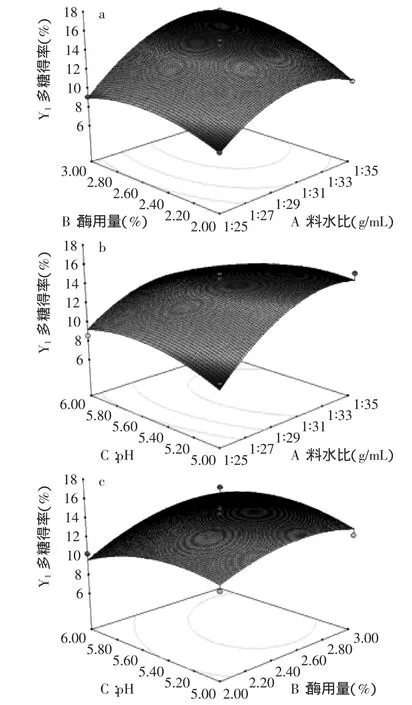
图6 各两因素交互影响岩藻多糖得率的响应面图Fig.6 Each interaction of two factors on fucoidan yield
响应面优化过程中,所选三个因素的交互作用的响应面图见图6。图6(a)中,随料水比的增加,多糖得率增加,适当增加酶用量也可增加多糖得率;图6(b)中料水比与pH影响均呈抛物线,二者交互影响较显著;图6(c)中酶用量与pH对多糖得率影响较明显,但二者的交互作用不显著。
2.3.2 最优值选择 经软件分析,该模型的最大估计值为15.42%,对应自变量值为料水比1∶35,酶用量2.57%,酶解pH5.32,故选取料水比1∶35,酶用量2.5%,酶解pH5.32。为确定实验结果的可靠性,对上述优化条件进行验证实验,岩藻多糖得率为14.53%±0.05%,与预测值15.42%接近,验证模型的准确性,测定多糖含量为75.36%±0.12%。
利用高压均质与酶法结合,通过响应面优化提取工艺后,较传统提取方法而言,提取时间缩短,能耗减少,岩藻多糖得率及纯度均提高,为获得优质岩藻多糖的产业化提供依据。
2.3.3 红外光谱 岩藻多糖红外光谱图(图7),3425、2925、1616cm-1处吸收峰为糖类特征性吸收峰;1255cm-1附近处是由硫酸基S=O伸缩振动引起的,证明岩藻多糖含有硫酸基;1051cm-1处为C-O的伸缩振动峰;821cm-1为C-O-S键的吸收峰,证明硫酸基连接在糖环上;在1700~1750cm-1附近未检测到吸收峰,说明不含糖醛酸[21],与张文清等[22]报道岩藻多糖单糖组分不含糖醛酸,结构类似。

图7 岩藻多糖的红外光谱图Fig.7 IR spectrum of fucoidan
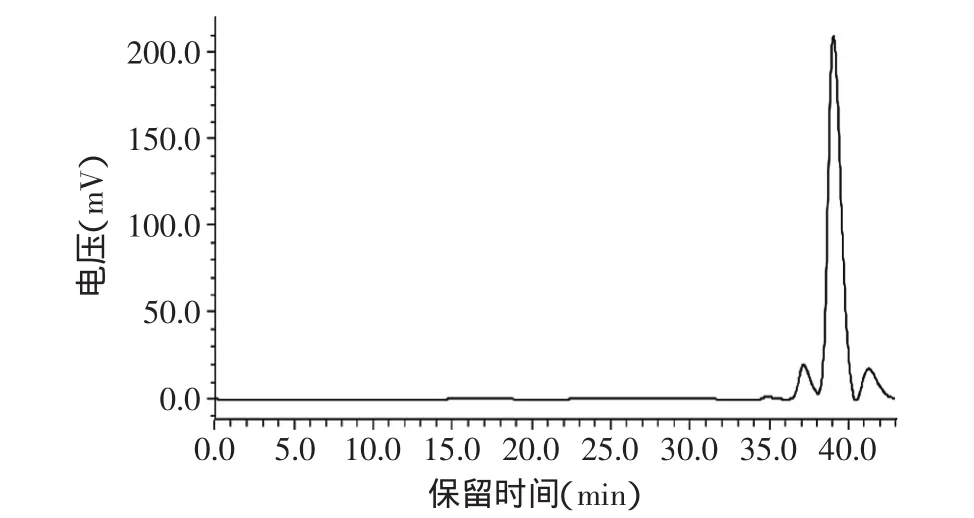
图8 海带岩藻多糖HPGFC色谱图Fig.8 HPGFC chromatograms of laminaria japonica fucoidan
2.3.4 岩藻多糖分子量的测定 葡聚糖标准品为标样,以葡聚糖的分子量对数为纵坐标与保留时间为横坐标绘制分子量校正曲线,得y=-0.43x+12.31,R2=0.991。如图8所示,分离得到三个峰,其分子量为别为639、248、79ku,与有关文献[23]报道相差较大,这与原材料不同提取方法不同有关。
2.3.5 岩藻多糖单糖组成的测定 岩藻多糖水解后产物进行IC-PAD分析,如图9所示,通过与标准单糖的保留时间(图10)比较,得知岩藻多糖样品由7种单糖组成,分别为岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖;糖含量分别为42.81%、1.95%、1.57%、31.35%、3.30%、5.56%、13.30%,与文献[23]报道结果相近,不含有葡萄糖醛酸,与上述红外结果一致。
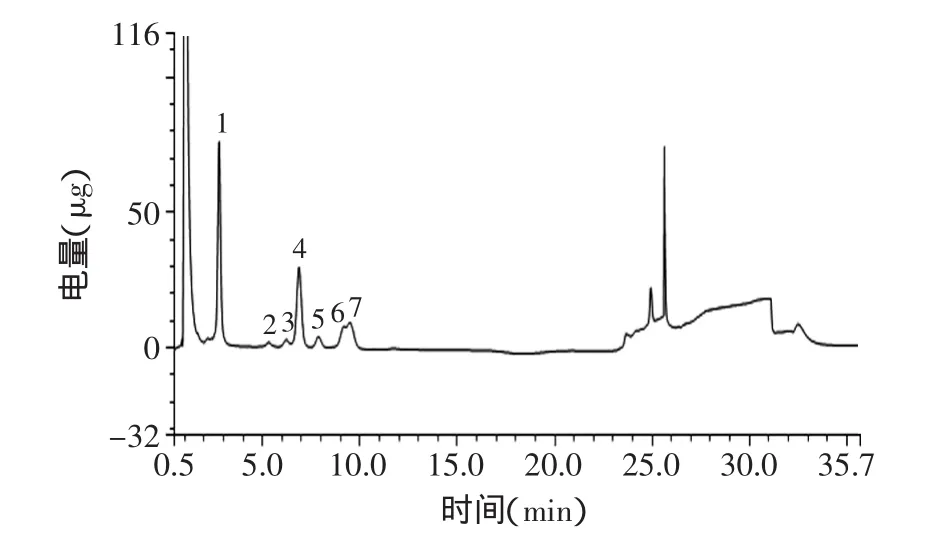
图9 海带岩藻多糖离子交换色谱图Fig.9 Ion exchange chromatogram of mixed standard solution

图10 混合标准液离子交换色谱图Fig.10 Ion exchange chromatogram of mixed standard solution
3 结论
在单因素实验基础上,运用响应面实验优化岩藻多糖的提取工艺,其最佳条件为料水比1∶35,酶用量为2.5%,酶解pH为5.32,得率14.53%±0.05%;HPGFC测定岩藻多糖分子量为639、248、79ku;利用IC-PAD检测岩藻多糖的组成成分及含量为:岩藻糖42.81%、鼠李糖1.95%、阿拉伯糖1.57%、半乳糖31.35%、葡萄糖3.30%、木糖5.56%、甘露糖13.30%。
[1]刘舒.三种褐藻中岩藻聚糖硫酸酯的纯化及结构分析[D].大连:大连海洋大学,2013.
[2]娄翠,汤顺清.海带岩藻多糖的分离纯化及结构特性的初步研究[J].食品工业科技,2012,33(4):135-137,141.
[3]谌素华,王维民.褐藻岩藻聚糖硫酸酯生物活性研究进展[J].食品工业科技,2009,30(6):371-374.
[4]Jing Wang,Feng Wang,Quanbin Zhang,et al.Synthesized different derivatives of low molecular fucoidan extracted fromLaminaria japonicaand their potential antioxidant activityin vitro[J].International Journal of Biological Macromolecules,2009,44(5):379-384.
[5]Kim WJ,Koo YK,Jung M,et al.Anti-coagulating activities of low-molecular weight fuco-oligosaccharides prepared by enzymatic digestion of fucoidan from the sporophyll of Korean Undaria pinnatifida.[J].Archives of Pharmacal Research,2010,33(1):125-131.
[6]董诗竹.海带低分子量岩藻聚糖硫酸酯的制备及其抗血栓活性研究[D].青岛:中国海洋大学,2011.
[7]李小婷,殷辰俞,孟徐莲,等.褐藻糖胶抑制人肝癌细胞HepG2增殖的机制[J].南京医科大学学报:自然科学版,2011(9):1261-1265.
[8]Thomas Hahn,Siegmund Lang,Roland Ulber,et al.Novel procedures for the extraction of fucoidan from brown algae[J].Process biochemistry,2012,47(12):1691-1698.
[9]赵前程,滕钊,汪秋宽,等.复合酶法提取海带多糖的研究[J].沈阳农业大学学报,2007(2):220-223.
[10]贲永光,钟红茂,吴晓燕.海带中褐藻糖胶的超声提取工艺的优化[J].广东药学院学报,2010(5):466-469.
[11]Claudia P Passos,Manuel A Coimbra.Microwave superheated water extraction of polysaccharides from spent coffee grounds[J].Carbohydrate Polymers,2013,94(1):626-633.
[12]王健,吴永沛,于立国.超滤制备海带岩藻聚糖的工艺研究[J].食品工业科技,2012,33(19):210-213.
[13]程仕伟,陈超男,冯志彬,等.海带岩藻多糖的水提制备及其抗氧化活性研究[J].食品科学,2010(6):101-104.
[14]崔艳丽,王培培,周军明,等.复合酶酶解法提取褐藻糖胶及其结构分析和抗氧化性研究[J].浙江大学学报:理学版,2011(5):536-540,549.
[15]钟方晓,任海华,李岩.多糖含量测定方法比较[J].时珍国医国药,2007(8):1916-1917.
[16]台文静.3种海藻中岩藻聚糖的提取分离、结构表征及其对纤溶系统影响的研究[D].青岛:中国海洋大学,2012.
[17]翟春,盛家荣.粘度法和高效凝胶渗透色谱法在普通念珠藻多糖分子量测定中的应用[C].//第六届全国精细化学品化学学术会议论文集,2001:113-115.
[18]李静,李仁勇,梁立娜,等.毛细管型离子色谱-脉冲安培法检测枸杞多糖的单糖组成[J].分析化学,2012,40(9):1415-1420.
[19]孙海翔,尹卓容,马美范.高压均质破碎啤酒酵母细胞壁的研究[J].食品工业科技,2002,23(2):66-67.
[20]Rosa M Rodriguez-Jasso,Solange I Mussatto,Lorenzo Pastrana,et al.Microwave-assisted extraction of sulfated polysaccharides(fucoidan) from brown seaweed[J].Carbohydrate Polymers,2011,863.
[21]宫雪,丁黎,司敏达,等.植物多糖组分中糖醛酸的分析技术及其应用[J].药学进展,2007(11):496-501.
[22]张文清,左萍萍,徐辰,等.海带中岩藻多糖的分离纯化与结构分析[J].食品科学,2012(1):68-71.
[23]刘颖.低分子量海带岩藻多糖的制备及其抗肿瘤活性的研究[D].合肥:安徽农业大学,2012.

