猪苓生长土壤中微生物区系初探*
杨金部,张宗舟,苟 萍**
(1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.天水师范学院生命科学与化学学院,甘肃 天水 741001)
猪苓Polyporus umbellatus(Pets)Fr.,是一种珍贵的真菌类中药材,属于国家保护品种[1,2]。猪苓含有多糖类、甾体类、氨基酸类、维生素类及微量无机元素等多种对人体有益的成分,具有利尿、抗癌和抗菌的作用,因此在医学上被称为“药材乌金”[3,4]。鉴于甘肃省陇南市得天独厚的自然环境以及资源优势,“陇南猪苓”品质优良、有效成分含量高[5]。随着医疗保健的发展,猪苓的市场需要越来越大,仅靠采挖野生猪苓是远远不够的。长期以来,一些学者对猪苓的栽培、生态环境等进行了研究。上世纪70年代,陇南市人工栽培猪苓成功,属全国首创[6]。猪苓生长土壤为微酸性,腐殖质层较厚,矿物质含量丰富,土壤中蜜环菌及其它微生物较多[5],猪苓与蜜环菌为特殊的共生关系[7-10]。2012年,猪苓菌核半野生栽培技术试验成功,并开始大面积栽培种植猪苓[11]。猪苓具有较好的药用价值和经济价值[12,13],因此对猪苓成分和药理作用的研究较多,但对猪苓生长土壤中微生物区系的研究,尚无详细的报道。因此,考察猪苓生长土壤中微生物分布、种类及数量,对于更好地开发和利用猪苓资源有重要的意义。本文探究比较猪苓生长土壤与自然土壤 (非猪苓生长土壤)中微生物区系,为猪苓的大面积种植和人工栽培提供科学依据。
1 材料与方法
1.1 实验材料
猪苓生长土壤采集于陇南市武都区山墩沟,随机选取3个有代表性的猪苓生长地椴木根际土壤,海拔高度为1500 m~2000 m,土层深度10 cm~15 cm,土壤为山地暗棕壤。
自然土壤 (非猪苓生长土壤)采集于天水师范学院教学楼后草坪上随机选取3个有代表的点,土层深度5 cm~15 cm,土壤肥沃,属于自然土,含水量与猪苓土壤相近。
1.2 实验器材与药品
器材:培养皿、三角瓶、试管、移液枪、酒精灯、ACS-DII三峰牌计重秤等。
药品:牛肉膏、蛋白胨、可溶性淀粉、酵母膏、孟加拉红、尿素、 (NH4)2SO4·7H2O、NaCl、KNO3、FeSO4·7H2O、MgSO4·7H2O、KH2PO4·3H2O、Na2HPO4、CaCl2、K2HPO4、C2H12O6、FeCl3、NaNO3、刚果红、琼脂等。
1.3 培养基
按照参考文献[14]培养基配方如下:
牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、琼脂18 g,自来水1000 mL,pH7.2~7.4。
高氏一号培养基:可溶性淀粉20 g、KNO31 g、NaCl 0.5 g、KH2PO4·3H2O 0.5 g、MgSO4·7H2O 0.5 g、FeSO4·7H2O 0.01 g、琼脂18 g,蒸馏水1000 mL,pH7.4~7.6。
酵母膏培养基:C2H12O650 g、(NH4)2SO4·7H2O 1 g、尿素 1 g、KH2PO4·3H2O 2.5 g、Na2HPO40.5 g、MgSO4·7H2O 1 g、FeSO4·7H2O 0.1 g、酵母膏0.5 g、孟加拉红0.03 g、琼脂18 g,蒸馏水1000 mL,pH4.5。
孟加拉红培养基:蛋白胨5 g、孟加拉红0.033 g、氯霉素 0.1 g、C2H12O610 g、MgSO4·7H2O 0.5 g、KH2PO4·3H2O 1 g、琼脂18 g,蒸馏水1000 mL。
自生固氮菌培养基:C2H12O610 g、KH2PO4·3H2O 0.5 g、MgSO4·7H2O 0.2 g、1%刚果红 5 mL、琼脂 18 g、NaCl 0.1 g,自来水1000 mL,pH7.0~7.2。
Hvtchison 氏培养基:KH2PO4·3H2O 1.0 g、MgSO4·7H2O 0.3 g、NaCl 0.1 g、CaCl20.1 g、FeCl30.01 g、NaNO32.5 g、琼脂18 g,自来水1000 mL,pH7.2~7.4。
1.4 方法
1.4.1 土壤含水量测定
准确称取新鲜猪苓土壤和自然土壤各2份,每份1 g,一份测量土壤含水量,即将土壤放在干燥箱 (160℃)干燥2 h至恒重,迅速精密称定重量,记录数据。另一份放入冰箱冷藏,用于测定其中的微生物。土壤含水率 (P)公式为:
P=(M1-M2)/M2×100%
式中:M1表示湿土重;M2表示烘干土重。
1.4.2 土壤微生物数量的测定
(1)培养基制备
将1.3中的不同培养基按配方配制装入三角瓶,121℃下高压锅灭菌20 min,在超净工作台倒平板。
(2)菌悬液制备
在无菌条件下,将1 g新鲜猪苓土壤和1 g自然土壤分别加入到100 mL无菌水中,振荡摇匀,即得到浓度为10-2的悬浮液;用1 mL无菌移液管吹吸悬浮液3次,吸取1 mL溶液加到9 mL无菌水的试管中,吹吸混匀,即为10-3浓度的悬浮液;以同样的方法连续稀释土壤溶液,浓度依次为10-4、10-5、10-6、10-7。
(3)菌体培养
按照参考文献[15],培养细菌用牛肉膏蛋白胨培养基,分别接种0.1 mL三种不同浓度 (10-5~10-7)的土壤溶液:用涂布棒涂匀,28℃恒温培养箱培养,每天观察记录数据。每个浓度设3个重复,并以无菌水作对照。
培养放线菌用高氏一号培养基,土壤溶液浓度为10-2~10-4;培养霉菌用孟加拉红培养基,土壤溶液浓度为10-3~10-5;培养酵母菌用酵母膏培养基,土壤溶液浓度为10-2~10-4;培养固氮菌用自生固氮菌培养基,土壤溶液浓度为10-5~10-7;培养纤维素细菌用Hvtchison氏培养基,土壤溶液浓度为10-5~10-7;菌体培养方法同上。
(4)霉菌的分离、纯化和保存
待霉菌菌落在平板培养皿上生长旺盛时,用无菌接菌环挑取少量孢子,接种到新鲜的孟加拉红培养基上作平板划线,28℃培养。经2次~3次平板划线后得到初步纯化的霉菌,从培养36 h的划线平板上选取单菌落,用无菌针挖出并移植到新的孟加拉红平板培养基上,在28℃培养3 d后,得到纯种培养菌落。经过分离纯化得到的纯菌落,接种到斜面培养基继续培养3 d后,将已有明显菌落的斜面培养基用牛皮纸、线绳包扎好,放入4℃的冰箱里进行储存。
(5)霉菌的初步鉴定
观察平板培养基上菌落的特征,如菌落颜色、形状、直径、表面是否光滑、有无同心环、边缘是否整齐,菌丝的高矮、紧密度,孢子的颜色、形状;培养基颜色变化、气味,以及菌落生长速率等,可初步确定可能的菌种。对部分菌种进行显微镜镜检,观察孢子囊的形态、大小、着生方式,藏卵器的形状、着生方式,突起物的有无及其形状,雄器的形状、数目、位置,是否有柄及柄的形态等特征,进一步确定霉菌中菌株的类型。
(6)菌落的计数
根据各微生物菌落特征和显微特征,分别计数每个培养皿中同类型单菌落的数量。所得的菌落数 (N,cfu·g-1)计算公式为:
N=N1×n
式中:N1为培养皿中的菌落数;n为稀释倍数。
2 结果与分析
2.1 土壤含水量
通过测定土壤含水量可知,猪苓生长土壤与自然土壤水分含量相差不大,均约为30%,见表1。

表1 土壤含水量
2.2 猪苓生长土壤和自然土壤中微生物区系
用不同的培养基进行培养和筛选,通过菌落特征和显微细胞观察,从猪苓生长土壤和自然土壤均得到主要的6种类型微生物,见表2、表3。

表2 猪苓生长土壤微生物区系
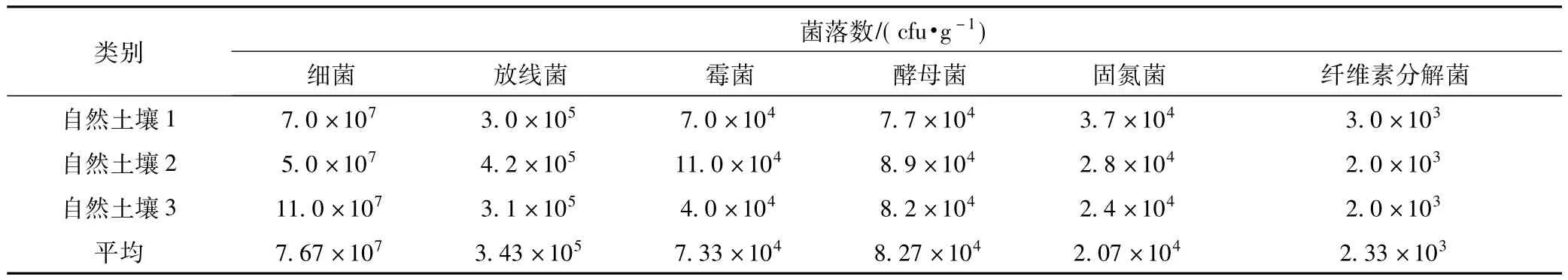
表3 自然土壤微生物区系
猪苓生长土壤中细菌、纤维素分解菌和固氮菌的菌落数较多,霉菌次之,放线菌、酵母菌较少。自然土壤中细菌菌落数较多,放线菌、酵母、菌霉菌次之,固氮菌和纤维素分解菌较少。
2.3 猪苓生长土壤与自然土壤中微生物区系比较
不同地域的土壤类型、含水量、肥力以及微生物数量和种类是不同的。通过比较猪苓生长土壤和自然土壤中的微生物区系,发现2种土壤微生物菌落数量差别较大,见表4。

表4 猪苓生长土壤与自然土壤微生物区系比较
猪苓生长土壤中霉菌、固氮菌、纤维素分解菌菌落数均高于自然土壤,纤维素分解菌菌落数比自然土壤高3个数量级,固氮菌高两个数量级,霉菌高1个数量级。猪苓生长土壤中的放线菌、酵母菌和细菌比自然土壤低1个数量级。猪苓生长土壤中纤维素分解菌和固氮菌菌落数显著高于自然土壤,可能与猪苓生长土壤腐殖质层较厚,土壤肥力较好,土质疏松有关。
2.4 猪苓生长土壤与自然土壤中霉菌的比较
霉菌遍布于全世界,大多数栖息于土壤、水体和植物载体上,对土壤和生命体发挥着非常重要的作用。由于霉菌种类多、形态多样、特征各异、容易观察鉴别,并且分离纯化出霉菌中各菌属对研究霉菌作用有很大的帮助。本次试验从猪苓土壤和自然土壤中各自分离纯化已知的霉菌5株,分别为青霉属、交链孢霉属、毛霉属、根霉属、曲霉属,还有未确定的其他霉菌,见图1。
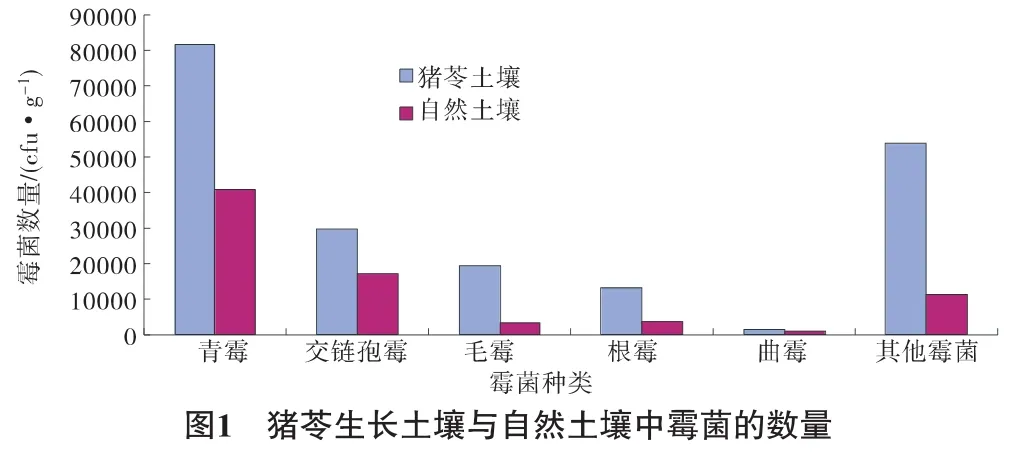
猪苓生长土壤和自然土壤中,青霉数量最多,每克土壤中数量分别达到 8.17 ×104cfu·g-1和 4.07 ×104cfu·g-1,占总霉菌数量的41.47%和55.52%。接着依次是交链孢霉、毛霉、根霉、曲霉,猪苓土壤中数量分别为2.97×104cfu·g-1、1.93 ×104cfu·g-1、1.33 × 104cfu·g-1、0.13 × 104cfu·g-1,自然土壤中数量分别为1.7 ×104cfu·g-1、0.33 ×104cfu·g-1、0.37 ×104cfu·g-1、0.1 ×104cfu·g-1,未知霉菌在猪苓土壤和自然土壤中数量分别为1.13×104cfu·g-1和1.13×104cfu·g-1。即从总体说,猪苓生长土壤中霉菌各菌株数量都高于自然土壤,并且青霉和毛霉的数量明显高于自然土壤。
3 讨论
根际微生物是土壤生命活动的重要组成成分,是根际微环境与土壤有机物质相互循环和相互转换的纽带,对植物的生长发育起着重要作用,更对其周围的寄生生物也发挥着重要影响。猪苓生长土壤中纤维素分解菌数量较多,该菌能分解纤维素为葡萄糖,葡萄糖可以为猪苓生长提供碳源。猪苓生长土壤中霉菌数量较多,可使土质肥沃、透气性良好,为猪苓生长创造了良好的条件。猪苓生长土壤中固氮菌的数量也较多,这可能是大量的固氮菌能为猪苓的生长提供氮源[16]。猪苓生长土壤中放线菌的数量明显比自然土壤中的少,可能与其土壤为微酸性[17]有关,不适宜放线菌生长繁殖。猪苓生长土壤中酵母菌的数量较少,其作用可能是防止酵母菌在厌氧条件下促进土壤中的糖类物质转化成酸,不利于猪苓中多糖类物质的合成。
猪苓生长土壤中霉菌是一个很大的类群,而霉菌中青霉属在猪苓土壤中占了很大的比例,青霉可以分解土壤中其他微生物难以分解利用的有机物和营养成分,对土壤环境具有高度的适应性和改良性,在土壤中发挥着重要意义。而且,青霉能与其他微生物形成稳定的微生物群落,可以阻挡病原菌微生物的入侵,对土壤特定环境起到一定的屏障和防治作用。因此,青霉很可能与猪苓生长土壤的独特性有关。还有,毛霉、根霉、交链孢霉的数量比自然土壤也明显增多,他们都可参与大分子物质的分解,释放营养元素、提高土壤肥力、改善土壤结构,也可能对猪苓生长土壤成分发挥一定作用,对猪苓品质改良有积极影响。
4 结论
猪苓生长土壤中微生物的分布和数量具有一定的特殊性,纤维素分解菌、固氮菌和霉菌 (尤其是青霉属)数量显著增多,可能决定着猪苓土壤资源的珍稀性。而且,猪苓生长土壤中合理的微生物比例,对猪苓人工种植、提高产量和改良品质具有一定的积极意义,因此,可以通过人工配制微生物菌剂,可以为优质猪苓的大面积栽培提供菌肥。
[1]李梁,罗英,熊东红,等.野生猪苓及其生态环境理化特性的分析研究[J].中国中医药信息杂志,2001(7):32-33.
[2]江苏新医学院.中草药大辞典[M].上海:上海科学技术出版社,1986:2191-2192.
[3]赵英永,崔秀明,张文斌.猪苓的化学成分与药理作用研究进展[J].中药材,2009(11):1785-1786.
[4]张志刚,杨权社,杨金梅.陇南猪苓规范化栽培技术[J].食用菌,2011(2):42.
[5]李富得,杨燕.陇南山区猪苓仿野生优质高产规范化栽培技术[J].食用菌,2012(3):40-41.
[6]曹琴.陇南猪苓人工栽培技术 [J].中国食用菌,2010,29(2):69-70.
[7]郭顺星,徐锦堂.猪苓菌核的营养来源及其与蜜环菌的关系[J].植物学报,1992,34(8):576-580.
[8]徐锦堂,郭顺星.猪苓与蜜环菌的关系[J].真菌学报,1992,11(2):142-145.
[9]王秋颖,徐锦堂,等.猪苓与蜜环菌营养关系的初步探讨 [J].中国中药杂志,2000,25(8):472.
[10]许广波,博伟杰,赵旭奎.我国猪苓研究的进展 [J].菌物研究,2003(1):58-61.
[11]李富得.猪苓菌核半野生栽培技术 [J].甘肃农业科技,2012(5):58-59.
[12]宋钦兰.猪苓的药理研究及临床应用[J].广西中医药,1981(3):42-45.
[13]刘汉卿,郭勇全,肖萍,等.猪苓的研究与应用[J].广州化工,2010,38(10):40-41.
[14]周德庆,胡宝龙,祖若夫,等.微生物学实验教程 [M].北京:高等教育出版社,2006(2):372-375.
[15]李阜棣,喻子牛.农业微生物实验技术[M].北京:中国农业出版社,1996.
[16]朱祖祥.土壤学[M].北京:农业出版社,1982:36-38.
[17]罗英,李梁.猪苓生长的土壤条件研究[J].核学农报,2002(2):115-118.

