基于细胞电阻抗传感器的细胞多生理参数分析系统设计*
王天星,黎洪波,苏凯麒,胡 宁,王 平
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027)
基于细胞电阻抗传感器的细胞多生理参数分析系统设计*
王天星,黎洪波,苏凯麒,胡 宁,王 平*
(浙江大学生物传感器国家专业实验室,生物医学工程教育部重点实验室,生仪学院,杭州 310027)
针对传统的细胞传感器系统存在参数单一的问题,设计了基于细胞电阻抗传感器的细胞多生理参数分析系统。通过阻抗传感器的模型及其生长和搏动原理、阻抗传感器的设计加工,细胞多生理参数分析系统设计等方面对系统进行介绍。该系统具有操作简便,高一致性和高通量等特点。采用系统测试实验和细胞实验对系统的基本性能继续测试。实验结果表明,细胞多生理参数分析系统能同时检测细胞生长和心肌细胞的搏动,具备快速,长期,无损和高通量测量的特点,为细胞生理研究提供了实用的平台。
生物医学;细胞传感器;阻抗传感器;细胞多生理参数分析系统;细胞生长和搏动;小鼠脑神经瘤细胞细胞;原代新生大鼠心肌细胞
生物阻抗检测技术是一种生物医学领域的重要测量技术。生物阻抗检测技术将较小的外加电流或者外加电压加载在活体组织或细胞上,非侵入地检测对电流的阻碍作用,即对阻抗的检测,广泛应用于医学领域中疾病诊断和生物学领域中细胞组织生理状态的研究[1-9]。随着微芯片加工技术和传感检测技术的不断发展,生物阻抗检测技术广泛应用于细胞生理相关的研究。阻抗检测技术应用于细胞研究主要分为两类:一类是结合微流控芯片或其他微通道,进行单个细胞定位和转移,检测细胞数量、尺寸等参数。另一类是利用阻抗微电极,检测细胞在电极上的生长和行为状态。利用阻抗微电极检测细胞生长和行为引起的阻抗变化已经广泛用于细胞生理相关的研究,也是用于构建细胞阻抗传感器的基础。
细胞阻抗传感器(ECIS),由Giaever和Keese在1984年首次提出的,是一种实用的常用于监测离体培养细胞行为的传感器[10-11]。活体细胞在ECIS传感器的电极表面上贴附生长,改变了电极间的电场分布,进而引起阻抗变化。阻抗变化反映细胞的生理状态,可以用于细胞行为的持续监测。由于细胞阻抗传感器具备实时、无标记、非侵入、可定量等优点,用于监测细胞贴附变化和细胞形状相关的大量过程,例如细胞增殖[12]、细胞贴附与伸展[13]、细胞微小运动[14]、细胞的趋化活性[15]、细胞迁移[16]、创伤愈合[17]、离体细胞毒性反应[18-20],以及细胞对其他物理化学变化的响应[12,21-22]。在最近的20多年里,阻抗检测技术已经成为一种重要和实用的用于离体细胞实验的无标记检测技术,有着极其广泛的应用。传统的细胞阻抗传感器及其检测系统只能检测细胞生长,而无法检测心肌细胞的搏动,因而极大地限制了阻抗传感器及其检测系统在生物医学领域中的应用。本论文主要设计开发了一种新型的阻抗传感器检测系统,从而能用于细胞生长和搏动的同时检测。
1 原理和方法
1.1 ECIS细胞阻抗模型
细胞在ECIS电极表面贴附、生长、增殖,阻碍了离子电流,从而引起了阻抗的变化。细胞在ECIS上简化模型如图1(a)所示。一般来说,采用等效阻抗电路来表示真实的阻抗系统模型[23-24],用于广泛的解释和分析实验获得的阻抗数据。随着ECIS的发展,越来越多的细胞研究采用叉指电极结构,有利于提高细胞阻抗传感器性能。图1(b)为在叉指电极上无细胞贴附的情况下,ECIS的阻抗等效电路模型。其中CD为Helmholtz双电层界面电容,Rsol为细胞培养液的扩展电阻。当细胞在电极上生长时,其简化等效电路模型如图1(c)所示,相比于无细胞时的等效电路模型,增加了细胞电容Ccell和电阻Rcell,细胞与基底之间的电容Cgap和电阻Rgap。基于无细胞和有细胞的等效电路模型,获得的ECIS有无细胞时的阻抗谱(图1(d)),及其对应的ECIS细胞阻抗检测灵敏度(图1(e))。
为了研究叉指电极的频率特性,Wang等从等效电路模型中定义了3个重要的频率flow、fmiddle和fhigh,并且根据这3个频率将整个阻抗谱频谱范围分成了4个部分Ⅰ、Ⅱ、Ⅲ、Ⅳ[25]。当激励频率低于flow时,无论ECIS电极上有无细胞,其阻抗主要由Helmholtz双电层界面电容CD决定,在这个频率范围内,ECIS灵敏度较低,随着频率的减小而进一步降低,并趋近于零。频率低于flow的范围被定义为Ⅰ区。相比于低频范围,当频率足够高并且高于fhigh时,无论ECIS电极上有无细胞,其阻抗主要由溶液扩展电阻Rsol决定。在这个频率范围内,ECIS灵敏度也较低,且随着频率的增加而进一步降低,并趋近于零。频率低于fhigh的范围被定义为IV区。最适合用于细胞阻抗测量的频率范围是Ⅱ区和Ⅲ区。当ECIS的工作频率处于flow和fhigh之间时,细胞对ECIS阻抗变化的影响起主要作用。在工作频率较低的Ⅱ区范围内,Ccell和Cgap引起ECIS阻抗的变化作用大于Rcell和Rgap。在工作频率较高的Ⅲ区范围内,Rcell和Rgap引起ECIS阻抗的变化作用大于Ccell和Cgap。通过ECIS细胞阻抗模型,可以确定ECIS传感器大致合适的工作频率范围,有利于指导传感器的设计优化和加工。
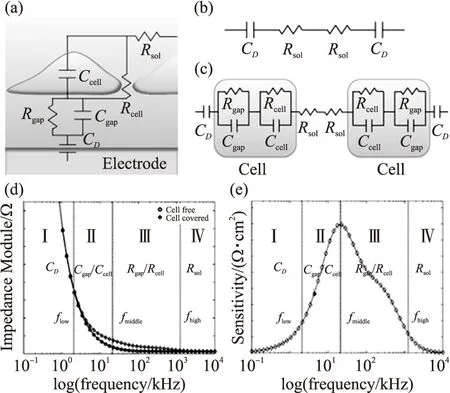
图1 (a)细胞在ECIS上简化模型;(b)ECIS上无细胞时的等效模型;(c)ECIS上有细胞覆盖的等效模型;(d)在不同频率下ECIS上有无细胞的阻抗大小对比;(e)在不同频率下的ECIS的检测灵敏度
1.2 细胞生长和搏动检测原理
ECIS传感器可以检测在其表面生长细胞的生理状态。相比于单电极,叉指电极的参考电极与工作电极发挥等价的作用,提高了空间阻抗电极的利用率。在细胞实验中,单电极与叉指电极检测细胞阻抗的原理类似。我们主要采用叉指电极,因此,主要围绕叉指电极的检测原理展开介绍。当一个幅值较小的正弦交流电压加载在叉指电极两端时,叉指电极间形成离子电流。如图2所示,当叉指电极上无细胞时,其阻抗最小,也称基线阻抗。当细胞在叉指电极上生长贴附时,阻碍离子电流,从而引起阻抗的升高。细胞在阻抗电极上细胞组织覆盖度越多,阻碍离子电流程度越大,阻抗越大。此外,ECIS阻抗的大小还与细胞贴附的紧密程度有关。细胞与叉指电极贴附越紧密,阻抗越大。细胞与细胞接触融合越紧密,阻抗也越大。ECIS传感器的基本功能是实时动态地监测细胞生长和贴附的生理状态。而对于一些有特殊行为的细胞(如节律性搏动的心肌细胞)来说,ECIS传感器检测细胞贴附紧密程度和形态的功能可以进一步扩展。心肌细胞由于兴奋收缩偶联的特性,会产生节律性的收缩和舒张,从而引起心肌细胞与电极之间、细胞与细胞之间贴附接触紧密程度以及细胞形态的变化,这些变化相比于缓慢的细胞生长状态变化较为迅速,能引起ECIS传感器阻抗的快速变化,因而可以被ECIS传感器检测(见图2)。
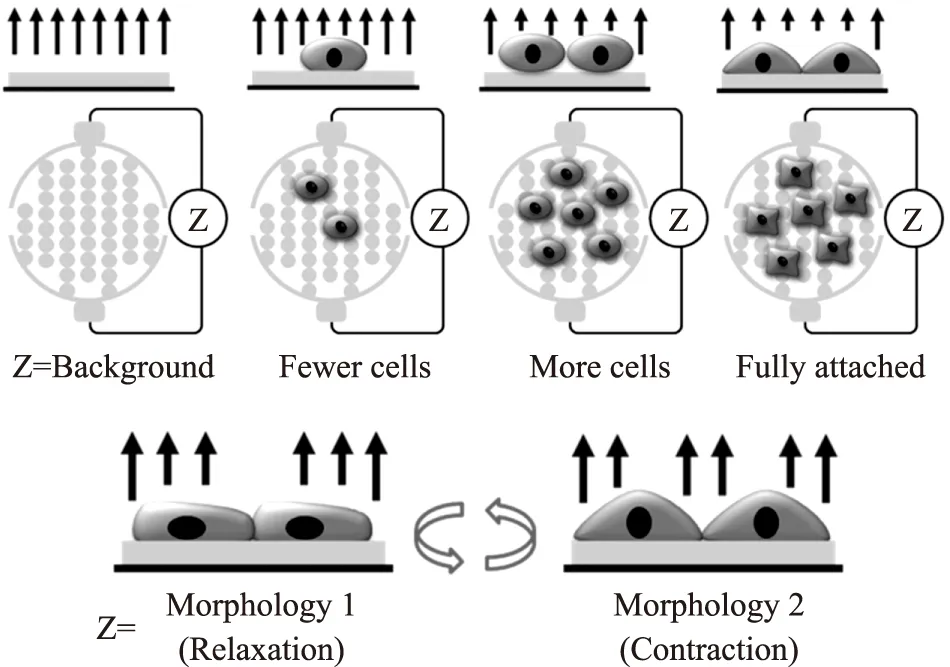
图2 ECIS传感器检测细胞生长和搏动原理
ECIS传感器检测电极上的细胞阻抗,可以实时记录生长在电极上细胞生理状态的重要信息。当细胞在外界刺激的作用下,生理状态发生改变,可以从ECIS检测的细胞阻抗中反映出来。因此,ECIS传感器常应用于在细胞实验中用于指示细胞生长、分裂增殖、形态变化、贴壁融合程度和死亡等生理状态的变化。ECIS传感器用于心肌细胞搏动的检测,是一种新型的ECIS功能应用。利用新生乳鼠的心肌细胞或者心肌细胞系,结合ECIS传感器,可以建立用于研究离体培养心肌细胞的传感器检测平台,进一步将构建的心肌细胞传感器平台用于药物的药理学和毒理学实验。
1.3 阻抗传感器的设计加工
ECIS传感器的加工主要是在玻璃材料的基底上刻蚀叉指电极图形及其引线。具体的工艺流程如图3所示,选择4 inch的玻璃材料作为加工传感器的基底材料。首先采用标准清洗工艺清洗玻璃材料;采用磁控溅射的方法溅射一层厚度约为20 nm的Cr作为粘附层,用来加强电极材料层的粘附能力;随后,采用磁控溅射的方法在Cr层上溅射一层厚度为300 nm的Au作为电极材料;再后,利用具有电极图案掩膜板,采用蚀刻的方法,刻出设计的叉指电极的图形及其引线。传统的加工设计方法还需要进行绝缘层的加工,采用PECVD的方法沉积SiO2/Si3N4作为芯片绝缘层,从而防止电极引线和溶液短路。我们利用ECIS的细胞培养腔,采用胶水固定在芯片区域,恰好能将引线区域排除在腔体之外,所以可以省略绝缘层加工的工艺流程,从而极大地降低了传感器加工的复杂性。
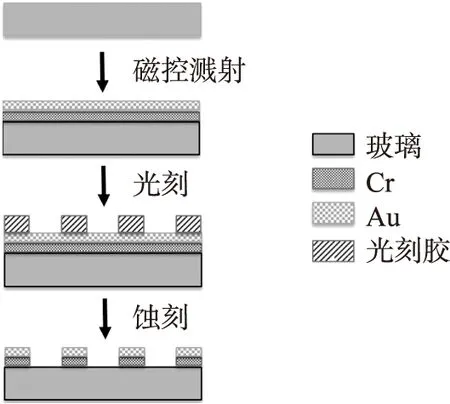
图3 ECIS传感器的加工工艺流程
1.4 细胞多生理参数分析系统设计
细胞多生理参数分析系统框图(见图4)),主要包括信号发生模块、前置放大滤波模块、模数转换模块和中央处理器模块。检测系统通过信号发生模块产生微小的正弦电压信号,并将这个微小的电压信号加载在多通道传感器上,会在传感器叉指电极上形成离子电流,传感器输出电流经过放大和滤波模块,被数模转换模块采集,最后通过激励信号的幅值和输出电流的幅值,即可计算出每个通道的阻抗大小。
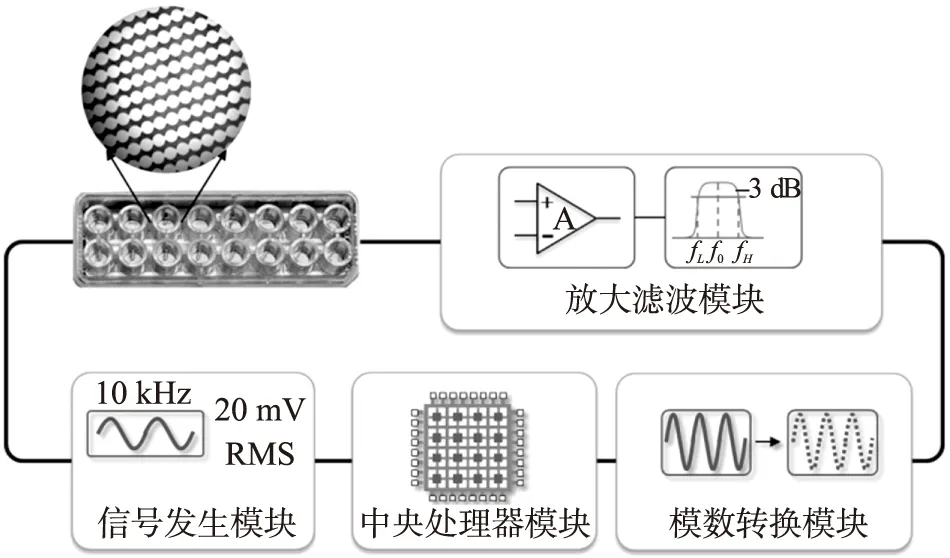
图4 多功能阻抗传感器系统框图
在众多研究中[26-30],细胞指数CI(Cell Index)被引入用于评价ECIS传感器系统中细胞电极相互作用引起的阻抗变化。CI是一个没有单位的比率ΔZ/Z0,Z0是通道背景阻抗,ΔZ为细胞在电极上贴附生长引起的阻抗变化,CI是将细胞在ECIS传感器电极上阻抗变化ΔZ转化为更统一、直观、简单的值。因此,CI值可以代替阻抗值反映细胞生长、增殖、细胞间接触、细胞与基底贴附的状态。由于细胞生长增殖属于较为缓慢的过程,不会产生剧烈快速的阻抗变化,所以对细胞在叉指电极生长增殖的阻抗检测,并不要求检测系统具备较高的时间分辨率。根据细胞在传感器上生长的阶段,时间分辨率可以为几分钟到几十分钟不定,而且不会丢失细胞生长增殖中的重要信息。
ECIS传感器也可以用于心肌细胞的搏动检测,由于心肌细胞是一种较为独特的细胞,会自发的进行节律性的搏动,其节律性收缩和舒张会引起细胞形态、细胞与细胞间接触、细胞与基底贴附的改变,从而会引起ECIS传感器阻抗节律性的改变,其输出的阻抗变化信号较为微小且快速,通常离体培养的心肌细胞搏动信号的时程为几百毫秒。对于这种ECIS传感器变化信号的检测,检测系统需要具备更高的检测灵敏度,从而能记录较为完整的心肌细胞搏动的信号。多功能ECIS传感器的检测系统区别于传统的阻抗检测系统,可以较为快速地检测ECIS传感器的输出信号,从而可以用于快速心肌细胞搏动信号的检测。从系统开发成本、效率等多方面因素考虑,我们采用NI高速数据采集卡为核心进行多功能阻抗检测系统的搭建,取代信号发生模块、中央处理器模块以及数模转换模块的功能。多功能ECIS传感器检测系统实物图如图5所示,内部主要包括NI高速数据采集卡、电源模块、前置放大滤波模块。此外,还设计了用于多通道芯片接口,用于固定和检测ECIS传感器的输出信号。

图5 细胞多生理参数分析系统实物图
2 实验结果与讨论
2.1 系统性能测试
研究表明[25],对于ECIS传感器对细胞阻抗进行检测,通常不会采用频率过高或过低的信号作为ECIS传感器的激励。激励信号的频率过高,传感器阻抗主要由溶液电阻决定;激励信号的频率过低,传感器的阻抗主要由界面电容决定。在上述两种情况下,细胞在传感器上生长引起的阻抗变化在这些频率范围内不显著,因而传感器的灵敏度较低。常用于细胞阻抗检测的频率范围为中间频段,一般来说在10 kHz~40 kHz范围内,叉指结构的ECIS传感器具备较高的检测灵敏度。从检测系统设计的角度来说,最佳工作频率选择需要考虑多方面的因素:①在10 kHz~40 kHz范围内,ECIS传感器都具备较高的灵敏度,且差异不大,选择适当数值的工作频率如10 kHz、20 kHz、40 kHz等便于实时的信号计算和处理;②在高速采集系统中,相同采样率条件下,正弦信号的频率越低,在一个正弦周期内能采集到离散信号的点数就越多,可用于信号处理的数据点数也越多,计算正弦周期幅值的准确度越高。综上考虑,选择频率为10 kHz幅值为30 mV的激励电压驱动ECIS传感器工作。
在系统进行校准后,进行传感器系统的稳定性测试,向16通道的ECIS传感器中加入200μL细胞培养液,将其放入培养箱中一段时间后进行阻抗检测。测试结果如图6所示,在后续的实验中Cell Index是主要用于反映细胞阻抗大小的指标,从结果中可以看到,16通道ECIS传感器的阻抗值基本保持稳定,标准差在±0.58 Ω之内,而计算得到CI标准差在±0.04之内,说明传感器具有较好的稳定性,由于细胞生长和搏动引起的阻抗变化远大于稳定性测试的标准差,因而满足系统检测细胞生长和搏动的要求。同时传感器系统的高速采集模式的时间分辨率可以达到4 ms,相对于搏动时程较短,可以记录较为完整的心肌细胞的搏动信号,因而也满足心肌细胞搏动检测的要求。
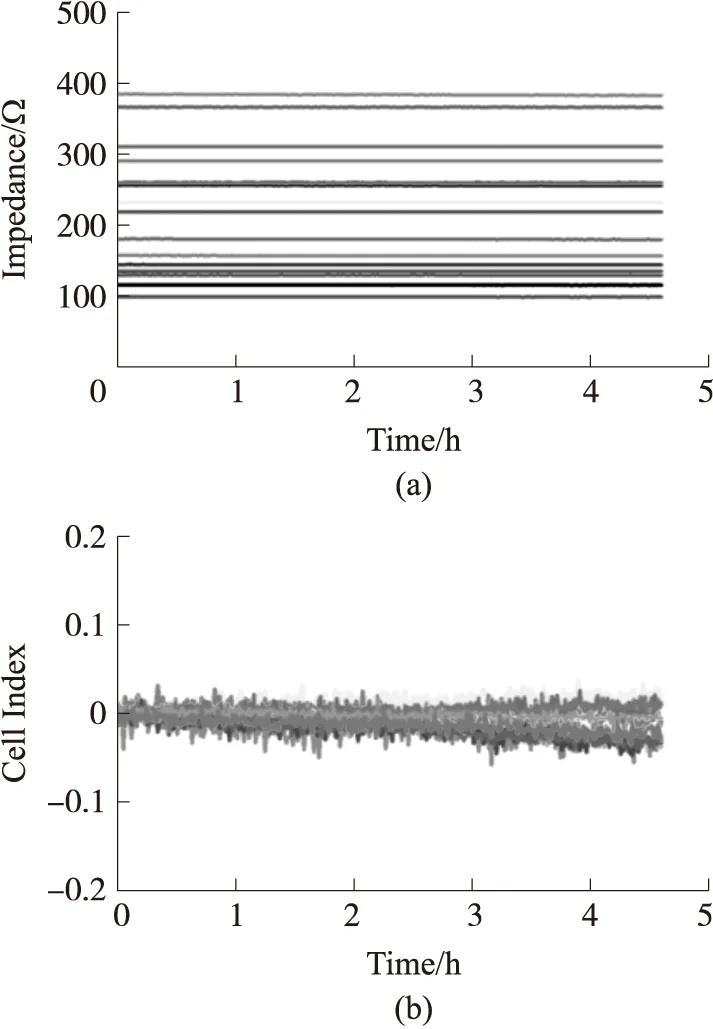
图6 传感器系统稳定性测试
2.2 细胞生长测试实验
ECIS传感器系统基本的功能是用于监测细胞在叉指电极上的生长状态。我们采用小鼠神经瘤母细胞Neuro-2a、人子宫颈癌细胞Hela、人肝癌细胞HepG2、人正常肝细胞L02等细胞系,用于开展多功能ECIS传感器系统细胞生长测试实验。这些细胞系在ECIS传感器上的培养方法基本类似,我们以小鼠神经瘤母细胞Neuro-2a的实验为例。首先需要进行的是细胞培养,采用的培养液包含100 μg/mL青霉素、100 μg/mL链霉素、10%胎牛血清、1%的丙酮酸钠、1%的谷氨酰胺、1%的非必需氨基酸的RPMI-1640培养基。将细胞培养在CO2细胞培养箱中,保持温度为37 ℃,CO2浓度为5%。观察细胞至对数生长期时,用胰酶-EDTA消化液(0.25%胰蛋白酶,0.02%EDTA),消化培养瓶中细胞,并将细胞按照105细胞/孔的细胞数接种到多通道ECIS传感器上。
如图7所示的ECIS传感器检测结果为细胞整个生长过程的原始CI:可以看到细胞在接种后第1个1 h,CI迅速增长。这主要是由于细胞在传感器的贴附引起;在之后的20多个小时内,CI不断增加,表明细胞处于快速生长期;在24 h左右更换细胞培养液,可以看到CI值在一段时间内有所下降,但随后又迅速恢复到原有CI值大小,并继续快速生长;在48 h左右,由于细胞数量过多,营养不充分,因而CI值逐渐减小,细胞进入衰亡期。
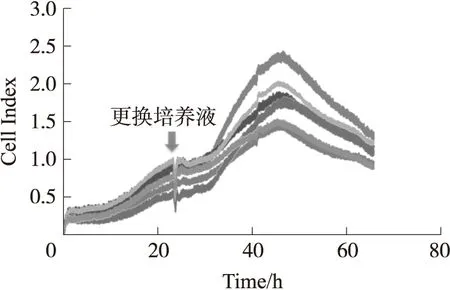
图7 小鼠神经母细胞瘤Neuro-2a生长实验结果
由于细胞生长在ECIS传感器上有一定差别,原始CI的曲线有较大的区别,这不利于将其作为细胞传感器使用。因而,我们采用归一化CI的方法,提高细胞传感器的一致性,选择归一化点为23 h,图8为归一化CI效果,从图上可以看到,在快速生长期的归一化CI值较为一致,从各通道统计结果中也能体现,细胞在快速生长期具有较小的标准差,有效地降低了细胞生长引起的差异性。由于在药物或者毒素测试常在细胞的快速生长期进行,通常与更换培养液同时进行,因此,使多通道ECIS传感器具备一致性良好的归一化生长曲线,是构建细胞传感器的必要前提。
从细胞生长的测试实验结果可知,我们设计的多功能ECIS传感器系统具备良好的检测细胞生长的基本功能。采用细胞指数归一化的功能可以有效地提高生长曲线的一致性,有利于进一步的化合物分析。多功能ECIS传感器能检测贴附在其叉指电极上生长增殖的各类细胞,通过实时记录阻抗的变化,检测细胞的生长状态。
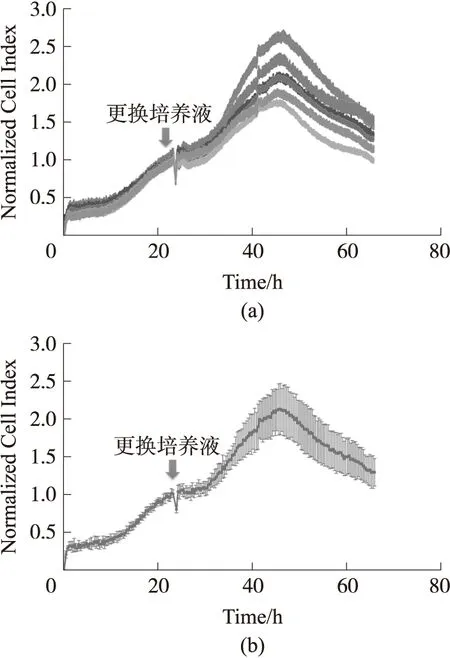
图8 归一化的细胞生长曲线CI(a)和各通道统计结果(b)
2.3 心肌细胞搏动测试实验
心肌细胞的搏动检测是多功能ECIS传感器系统另一个重要的功能。离体培养的心肌细胞在形成组织团之后会引起节律性的收缩和舒张,从而使叉指电极上的细胞形态、细胞与细胞接触、细胞与基底的贴附强度发生改变,影响叉指电极周围的离子环境,引起阻抗的变化。
我们采用了原代新生大鼠(1 d~3 d)的心肌细胞。具体步骤包括,首先在ECIS传感器各个通道内上包被一层0.1%的明胶,并在4 ℃条件下过夜,使传感器具备良好的心肌细胞生长贴附条件;采用75%的酒精消毒新生大鼠,用剪刀切开大鼠胸腔并分离出心脏,从新生大鼠取出心脏的过程必须快速,在冰冷的DMEM中润洗,清洗除去血液和其他碎片;将分离的心脏的心房除去,保留心室部分并移至装有2 mL的HBSS盐平衡液的瓶中;将心室剪碎成1 mm3的组长碎片,除去HBSS液。组织碎片步骤的采用胰蛋白酶和胶原酶消化,每步消化过程持续10 min,每5 min振荡瓶子,使用玻璃吸管吹碎片,取出上层清液,将组织碎片移至其他瓶中,采用含10%胎牛血清DMEM培养液停止消化;将细胞悬液以800 r/mmin的速度离心5 min,取出细胞悬液;重新加入4 mL含10%胎牛血清的DMEM细胞培养液,使细胞重新悬浮,采用200目细胞过滤筛过滤细胞,除去较大细胞团;将细胞按照每通道15 000个细胞的数量培养在多通道ECIS传感器上,并放入37 ℃,5% CO2的细胞培养箱中培养。在ECIS传感器上培养结果如图9所示。

图9 原代新生大鼠心肌细胞24 h培养后显微照片
采用多功能ECIS阻抗传感器系统对心肌细胞的搏动状态进行记录。图10显示为在第24 h、26 h、30 h、32 h、40 h和42 h下ECIS传感器检测的心肌细胞搏动信号,每次检测的时间持续20 s。从各个时间点记录的信号特征可知,原代新生大鼠心肌细胞在刚开始搏动阶段,搏动信号频率较低、幅值较小、时程较长(如第24 h和第26 h);在经过一段时间的培养后,心肌细胞搏动信号频率增加且较为规则,信号的时程较短,信号的幅值也逐渐增加(如第30 h和第32 h);在培养一定的时间之后,心肌细胞活性下降,搏动信号的频率显著下降,且信号的时程较长(如第40 h和第42 h),最后搏动信号逐渐消失。
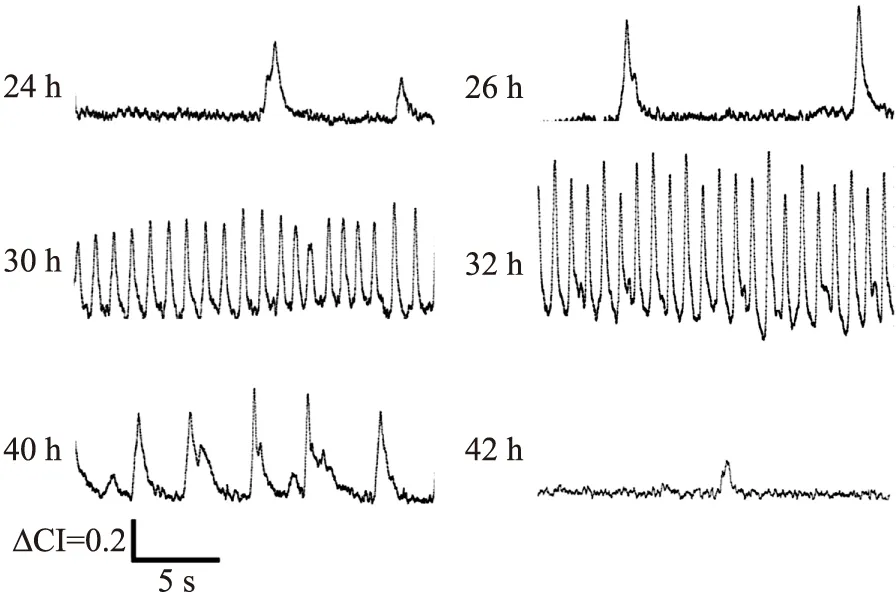
图10 在各个时间阶段下ECIS传感器检测的心肌细胞搏动信号
从多通道的心肌细胞搏动信号统计结果可见(图11),细胞培养24 h~30 h内,细胞的搏动频率较低,在20次/min以下;而在培养31 h~37 h内,细胞搏动频率较高,且较为稳定,在60次/min左右;在接下来的一段时间内,由于细胞活性下降,其搏动频率也逐渐下降,最后停止搏动。从统计结果可知,搏动频率类似,变化相近,标准差较小,表明同次培养的原代心肌细胞在各通道之间培养的状态近似相同,具备较好的一致性,是构建心肌细胞传感器的前提和基础。
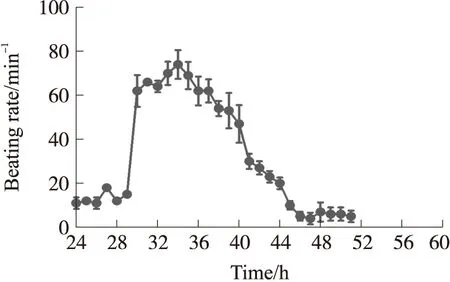
图11 多通道心肌细胞搏动频率的统计(n=3)
通过心肌细胞的搏动测试实验,验证了多功能ECIS传感器系统具备良好的检测心肌细胞的搏动的功能。ECIS传感器可以检测到生长在叉指电极表面心肌细胞节律性搏动的检测,为构建心肌细胞传感器创造了基本的条件,也为研究药物对心肌细胞影响建立了良好的传感器系统平台。综合以上的系统性能测试和细胞实验的结果表明,我们设计的细胞阻抗传感器系统,具有良好的一致性和实用性,可以同时用于多通道细胞生长和搏动的检测。
3 结论
本文主要介绍了基于细胞电阻抗传感器的细胞多生理参数分析系统设计。从ECIS细胞阻抗模型、ECIS细胞生长检测原理、ECIS细胞搏动检测原理介绍了细胞阻抗传感器的原理。重点介绍了高通量ECIS传感器的优化设计准则和加工工艺流程、传感器单元的封装结构和组成,ECIS传感器系统检测仪器的设计。我们设计的多功能ECIS不仅可以对细胞的生长进行实时的监测,用于分析细胞生长状态和药物作用,同时设计高速采集模式可以对心肌细胞的节律性搏动进行检测,使ECIS传感器的功能进一步扩展。最后通过细胞实验分析,验证了多功能ECIS传感器系统具备细胞生长和搏动的检测功能。
[1] Morimoto T,Kinouchi Y,Iritani T,et al. Measurement of the Electrical Bio-Impedance of Breast Tumors[J]. European Surgical Research,1990,22(2):86-92.
[2]Zou Y,Guo Z. A Review of Electrical Impedance Techniques for Breast Cancer Detection[J]. Medical Engineering and Physics,2003,25(2):79-90.
[3]Aberg P,Nicander I,Hansson J,et al. Skin Cancer Identification Using Multifrequency Electrical Impedance—A Potential Screening Tool[J]. Biomedical Engineering,IEEE Transactions on,2004,51(12):2097-2102.
[4]Cherepenin V,Karpov A,Korjenevsky A,et al. A 3D Electrical Impedance Tomography(EIT)System for Breast Cancer Detection[J]. Physiological Measurement,2001,22(1):9.
[5]Bernstein D P. A New Stroke Volume Equation for Thoracic Electrical Bioimpedance:Theory and Rationale[J]. Critical Care Medicine,1986,14(10):904-909.
[6]Wabel P,Chamney P,Moissl U,et al. Importance of Whole-Body Bioimpedance Spectroscopy for the Management of Fluid Balance[J]. Blood Purification,2009,27(1):75-80.
[7]De Lorenzo A,Andreoli A,Matthie J,et al. Predicting Body Cell Mass with Bioimpedance by Using Theoretical Methods:A Technological Review[J]. Journal of Applied Physiology,1997,82(5):1542-1558.
[8]Bernstein D P. Continuous Noninvasive Real-Time Monitoring of Stroke Volume and Cardiac Output by Thoracic Electrical Bioimpedance[J]. Critical Care Medicine,1986,14(10):898-901.
[9]Gutin B,Litaker M,Islam S,et al. Body-Composition Measurement in 9-11-Y-Old Children by Dual-Energy X-Ray Absorptiometry,Skinfold-Thickness Measurements,and Bioimpedance Analysis[J]. The American Journal of Clinical Nutrition,1996,63(3):287-292.
[10]Giaever I,Keese C R. Monitoring Fibroblast Behavior in Tissue Culture with an Applied Electric Field[J]. Proceedings of the National Academy of Sciences of the United States of America,1984,81(12):3761-3764.
[11]Giaever I,Keese C R. A Morphological Biosensor for Mammalian Cells[J]. Nature,1993,366(6455):591-592.
[12]Xiao C,Luong J H. On-Line Monitoring of Cell Growth and Cytotoxicity Using Electric Cell-Substrate Impedance Sensing(ECIS)[J]. Biotechnology Progress,2003,19(3):1000-1005.
[13]Xiao C,Lachance B,Sunahara G,et al. An In-Depth Analysis of Electric Cell-Substrate Impedance Sensing to Study the Attachment and Spreading of Mammalian Cells[J]. Analytical Chemistry,2002,74(6):1333-1339.
[14]Giaever I,Keese C R. Micromotion of Mammalian Cells Measured Electrically[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88(17):7896-7900.
[15]Hadjout N,Lacvsky G,Knecht D A,et al. Automated Real-Time Measurement of Chemotactic Cell Motility[J]. Biotechniques,2001,31(5):1130-1139.
[16]Lee C C,Putnam A J,Miranti C K,et al. Overexpression of Sprouty 2 Inhibits HGF/SF-Mediated Cell Growth,Invasion,Migration,and Cytokinesis[J]. Oncogene,2004,23(30):5193-5202.
[17]Keese C R,Wegener J,Walker S R,et al. Electrical Wound-Healing Assay for Cells in Vitro[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(6):1554-1559.
[18]Xing J Z,Zhu L,Jackson J A,et al. Dynamic Monitoring of Cytotoxicity on Microelectronic Sensors[J]. Chemical Research in Toxicology,2005,18(2):154-161.
[19]苏凯麒,邹玲,王琴,等. 基于细胞阻抗传感器的腹泻性毒素检测系统设计与实现[J]. 传感技术学报,2014,27(3):283-288.
[20]胡朝颖,刘清君,张远帆,等. 细胞阻抗传感器优化设计及其在毒素监测中的应用[J]. 传感技术学报,2010,23(3):291-296.
[21]Hug T S. Biophysical Methods for Monitoring Cell-Substrate Interactions in Drug Discovery[J]. Assay and Drug Development Technologies,2003,1(3):479-488.
[22]Luong J H. An Emerging Impedance Sensor Based on Cell-Protein Interactions:Applications in Cell Biology and Analytical Biochemistry[J]. Analytical Letters,2003,36(15):3147-3164.
[23]Huang X,Nguyen D,Greve D W,et al. Simulation of Microelectrode Impedance Changes Due to Cell Growth[J]. Sensors Journal,IEEE,2004,4(5):576-583.
[24]Yang L,Li Y,Griffis C L,et al. Interdigitated Microelectrode(IME)Impedance Sensor for the Detection of Viable Salmonella Typhimurium[J]. Biosensors and Bioelectronics,2004,19(10):1139-1147.
[25]Wang L,Wang H,Mitchelson K,et al. Analysis of the Sensitivity and Frequency Characteristics of Coplanar Electrical Cell-Substrate Impedance Sensors[J]. Biosensors and Bioelectronics,2008,24(1):14-21.
[26]Atienza J M,Zhu J,Wang X,et al. Dynamic Monitoring of Cell Adhesion and Spreading on Microelectronic Sensor Arrays[J]. Journal of Biomolecular Screening,2005,10(8):795-805.
[27]Yu N,Atienza J M,Bernard J,et al. Real-Time Monitoring of Morphological Changes in Living Cells by Electronic Cell Sensor Arrays:An Approach to Study G Protein-Coupled Receptors[J]. Analytical Chemistry,2006,78(1):35-43.
[28]Abassi Y A,Jackson J A,Zhu J,et al. Label-Free,Real-Time Monitoring of IgE-Mediated Mast Cell Activation on Microelectronic Cell Sensor Arrays[J]. Journal of Immunological Methods,2004,292(1):195-205.
[29]Abassi Y A,Xi B,Zhang W,et al. Kinetic Cell-Based Morphological Screening:Prediction of Mechanism of Compound Action and Off-Target Effects[J]. Chemistry and Biology,2009,16(7):712-723.
[30]Atienza J M,Yu N,Kirstein S L,et al. Dynamic and Label-Free Cell-Based Assays Using the Real-Time Cell Electronic Sensing System[J]. Assay and Drug Development Technologies,2006,4(5):597-607.

王天星(1979-),男,浙江大学,博士研究生,主要研究方向为细胞传感器与系统及其检测技术,wtx1979@163.com;

王平(1962-),男,浙江大学,教授,博士生导师,主要研究方向为传感器与检测技术、生物芯片与生物电子学、人工嗅觉与人工味觉等,cnpwang@zju.edu.cn。
CellularMultiphysiologicalParameterAnalysisSystemBasedonElectricalCell-SubstrateImpedanceSensor*
WANGTianxing,LIHongbo,SUKaiqi,ZOULing,HUNing,WANGPing*
(Biosensor National Laboratory,Key Laboratory of Biomedical Engineering of Education Ministry,Department of Biomedical Engineering,Zhejiang University,Hangzhou 310027,China)
For solving problems of single parameters of traditional sensor system,Cellular multiphysiological parameter analysis system based on electrical cell-substrate impedance sensor(ECIS)was designed. The equivalent model of ECIS,cellular growth and beating detection principle,the design and fabrication of ECIS,cellular multiphysiological parameters analysis system design and other aspects of the system are introduced. This system has the characteristics of simple,high-consistency and high-throughput. System test experiments and cell experiments were carried out to determine the basic performance of the system. Experimental results show that the cellular growth and cardiomyocyte beating can be detected by cellular multiphysiological parameter analysis system with rapid,long-term,high-throughput and non-invasive measurement of characteristics. It will provide a utility platform for the cellular physiological study.
biomedical engineering;cell-based biosensor;electrical cell-substrate impedance sensor;cellular multiphysiological parameter analysis system;cellular growth and beating;neuro-2a;cardiomyocyte
项目来源:海洋公益项目(201305010)
2014-08-07修改日期:2014-10-10
TP216
:A
:1004-1699(2014)12-1589-07
10.3969/j.issn.1004-1699.2014.12.001

