慢性阻塞性肺疾病大鼠外周血及支气管肺泡灌洗液中CCR6、CCR7的变化及意义
遵义医学院附属医院呼吸一科,贵州 遵义 563099
慢性阻塞性肺疾病大鼠外周血及支气管肺泡灌洗液中CCR6、CCR7的变化及意义
孙得胜欧阳瑶顾延会
遵义医学院附属医院呼吸一科,贵州 遵义 563099
目的了解树突状细胞的趋化因子受体CCR6、CCR7在COPD大鼠外周血和支气管肺泡灌洗液(BALF)中的变化。方法选用20只健康Wistar大鼠,随机分为正常对照组(10只)、COPD模型组(10只),采用两次气道内注入细菌内毒素脂多糖(LPS)和连续被动吸烟4周的方法建立COPD大鼠模型。第28天处死两组大鼠。取大鼠肺脏组织用石蜡包埋HE染色以观察肺组织病理学改变,酶联免疫法(ELISA)检测BALF及外周血中CCR6、CCR7的含量。结果COPD模型组大鼠一般状况较正常对照组大鼠差,体重显著减轻模型组(242.31±14.71)g,对照组(324.18±12.89)g,差异具有统计学意义P<0.05),HE染色提示慢性阻塞性肺疾病的特征性病理改变。BALF中CCR6含量在COPD模型组(105.81±2.73)ng/L明显高于正常对照组(43.57±5.51)ng/L,差异具有高度统计学意义(P<0.01),CCR7的含量在COPD模型组(10.40±3.07)ng/L低于正常对照组(41.73±7.40)ng/L,差异具有高度统计学意义(P<0.01)。两组大鼠外周血中CCR6含量模型组(264.89±45.34)ng/L,对照组(311.12±29.78)ng/L、CCR7含量模型组(73.77±29.71)ng/L,对照组(56.42±15.30)ng/L均无统计学差异(P>0.05)。结论COPD大鼠肺组织病理符合人COPD特征性病理改变,提示COPD大鼠模型建立成功。树突状细胞趋化因子受体CCR6在COPD大鼠肺部明显增多,而成熟树突状细胞趋化因子受体CCR7在COPD大鼠肺部减少。
慢性阻塞性肺疾病;CCR6;CCR7
现代研究认为慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的发病与肺部对卷烟烟雾等有害气体或有害颗粒的异常炎症反应有关[1]。导致这种炎症发生的确切机制目前还不十分清楚,但已有研究证实在此过程中免疫细胞被募集到肺[2]。COPD中的免疫应答至少部分地被特定的抗原所驱使[2-4],这些免疫应答过程在树突状细胞(dendritic cell, DC)的严密调控下完成[5-6]。气道DC环绕气道形成一个高度敏感的“哨兵式”网络系统,它们在气道能从完好的上皮组织移行到被外来抗原侵袭的地方[7],受到信号刺激的DC表面受体介导了这一过程[8]。在摄取抗原之后,DC迁移到局部引流淋巴结,并把抗原信息提呈给特定的T淋巴细胞,这些T细胞组织了对抗外来抗原的炎症反应[5]。在迁移的过程中,DC上调了其细胞表面共刺激分子的表达——这一过程也称为DC的成熟[9]。DC的顺利迁移是趋化作用的结果,它得益于DC趋化因子受体的表达[10]以及它们与相应的趋化因子间的相互作用。
趋化因子 (chemokine)是一类能够使细胞产生趋化运动的低分子量细胞因子,它们由不同类型的细胞所分泌,在正常和非正常生理状态下都发挥着重要作用[11],与机体的免疫和炎症反应有着密切的关系[12]。CCL20是未成熟树突状细胞 ( immature DC, iDC ) 的主要趋化因子,在把iDC募集到上皮组织的过程中发挥着关键作用。当气道发生炎症反应的时候,在炎症介质的刺激作用下,表达于气道上皮的CCL20大量增加[13-14]。趋化因子受体( chemokines receptors ) 是能够特异性结合趋化因子的跨膜G蛋白偶联受体,通过与其配体的结合在体内发挥着多种生物学作用[11]。CCR6是CCL20的唯一受体[13],它们两者之间的相互作用被认为是 iDC被募集于气道的一个可能的重要机制。CCR7是成熟DC ( mature DC, mDC )完成抗原提呈从而激活初始T细胞的主要受体[10],在DC的迁移、归巢中起着关键作用。CCR7在与其配体CCL19、CCL21的作用下[11],引导mDC迁移至淋巴结。
本研究通过卷烟烟雾刺激和向大鼠气道内注入少量LPS制备大鼠COPD模型,观察CCR6、CCR7在大鼠外周血和支气管肺泡灌洗液(BALF)中的含量,探讨DC趋化因子受体在COPD发病中的表达变化和意义。
1 材料与方法
1.1 实验动物、主要试剂和材料 20只健康雄性Wistar大鼠,体重(200±20)g。购买于第三军医大学大坪医院实验动物中心,合格证号为:[SCXK(渝)2007-0005]。脂多糖(E.coli 055:B5,美国Sigma公司),大鼠趋化因子受体6 ELISA试剂盒(上海西唐生物科技有限公司),大鼠趋化因子受体7 ELISA试剂盒(上海西唐生物科技有限公司),卷烟(黄果树牌,烟气烟碱量1.0mg焦油含量11mg 贵州中烟工业有限公司)。
1.2 模型制备 把20只大鼠随机分为两组:正常组(10只)、COPD组(10只)。参考宋一平等的方法并在此基础上略作改进制作大鼠COPD模型[15]:模型组大鼠于第1、15d气道内注入200μg/200μL LPS溶液;第2~28d(第15d除外)于自制熏烟箱(由有机玻璃制成,30cm×40cm×90cm,箱顶端有直径1.5cm大小的圆形通气孔,箱中央自下往上设有两排铁丝网,两排铁丝网之间的箱子底部放置卷烟)内被动吸烟30 min×12支/次,2次/d,每日2次被动吸烟造模操作之间间隔2 h,使其呼吸新鲜空气。正常组不予特殊处理,呼吸新鲜空气。饲养方法与对照组相同。模型组大鼠注LPS的当天给予正常饲养,使其呼吸新鲜空气,不予被动吸烟。
1.3 标本采集 第28 天分别选取正常对照组、COPD模型组大鼠在其清醒的状态下,用直径1mm的毛细吸管穿刺内毗球后静脉丛血管,采集血液1ml,用于ELISA检查。腹腔注射10%水合氯醛(3.5ml/100g)麻醉,大鼠麻醉成功后仰卧位固定于事先备好的大鼠固定板上,手术开腹,充分暴露腹腔,用采血针穿刺腹主动脉并连接负压采血管放血处死大鼠。同时开胸,迅速结扎右侧肺,剪取右侧肺下叶肺组织约1cm×1cm×1cm大小,立即置于4%多聚甲醛中固定(固定时间不超过24 h),以备用于石蜡标本及病理切片的制作,并利于下一步进行肺组织切片HE染色以及免疫组化实验。取右肺上叶标本放入低温冷冻管里,并立即放入液氮中冷冻保存备用。继续手术充分暴露出大鼠的颈部气管,在气管的下段作一个倒“T”字形切口,由上向下以内径1mm大小的塑料管行气管插管,缓缓注入5ml 4℃生理盐水,轻轻按摩膨胀的肺脏约5min,回抽后再注入,如此反复灌洗3次(支气管肺泡灌洗液总回收率>80%),将回抽的灌洗液注入15ml的塑料离心管中(离心管置于冰盒里),此即为BALF标本,用于ELISA检查。
1.4 指标检测 光学显微镜下观察各HE染色的切片,使用计算机图像分析软件IPWin32图像采集系统对各HE切片进行图像采集。用ELISA法测定BALF及外周血中CCR6和CCR7的含量。
1.5 统计学方法 采用SPSS 17. 0统计软件进行数据分析,实验结果用表示,两组间样本均数比较进行t检验,以P<0.05认为差异有统计学意义。
2 结果
2.1 各组大鼠一般状况的观察 正常对照组的大鼠一般状况比较好,活泼好动,毛发的光泽度比较好,呼吸平稳规则,体重增长比较迅速。COPD模型组的大鼠毛发渐渐失去光泽,活动减少,神情倦怠,体重增长缓慢,第7d起出现倦怠、咳嗽以及呼吸幅度加深等表现,而且上述表现逐渐明显、加重,在实验的后期稍微活动即出现气促等症状。第28天 COPD模型组大鼠体重(242.31±14.71)g,低于正常对照组(324.18±12.89)g,差异具有高度统计学意义(P<0.01)。
2.2 大鼠肺脏组织的大体标本的肉眼观察 正常对照组大鼠的肺脏组织无肿胀或出血,外观有光泽,呈粉红色。COPD模型组大鼠的肺组织明显肿胀,亦未见出血或渗出物,但其表面可见囊泡状突起,外观光泽度较差,呈灰白色。
2.3 大鼠肺脏组织的病理学特点 正常对照组:光镜下(见图1)小支气管未见炎性细胞浸润及腺体,肺泡壁完好,肺泡结构完整连续。COPD模型组第28天:光镜下(见图2)见肺泡隔增宽,伴有淋巴细胞、单核细胞及中性粒细胞浸润,隔内见毛细血管扩张充血,部分肺泡隔变窄、断裂并融合。


2.4 各组大鼠的外周血和BALF中CCR6的含量(ng/L) 用ELISA法分析两组大鼠的外周血中CCR6的含量,结果显示CCR6含量在COPD模型组中(264.89±45.34)与正常对照组(311.12±29.78)相比,差异没有统计学意义(P>0.05)。用ELISA法分析两组大鼠的BALF中CCR6的含量,结果显示CCR6含量在COPD模型组中(105.81±2.73)高于正常对照组(43.57±5.51),差异有高度统计学意义(P<0.01)。
2.5 各组大鼠的外周血和BALF中CCR7的含量(ng/L) 用ELISA法分析两组大鼠的外周血中CCR7的含量,结果显示CCR7含量在COPD模型组中(73.77±29.71)与正常对照组(56.42±15.30)相比,差异没有统计学意义(P>0.05)。用ELISA法分析两组大鼠的BALF中CCR7的含量,结果显示CCR7含量在COPD模型组中(10.40±3.07)低于正常对照组(41.73±7.40),差异有高度统计学意义(P<0.01)。

表1 各组大鼠外周血及BALF中CCR6的含量(ng/L)
注:与正常对照组相比,*P<0.01。
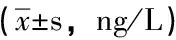
表2 各组大鼠外周血及BALF中CCR7的含量
注:与正常对照组相比,*P<0.01。
3 讨论
COPD是一种可防治的常见疾病,其特征为持续存在的气流受限,气流受限呈进行性发展,伴有气道和肺对有害颗粒或气体所致慢性炎症反应增加[16],其本质是发生于气道的慢性非特异性炎症性疾病。研究人员在COPD的病灶里发现了DC的存在,并且还发现其数量和功能均发生了改变,这些发现提示了COPD的发病机制可能与DC有关。
现在认为COPD的发病受遗传因素和环境因素的双重作用。在环境因素里,吸烟和感染被大家认为是最主要的两个因素。我们以被动吸烟和向大鼠的气道内注入LPS模拟这一病理过程建立大鼠COPD模型,28天后COPD模型组大鼠出现活动能力降低、毛发失去光泽、咳嗽以及呼吸道分泌物增加等,病理学检查结果与文献报道一致[13],符合COPD病理的典型表现,提示模型制备成功。
DC的功能和趋化因子介导的体内迁移密切相关,藉着迁移使DC有效地把所捕获的抗原提呈给初始T 细胞并使之活化和分化,进而使机体产生免疫应答作用[10]。 在前言中我们已经提到CCL20是iDC的主要趋化因子,在把iDC募集到上皮组织的过程中起重要的作用,已有研究显示COPD患者气道上皮的CCL20表达增加[14]。 CCL20是CCR6的配体,它们两者之间的相互作用很可能是 iDC被募集到气道的一个重要机制。
CCR7是成熟DC ( mature DC, mDC )完成抗原提呈从而激活初始T细胞的主要受体[10],在DC的迁移、归巢中起着关键作用。目前认为外周的DC都是通过淋巴组织趋化因子作用于CCR7这条途径来实现向淋巴组织迁移的[17]。
本研究使用ELISA的方法检测各组大鼠的支气管肺泡灌洗液(BALF)以及外周血中CCR6、CCR7的含量。
研究结果显示, BALF中CCR6的含量在COPD模型组高于正常对照组(P<0.01)。而外周血中CCR6的含量没有显著的差异(P>0.05)。
多项研究表明COPD的发病可能与DC在肺脏局部的增多有关[18-19],而这种增多极可能因外周血中的一部分iDC被趋化到肺脏。这一趋化过程的完成有赖于iDC的趋化因子CCL20和iDC的趋化因子受体CCR6的结合[14]。当气道发生炎症反应的时候,在炎症介质的刺激下,表达于气道上皮的CCL20大量增加[13],故而在COPD者的肺脏局部CCL20也是明显增加的,我们课题组前期的临床和动物实验也证实了这一点[20-22]。作为与DC紧密相连的CCR6可看做DC自身结构的一部分,在肺脏局部大量CCL20的吸引下,血液中的部分CCR6带动iDC从它们的储备库外周血向肺组织迁移[23],从而造成肺脏局部DC和CCR6的显著增多。
BALF 测定结果显示引导mDC向淋巴结迁移的CCR7的含量在COPD模型组低于正常对照组(P<0.01)。Bratke等的研究也得到类似的结果,他们发现与不吸烟者相比,吸烟者BALF中CCR7呈低表达,并且其表达程度与气道受限的严重程度呈负相关[24]。
本实验中两组大鼠外周血中CCR6、CCR7的含量均没有显著差异(P>0.05),可能是因为在肺脏局部发生变化的这部分DC的数量与外周血中的DC的总量相比,常常显得微乎其微。
综上所述,本实验提示COPD模型组大鼠血液中部分iDC可能在CCR6作用下,被趋化到肺,造成模型组大鼠肺部DC增多。同时,我们还发现COPD模型组的大鼠肺脏局部mDC的趋化因子受体CCR7减少,这提示COPD的发病也可能与肺脏局部mDC在CCR7的引导下向局部引流淋巴结迁移有关,但这两者间的关联性尚需要进一步研究来证实。
[1] Rabe K F, Hurd S, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary [J]. Am J Respir Crit Care Med, 2007, 176 (6): 532-555.
[2] Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease [J]. N Engl J Med, 2004, 350 (26):2645-2653.
[3] Sullivan AK, Simonian PL, Falta MT, et al. Oligoclonal CD4+ T cells in the lungs of patients with severe emphysema [J]. Am J Respir Crit Care Med, 2005, 172 (5): 590-596.
[4] Van der Strate BW, Postma DS, Brandsma CA, et al. Cigarette smoke-induced emphysema: a role for the B cell [J]? Am J Respir Crit Care Med, 2006, 173 (7): 751-758.
[5] Vermaelen K, Pauwels R. Pulmonary dendritic cells [J]. Am J Respir Crit Care Med, 2005, 172 (5):530-551.
[6] Banchereau J, Steinman RM. Dendritic cells and the control of immunity [J]. Nature, 1998, 392 (6673): 245-252.
[7] Blank F, Rothen-Rutishauser B, Gehr P. Dendritic cells and macrophages form a transepithelial network against foreign particulate antigens [J]. Am J Respir Cell Mol Biol, 2007, 36 (6):669-677.
[8] Rossi M, Young JW. Human dendritic cells: potent antigen presenting cells at the crossroads of innate and adaptive immunity [J]. J Immunol, 2005, 175 (3):1373-1381.
[9] Tsoumakidou M, Koutsopoulos AV, Tzanakis N, et al. Decreased Small Airway and Alveolar CD83+ Dendritic Cells in COPD [J]. Chest, 2009,136 (3): 726-733.
[10] Sallusto F, Lanzavecchia A. Understanding dendritic cell and T-lymphocyte trafc through the analysis of chemokine receptor expression [J]. Immunol Rev,2000, 177 (1):134-140.
[11] 李生娇,齐岩,徐晓刚,等.趋化因子受体CCR7及配体对肿瘤生物学行为的影响[J].中国肿瘤,2003,12(12):718-721.
[12] 冯小芳,殷堞,陆允敏,等.CCL20单克隆抗体对小鼠嗯唑酮结肠炎的治疗作用[J].胃肠病学,2009,14(6): 355-358.
[13] Le Borgne M, Etchart N, Goubier A. Dendritic cells rapidly recruited into epithelial tissues via CCR6/CCL20 are responsible for CD8+ T cell crosspriming in vivo [J]. Immunity, 2006, 24(2): 191-201.
[14] Demedts IK, Bracke KR, Van Pottelberge G, et al Accumulation of dendritic cells and increased CCL20 levels in the airways of patients with chronic obstructive pulmonary disease [J]. Am J Respir Crit Care Med, 2007, 175 (10): 998-1005.
[15] 宋一平,崔德健,茅培英,等.慢性阻塞性肺疾病大鼠模型的建立及药物干预的影响 [J].中华内科杂志,2000,39 (8):556-557.
[16] Vestbo J, Hurd S S, Agusti A G, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary[J]. Am J Respir Crit Care Med, 2013, 187(4): 347-365.
[17] Ritter U, Wiede F, Mielenz D, et al. Analysis of the CCR7 expression on murine bone marrow-derived and spleen dendritic cells [J]. J Leukoc Biol, 2004,76 (2):472-6.
[18] 符丹丹,欧阳瑶,薛令合. CD40和CD86在慢性阻塞性肺疾病患者中的变化及意义[J].遵义医学院学报,2011,34(4): 344-347.
[19] 饶习敏,欧阳瑶,顾延会.慢性阻塞性肺疾病大鼠肺组织中树突状细胞的变化[J]. 遵义医学院学报,2013,36(5):410-412.
[20] 符丹丹,欧阳瑶,薛令合.CCL20及DCs在慢性阻塞性肺疾病患者诱导痰中的变化及意义[J].贵州医药,2011,35(5): 408-411.
[21] 顾延会,欧阳瑶.一种抑制型慢性阻塞性肺疾病大鼠的建立[J].山东医药,2011,51(48): 46-48.
[22] 顾延会,欧阳瑶,孙得胜. CCL20抗体对慢性阻塞性肺疾病大鼠外周血和肺泡灌洗液中树突状细胞表面因子表达的影响[J]. 吉林大学学报(医学版),2013,39(2):236-240.
[23] 于晴,刘军,邱海波.严重感染患者外周血中树突状细胞的变化及意义[J].中国呼吸与危重监护杂志,2010, 9(6): 647-648.
[24] Bratke K, Klug M, Bier A, et al. Function-associated surfacemolecules on airway dendritic cells in cigarette smokers [J] Am J Respir Cell Mol Biol, 2008, 38 (6): 655-660.
ExpressionsofCCR6andCCR7inperipheralbloodandBALFofratswithCOPD
SUN De-sheng, OU Yang-yao, GU Yan-hui
Department of Respiratory Medicine, Affiliated Hospital of Zunyi Medical College, Zunyi Guizhou 563099, China
ObjectiveTo investigate expressions of CCR6 and CCR7 in peripheral blood and BALF of rats with COPD.Methods20 Wistar rats were randomized into normal control group and COPD model group. COPD was induced by established cigarette smoke inhalation about four weeks and intratracheal 200μg/200μL of LPS solution twice totally. All animals were killed at the 28th day. Then pathomorphology of rats’ lung and bronchiole were investigated by HE staining. The contents of CCR6 and CCR7 in the BALF were analyzed with ELISA, so were those in the peripheral blood.ResultsRats in the COPD model group expressed lassitude and less activity, and their weight was lower than the normal control group with a significant difference(P<0.05). The HE staining result suggest that the changes of pathology of the COPD model at 28-day were the same as those of COPD patients. The contents of CCR6 and CCR7 in rats’ peripheral blood were not significantly different between the two groups. The content of CCR6 in BALF about the COPD model group was significantly increased compared with the controls (P<0.01). The content of CCR7 in BALF about the COPD model group was significantly reduced compared with the controls (P<0.01).ConclusionThe COPD rats model was established successfully by this combined methods. The expressions of CCR6 are increased in the lungs of rats with COPD, but those of CCR7 are decreased.
COPD;CCR6; CCR7
贵州省优秀科技教育人才省长专项资金项目(NO:黔省专合字[2008]62号)。
欧阳瑶,女,教授,硕士生导师,研究方向:COPD的发病机制,E-mail:ouyangyao116@sohu.com。
R563
A
1007-8517(2014)13-0056-03
2014.05.04)

