miR-181a-5p在非小细胞肺癌中抗癌机制的研究
王颖,郭人花
(1.新乡医学院第一附属医院 肿瘤内科,河南 新乡 453100;2.南京医科大学附属第一医院 肿瘤内科,江苏 南京 210029)
miR-181a-5p在非小细胞肺癌中抗癌机制的研究
王颖1,郭人花2
(1.新乡医学院第一附属医院 肿瘤内科,河南 新乡 453100;2.南京医科大学附属第一医院 肿瘤内科,江苏 南京 210029)
目的 探索miR-181a-5p的抑癌机制,探讨其是否可作为临床检测肺癌的标志物。方法 采用CCK8法检测非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞株A549细胞增殖情况;流式细胞术检测细胞凋亡;细胞划痕和Transwell实验检测miR-181a-5p对A549细胞运动的影响;利用双荧光报告基因实验和RT-PCR实验探讨miR-181a-5p与靶基因的相互作用。结果 在非小细胞肺癌细胞株A549中过表达miR-181a-5p能明显抑制A549细胞株的增殖,促进细胞的早期凋亡(P<0.05)。细胞划痕和Transwell实验结果表明miR-181a-5p能明显抑制细胞的运动(P<0.05);miR-181a-5p可通过3'UTR靶向下调Kras基因的表达,且在NSCLC中Kras表达与miR-181a-5p表达有一定关系。结论 miR-181a-5p可显著抑制NSCLC A549细胞的生物进程,是潜在的治疗NSCLC的靶标。
miR-181a-5p;增殖;迁移;凋亡;非小细胞肺癌
在肿瘤的发生发展过程中,miRNA通过调控基因表达影响细胞功能,起抑癌或促癌作用[1-2]。起抑癌作用的miRNA主要通过调控功基因来抑制细胞的增殖、迁移或促进细胞的凋亡来抑制肿瘤的发生[3-8]。
1 材料与方法
1.1 实验材料 非小细胞肺癌细胞株A549购自中科院生化细胞所细胞库。
1.2 实验仪器 FLx8酶标仪(BIO-RAD),C1000TMThermal Cycler PCR仪(BIO-RAD),TGL-18000-CR高速台式离心机(上海安亭科学仪器制造有限公司),SW-CJ-2F超净工作台(苏静安泰有限公司),SW-CJ-2F多功能脱色摇床(上海智成分析仪器制造有限公司),XW-80A漩涡混合仪(海门市其林贝尔仪器制造有限公司),JY92-11超声波细胞粉碎机(宁波新芝生物科技有限公司),PK-SZZ电热恒温水浴锅(上海精宏实验设备有限公司),PL203电子分析天平(METTLER TOLEDO上海有限公司),CFX96qRT-PCR仪(BIO-RAD),LRH-250F CO2恒温培养箱(SHELLAB),MLS-3708高压灭菌锅(SANYO)。
1.3 实验方法
1.3.1 细胞培养:非小细胞肺癌细胞株A549培养在含有10%胎牛血清、青霉素105IU/L、链霉素100 mg/L的1640和DMEM培养基中,培养基于37℃,5%CO2的细胞培养箱内培养。细胞融合到85%左右时,用0.25%胰酶消化,传代[9]。
1.3.2 细胞增殖实验:取对数生长期的细胞,以1×104个/mL的密度接种于96孔培养板中,每孔接种100μL,培养待细胞贴壁后,再分别加入miR-181a-5p、anti-miR-181a-5p,每组设置6个复孔,同时设置不受处理因素的对照组(NC),也设置6个复孔。分别培养24、48 h后,每孔加入25μL的MTT噻唑蓝,继续培养4 h后小心弃去培养液,再每孔加入150μL的DMSO,于摇床上振摇10min,充分溶解生成的结晶,然后于490 nm波长处测定各组的光吸收值(OD值),重复3次,取均值。用下面的公式计算各组药物的细胞的抑制率[10-11]:抑制率=(1-药物组OD值/对照组OD值)×100%。
1.3.3 流式细胞仪检测:按照流式细胞仪检测细胞凋亡试剂盒操作,以适量的胰酶消化、收集转染后的A549细胞,磷酸盐缓冲液洗涤、重悬细胞,2 000 r/min,5min收集(1×105)~(5×105)个细胞,离心沉淀,加入500 uL Binding Buffer重悬细胞,向重悬液中加入5 uL Annexin V-FITC染色,随后加入5 uL PI染色,室温下避光孵育15m in,流式细胞仪检测凋亡率,实验重复3次。
1.3.4 miR-181a-5p靶基因的鉴定:从A549细胞中提取总RNA,并反转成cDNA后用来作为PCR的模板,成功的得到了5种靶基因的目的片段。经割胶回收后,在37℃用相适应的限制性内切酶酶切2 h后,用T4 DNA连接酶16℃连接过夜后,转化TOP10大肠杆菌感受态细胞。挑取单克隆经扩大培养后,提取质粒,送至上海英俊生物公司测序。经序列比对无误后,用无内毒素质粒大抽试剂盒提取重组质粒。抽得重组质粒,用限制性内切酶酶切验证。
1.3.5 细胞运动实验:在显微镜载物台上静置细胞2.5 h,通过摄像头、监控仪、录像机等设备记录整个过程,然后通过图像转化和采集系统保存实验照片。用Imagine Tool和Image-Pro Plus 6.0测量每个时间点内的几何中心二维坐标,用Microsoft Excel2013XY散点图绘制细胞迁移轨迹,时间间隔为5min,每张图取5个细胞求平均数。
1.3.6 qRT-PCR分析基因表达:A549细胞,对照组转染NC,实验组转染miR-181a-5p,在mRNA水平检测miR-181a-5p对靶基因的下调情况,靶基因里除了预测的基因,还包括文献中已经报道miR-181a-5p明确的靶基因,如 BCL2L11[12-13],但这些基因在非小细胞肺癌中并未验证,而是在其它癌症中做过相关研究,引物来源于哈弗医学院的引物库 (http://pga.mgh.harvard.edu/primerbank/)。
2 结果
2.1 miR-181a-5p抑制细胞增殖和克隆形成 细胞克隆实验结果显示:上调miR-181a-5p会显著抑制细胞株A549的增殖(图1A),细胞用结晶紫染料染色。通过qRT-PCR检测细胞转染效率,发现miR-181a-5p将近上调了40倍(图1B)。细胞转染miR-181a-5p后增殖能力低于转染NC的对照组,而转染antimiR-181a-5p的实验组对比NC增殖能力有所提升(图1C、D)。软琼脂实验中,对比NC,过表达miR-181a-5p抑制了细胞克隆的形成,细胞克隆的数量和大小均有显著的差异(P<0.05,图1E,F),这几个实验证明了过表达miR-181a-5p对A549细胞增殖具有抑制作用。

图1 miR-181a-5p对A549细胞增殖的影响Fig.1 Effect ofmiR-181-a-5p on A549 cell proliferation
2.2 miR-181a-5p对细胞凋亡的影响 流式结果表明:实验组在转染miR-181a-5p 48h后早期凋亡提高了6.37%(见图2)。说明miR-181a-5p表达上调促进了细胞的早期凋亡。

图2 miR-181a-5p对A549细胞凋亡的影响Fig.2 Effect ofmiR-181-a-5p on A549 cell apoptosis
2.3 过表达miR-181a-5p对A549细胞的运动和迁移的影响 细胞划痕法结果表明细胞转染miR-181a-5p后细胞迁移率显著降低,只有大约18%,而细胞转染anti-miR-181a-5p后具有较高的运动水平,细胞迁移率接近45%(图3A、3C)。Transwell实验结果显示与对照组NC相对比,实验组穿过Transwell小皿的细胞数量在转染miR-181a-5p后显著减少,约为75个细胞(图3B、3D)。表明转染miR-181a-5p的A549细胞的迁移受到了显著的抑制(P<0.05)。
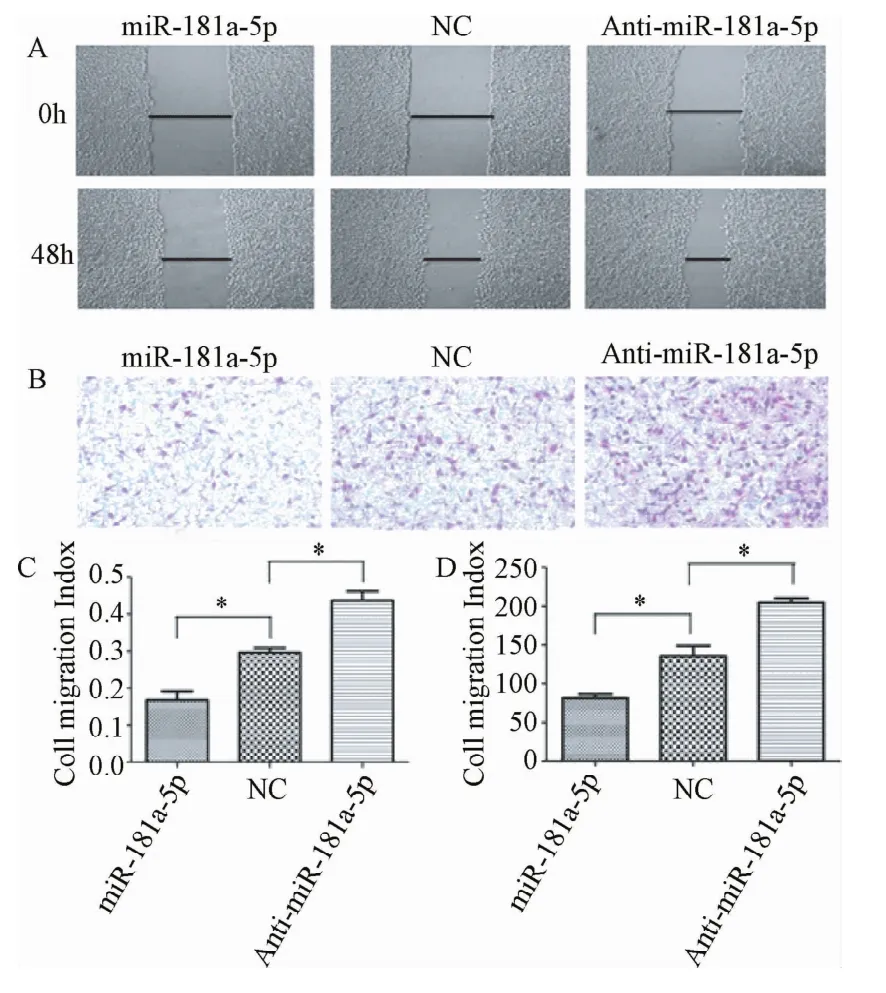
图3 miR-181a-5p对A549细胞运动的影响Fig.3 Effect ofmiR-181-a-5p on themovement of A549 cell
2.4 miR-181a-5p靶基因的鉴定
2.4.1 PCR产物连接载体:载体酶切位点信息(见图4),酶切后对比片段大小。

图4 PGL3载体上酶切位点及相关信息Fig.4 PGL3 vector restriction sites and related information
2.4.2 双荧光报告基因分析:重组载体与miR-181a-5p的mimics共转染HEK-293T细胞48 h后,分别检测各组海肾荧光素酶和萤火虫荧光素酶的活性,以转入NC和重组质粒的作为对照组。结果表明5种靶基因的3'-UTR均受到了miR-181a-5p的调控,其中以Kras和PLAG1受到的调控最为明显,相比转入NC的对照组显著下降了50%左右,其中的Kras因为在3'-UTR发现2个结合位点,因此在克隆Kras时共克隆了3个载体,第一个载体含有miR-181a-5p的第一个结合位点,第二个载体上的片段含miR-181a-5p的另一个结合位点,第三个载体连上的片段包含有miR-181a-5p结合的2个位点(见图5)。从结果可以看出这些基因的3'-UTR受到miR-181a-5p的调控,而Kras基因的2个位点都有不同程度的下调,同时包含有2个结合位点的载体比其中任何一个都较为明显,推测这2个结合位点都是有效的。
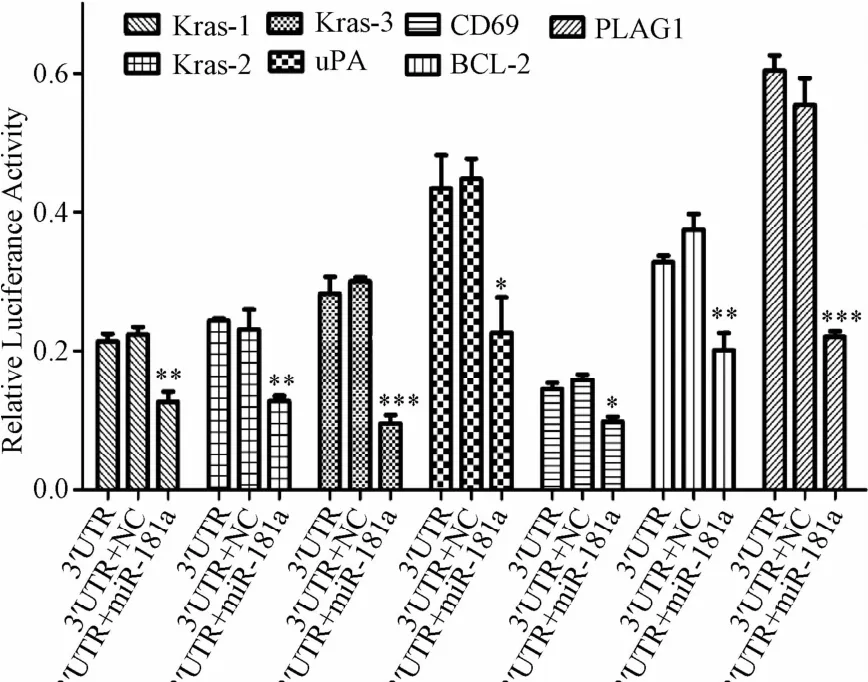
图5 miR-181a-5p与其可能的靶基因的荧光实验结果

图6 miR-181a-5p过表达对靶基因mRNA水平的影响
2.4.3 qRT-PCR分析转染miR-181a-5p后基因下调情况:本实验结果显示在这些靶基因中Kras的mRNA下调情况最为显著(图6A),而原先在乳腺癌中报道的BCL2L11为miR-181a-5p的靶基因,在非小细胞肺癌中得到相反的结果,靶基因在mRNA水平反而上调了。因此,推测miR-181a-5p或BCL2L11所扮演的角色具有组织或者细胞特异性。即不同的基因在不同的组织或细胞中调控的通路或者网络存在差异性。
对照组转染NC,结果显示:和对照组相比,实验组的许多抑癌基因表达量有所上调,一些促进凋亡的基因表达量相对升高如(图6B);miR-379,miR-30a,miR-126-3p,有显著的下调,而在其它癌症中比较明确发挥抑癌功能的miR-34a的表达量显著上调,这进一步证明了miR-181a-5p调控网络的复杂性,以及在非小细胞肺癌中发挥抑癌基因的功能。

图7 miR-181a-5p通过靶向结合3'-UTR下调Kras的表达Fig.7 Expression ofmiR-181a-5p in Kras to combine 3'-UTR through the target
2.4.4 miR-181a-5p靶基因的验证:为了验证miR-181a-5p可以直接作用于Kras的3′-UTR,调控其在mRNA和蛋白水平的表达,并明确结合位点,实验已构建好的PGL3载体为模版,做载体突变实验,将载体上的miR-181a-5p的结合位点TGAATGT突变成CGGACGC如(图7A)所示,突变后的位点经转录后将不能和miR-181a-5p结合。突变采用传统的引物隔花突变,隔一个碱基做一个突变,突变采用高保真酶进行,PCR后的产物因为有原来大抽的载体,即实验中作为模版的载体和PCR的突变产物载体,因此需要去除原来未突变的载体。大抽的载体因为在菌体里有经过甲基化,而PCR的突变载体没有甲基化,所以我们可以在整个产物中加入甲基化酶来破坏原有的模版载体,再进行转化和测序,并进行荧光实验验证,结果如图7B所示。然而,内源的Kras在蛋白水平是否受到miR-181a-5p的调控?如图7C所示,转染miR-181a-5p的实验组 Kras的蛋白水平下调了将近75%,而转染anti-miR-181a-5p的实验组和NC相比也有显著的区别。因此,本实验证明了miR-181a-5p可以在mRNA和蛋白水平对靶基因Kras进行调控。
2.4.5 DNA甲基化对miR-181a-5p表达的影响:采用甲基化酶抑制剂处理A549细胞,发现miR-181a-5p的转录水平显著提升(见图8),推测未加甲基化酶抑制剂的对照组受到甲基化酶的调控,影响miR-181a-5p的表达,而Kras作为 miR-181a-5p靶向调控的基因,在miR-181a-5p表达水平上升时发生下调也是合理的。

图8 加入甲基化酶抑制剂后miR-181a-5p和Kras的表达Fig.8 Expression ofmiR-181a-5p and Kras after added methylation enzyme inhibitor
3 讨论
本研究证明了miR-181a-5p和Kras存在负相关的关系,miR-181a-5p在A549细胞株中发挥抑癌基因的功能,在病例样本中,病人的年龄以及癌症的恶性程度越高,相应的miR-181a-5p表达量比较低。而Kras则随年龄和恶性程度的升高而表达量上升。细胞株中miR-181a-5p的表达量普遍显著下调。之前报道[14-15]的乳腺癌中miR-181a可以下调BCL2L11并发挥抑癌基因的功能,但在A549中过表达miR-181a-5p后BCL2L11却出现上升的情况,因此推测基因具有组织或细胞特异性。细胞癌化到一定阶段往往具有迁移性,从而导致肿瘤的扩散。起抑癌作用的miRNA可能通过调控一些基因,影响细胞的迁移,细胞迁移也是癌症进程的一项重要指标。本实验运用两种相类似的方法共同验证miR-181a-5p对细胞迁移的影响。此外,miR-181a-5p对其它miRNA也有调控作用,miR-34a在转染miR-181a-5p后有显著的上调。通过这些实验暗示了miR-181a-5p在非小细胞肺癌中能影响多样的细胞进程,通过靶向基因调控发挥作用。
DNA甲基化是一种表观遗传修饰,在甲基转移酶的催化下,S-腺苷甲硫氨酸提供甲基,选择性地添加甲基到DNA的CG两个核苷酸,形成5-甲基胞嘧啶。基因的启动子区CpG岛在正常情况下一般是非甲基化的,当发生甲基化时,时常发生基因的转录沉寂,使一些抑癌基因丧失功能,从而导致正常的细胞调控失常,与肿瘤的发生、发展密切相关。本研究结果显示miR-181a-5受到甲基化调控。
肿瘤的治疗还需要解决一些技术问题,需要选择合适的给药载体和给药方式使药物可以准确地送达病灶。除了技术问题我们还应顺着调控网络追溯到源头,鉴定miRNA的启动子及转录调控因子,相信随着新技术的不断发展,这些机制将会向我们揭开神秘面纱,使miRNA应用到各类疾病的应用和治疗中。
[1] Rana TM.Illuminating the silence:understanding the structure and function of smalRNAs[J].Nat Rev Mol Cell Biol, 2007, 8(1):23-29.
[2] Ahn HW,Morin RD,Zhao H.MicroRNA transcriptome in the newborn mouse ovaries determined bymassive parallel sequencing[J].Mol Hum Reprod, 2010, 16(7):463-471.
[3] Donnem T, Lonvik K, Eklo K.Independent and tissue-specific prognostic impact of miR-126 in nonsmall cell lung cancer:coexpression with vascular endothelial growth factor-A predicts poor survival[J].Cancer, 2011, 117(14):3193-3200.
[4] Lee RC,Feinbaum RL, Ambros V.The elegans hetero chronic gene lin-4 encodes small RNAs with antisense COB-plementarity to lin-14[J].Cell, 1993, 75(5):843-854.
[5] Raihart BJ,Slack FJ, Basson M.The 21-nucleotidelet-7 RNA regulates development timing in Caenorhabditis elegans[J].Nature,2000,24(403)901-905.
[6] Agirre X, Jimenez-Velasco A, San Jose-Eneriz E.Down-regulation of hsa-miR-10a in chronic myeloid leukemia CD34+cells increases USF2-mediated cell growth[J].Mol Cancer Res, 2008, 6(12):1830-1840.
[7] Balatti V,Maniero S, Ferracin M.MicroRNAs dysregulation in human malignant pleuralmesothelioma[J].J Thorac Oncol, 2011, 6(5):844-851.
[8] Biggar KK, Dubuc A, Storey K.MicroRNA regulation below zero:differential expression of miRNA-21 and miRNA-16 during freezing in wood frogs[J].Cryobiology, 2009, 59(3):317-321.
[9] Cerne JZ,Stegel V, Gersak K.KRAS rs61764370 is associated with HER2-overexpressed and poorly-differentiated breast cancer in hormone replacement therapy users:a case control study[ J].BMC Cancer,2012, 12(1):105-113.
[10] De Vito C,Riggi N, Suva ML.Let-7a is a direct EWS-FLI-1 target implicated in Ewing's sarcoma development[J].PLoSOne, 2011, 6(8):e23592.
[11] Diederichs S.Non-coding RNA in malignant tumors.A new world of tumor biomarkers and target structures in cancer cells[J].Pathologe 2010, 31(Suppl 2):258-262.
[12] Marilena V.Iorio, Carlo M.Croce.MicroRNAs in Cancer:Small MoleculesWith a Huge Impact[J].JClin Oncol,2009,27(34):5848-5856.
[13] Diederichs S.Non-coding RNA in malignant tumors.A new world of tumor biomarkers and target structures in cancer cells[J].Pathologe,2010, 31(Suppl)2:258-262.
[14] Du L,Schageman JJ, Subauste MC.miR-93, miR-98, and miR-197 regulate expression of tumor suppressor gene FUS1[J].Mol Cancer Res, 2009, 7(8):1234-1243.
[15] Davidson MR, Larsen JE, Yang IA.MicroRNA-218 is deleted and downregulated in lung squamous cell carcinoma[J].PLoSOne, 2010,5(9):e12560.
(编校:吴茜)
Analysis ofm iR-181a-5p function in non-small cell lung cancer
WANG Ying1,GUO Ren-hua2
(1.Department of Internal Medicine-Oncology,The First Affiliated Hospital of Xinxiang Medical University,Henan 453100,China;2.Department of Internal Medicine-Oncology,The First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China)
Objective The aims of this study were to explore the biologic functions ofmiR-181a-5p in NSCLC and investigate whether it can be a marker for detecting NSCLC.Methods A549 cell growth and apoptosis after transfected miR-181a-5p were examined by CCK8 and flow cytometry,respectively,themovement of A549 cell were detected by Transwell assay and wound healing assay.Interaction ofmiR-181a-5p and its possible target genes were detected by dual luciferase reporter assay.Results MiR-181a-5p inhibited A549 cell proliferation,promoted cell apoptosis in vitro.Transwell assay and wound healing assay showed thatmiR-181-5p negatively regulated cellmigration in vitro.MiR-181a-5p down-regulated Kras expression by directly targeting its 3′-UTR.Kraswas inversely correlated withmiR-181a-5p expression in NSCLC.Conclusion MiR-181a-5p might provide a potential treatment approach for NSCLC patients.
miR-181a-5p;proliferation;migration;apoptosis;non small cell lung cancer
R655
A
1005-1678(2014)06-0006-05
2011年国家自然科学基金(81172217)
王颖,女,硕士,主治医师,研究方向:恶性肿瘤的综合治疗,E-mail:qch1821460017@163.com。

