CD13分子对非小细胞肺癌浸润Treg细胞免疫抑制的机制研究
王心晓,程小珍
(1.中南大学湘雅医学院附属海口医院 海口市人民医院 呼吸内科,海南 海口 570208;2.中南大学湘雅医学院附属海口医院 海口市人民医院 肿瘤科,海南 海口 570208)
CD13分子对非小细胞肺癌浸润Treg细胞免疫抑制的机制研究
王心晓1,程小珍2
(1.中南大学湘雅医学院附属海口医院 海口市人民医院 呼吸内科,海南 海口 570208;2.中南大学湘雅医学院附属海口医院 海口市人民医院 肿瘤科,海南 海口 570208)
目的 通过检测非小细胞肺癌(non-small cell lung cancer,NSCLC)组和正常对照组中CD13分子与CD4+CD25+FoxP3+Treg细胞的表达,研究CD13分子对NSCLC浸润Treg细胞免疫抑制的机制。方法 随机选取2013年6月~2014年5月间中南大学湘雅医学院附属海口医院收治的NSCLC患者160例为NSCLC组,选取同期因其他肺部疾病行手术切除的患者60例作为正常对照组。采用反转录RT-PCR和免疫组化检测2组CD13分子与CD4+CD25+FoxP3+Treg细胞的表达,并进行比较。结果 对照组中CD13和CD4+CD25+FoxP3+TregmRNA的表达均显著低于NSCLC组,差异有统计学意义(P<0.05);CD13分子在NSCLC组的表达明显多于对照组:对照组中有12例(20.0%)CD13呈阳性表达,NSCLC组患者中有131例呈阳性表达,差异有统计学意义(P<0.05);NSCLC组的CD4+CD25+FoxP3+Treg细胞表达水平(24.1±6.3)显著高于对照组(0.7±2.1),差异有统计学意义(P<0.05)。结论 CD13分子可降低组织相容性复合物Ⅱ(MHCⅡ)的粘附抗原决定簇,从而降低T细胞对肿瘤细胞表面抗原的识别能力,导致机体对肿瘤的免疫无应答或免疫耐受。这可能是CD13分子对非小细胞肺癌浸润Treg细胞免疫抑制的主要分子机制。
CD 13分子;非小细胞肺癌;Treg细胞;免疫抑制
肺癌是呼吸系统最常见的肿瘤之一,其发病率已经位居肿瘤性疾病的首位,而且还有逐年升高的趋势,肺癌已经成为当今癌症首要致死原因。其中非小细胞肺癌(NSCLC)占肺癌的85%,明确诊断时已有70%左右发展成为晚期或转移性肺癌[1-2]。大量证据显示肺癌的发生、发展与机体的免疫状态密切相关[3-4]。调节性T细胞(regulatory T cells,Treg)是一类具有免疫调节功能的T细胞亚群,研究表明只有CD4+CD25+FoxP3+T细胞具有免疫调节功能[5-6]。CD4+CD25+FoxP3+T细胞的免疫无应答和免疫抑制使得肿瘤免疫逃逸,从而抑制机体对肿瘤细胞的免疫清除[7-8]。研究发现,非小细胞肺癌患者外周血中的Treg细胞明显升高,而且Ⅲ期和Ⅳ期患者外周血中的Treg细胞水平明显高于Ⅰ期和Ⅱ期患者[9-10]。因此,调节T细胞介导的免疫抑制成为肿瘤免疫治疗的主要障碍。CD 13分子是一种细胞膜糖蛋白,又名氨基肤酶N(aminopeptidase N,APN)。研究发现CD 13分子蛋白在肿瘤细胞的表面大量表达,可以降解细胞外基质蛋白,从而参与肿瘤细胞的侵袭、转移和生长[11-12]。此外,CD 13分子能够降解白细胞介素(IL-8),从而降低机体免疫功能;降低组织相容性复合物Ⅱ(major histocompatibility complexⅡ,MHCⅡ)的粘附抗原决定簇,从而降低T细胞对肿瘤细胞表面抗原的识别能力,导致机体对肿瘤的免疫无应答或免疫耐受[13-14]。为了进一步研究CD 13分子对非小细胞肺癌浸润Treg细胞免疫抑制的机制,本课题(研究)随机选取2013年6月~2014年5月间本院收治的NSCLC患者160例和正常对照组60例作为研究对象,对2组CD 13分子和CD4+CD25+FoxP3+Treg细胞的表达进行分析比较。现报道如下。
1 资料和方法
1.1 一般资料 随机选取2013年6月~2014年5月间本院收治的NSCLC患者160例和正常对照组60例作为研究对象。其中男性130例,女性90例;年龄35~80岁,平均年龄(59.87±9.23)岁,年龄选取无显著差异。NSCLC患者纳入标准:①外科手术切除后冰冻和常规处理证实病理类型为鳞癌和腺癌;②临床无其他恶性肿瘤的证据;③近1个月未经放化疗治疗;④近3个月未使用过免疫增强剂。
1.2 材料 CD13:上游5'-TCCGGAATTCATGGCCAAGGGCTTCTATATTTC-3';下游5'-CCGGATTTAAATC-TATTTGCTGTTTTCTGTGAACCACTG-3'。 CD4+CD25+FoxP3+Treg:上游 5'-GCTGGTGCTGGAGAAGGAGAAG-3';下游5'-GTGGAGGAACTCTGGGAATGTG-3'。β-actin(内参基因)引物序列:上游 5'-GGCATGGGTCAGAAGGATTCC-3';下游5'-ATGTCACGCCACGATTTCC-CGC-3'。以上引物均由上海生工生物技术服务有限公司合成。均用焦炭酸二乙醇溶解,最终浓度为1 pmol/μL。
Trizol RNA提取试剂盒,美国Invitrogen公司公司),M-MuLV反转录酶(美国NEB公司),5 U/uL Taq DNA聚合酶(广州东盛生物科技有限公司);CD4+CD25+FoxP3+Treg细胞MACS分离试剂盒(德国美天妮公司)。
CD 13兔抗人单克隆抗体(美国Epitomics公司);兔抗人Foxp3单克隆抗体(美国Santa Cruz公司);二抗为羊抗兔免疫球蛋白(美国DAKO公司);SP免疫组化试剂盒(上海信然生物技术有限公司);DAB显色剂(北京中杉金桥公司)
1.3 方法
1.3.1 取材:标本取材后用PBS缓冲液淋洗3次,于离体20 min之内取新鲜的组织60 mg,立即冻存于-72℃冰箱。异位子宫内膜组织经HE染色后在光镜下确定异位的腺上皮和间质细胞。待检测标本于2 h之内提取总RNA,逆转录生成cDNA,置于-20℃的冰箱保存备用。其余的标本均用4%的多聚甲醛进行固定,并经乙醇脱水和石蜡包埋,再用切片机连续切片[15]。
1.3.2 RT-PCR扩增CD 13和CD4+CD25+FoxP3+Treg:具体实验操作按照RT-PCR试剂盒的说明进行,反应体系为50 uL,94℃下先预变性4min,然后按照94℃,30 s;60℃,60 s;72℃,120 s,反复进行30个循环,最后在72℃下延伸10min。取RT-PCR的产物10 uL,置于2%的琼脂糖凝胶中电泳,相对分子质量标准采用puc Mix Marker,使用凝胶扫描系统对目的基因和β-actin基因进行光密度扫描,目的基因光密度与β-actin基因光密度的比值反映该目的基因mRNA的相对表达水平。
1.3.3 免疫组化检测CD 13和CD4+CD25+FoxP3+Treg:采用免疫化学SP法进行。选择视野清晰的高倍镜视野进行观察,然后按照着色程度和着色的百分比来评分。得分标准:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞所占百分比:<5%为0分,5%~10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。结果分为4级:1~3分为阴性(-),4~5分为弱阳性(+),6~7分为中阳性(++),8分以上为强阳性(+++)。
1.4 统计学方法 采用SPSS 17.0统计学软件进行统计和分析。正态计量资料以“±s”表示,组间比较用t检验;等级资料组间比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组和NSCLC组中CD 13分子和CD4+CD25+FoxP3+Treg的mRNA表达 使用 RT-PCR法检测 CD 13和CD4+CD25+FoxP3+TregmRNA在对照组和SCLC组中的表达情况。检测结果显示,对照组中CD 13和CD4+CD25+FoxP3+Treg mRNA的表达均显著低于NSCLC组,差异有统计学意义(P<0.05,见表 1、图 1)。

表1 2组CD 13分子和CD4+CD25+FoxP3+TregmRNA表达比较Tab.1 Comparison of CD 13 and CD4+CD25+FoxP3+TregmRNA expression beween two groups
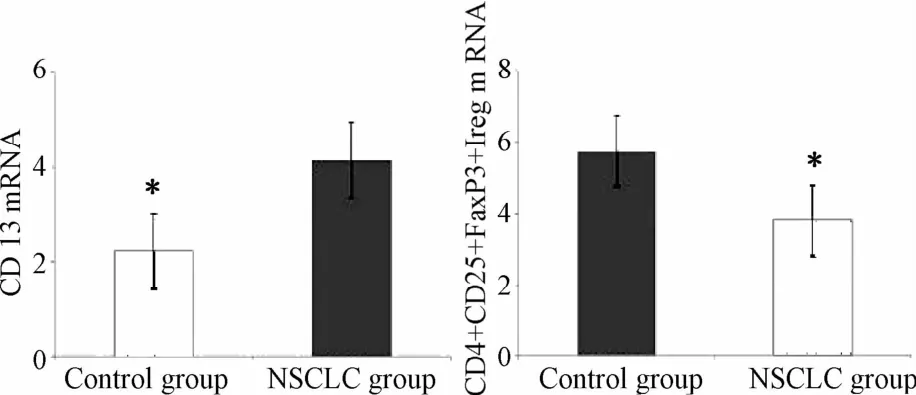
图1 2组CD 13和CD4+CD25+FoxP3+TregmRNA的表达*P<0.05,与NSCLC比较Fig.1 Them RNA expression of CD 13 and CD4+CD25+FoxP3+Treg in two groups*P<0.05,compared with NSCLC group
2.2 CD 13分子蛋白在对照组和NSCLC组中的表达CD13分子蛋白在非小细胞肺癌中表达多,在正常对照组中表达较少,见图2。由表2可知,60例对照组中CD 13蛋白阳性表达率仅为20.0(12/60),同期160例非小细胞肺癌中有131例(81.9%)CD 13蛋白呈阳性表达,明显高于对照组,差异有统计学意义(P<0.05)。

图2 CD 13分子在对照组和NSCLC组中的表达(SP,×400)Fig.2 The expression of CD 13 in NSCLC and control groups(SP,×400)

表2 CD 13分子在对照组和NSCLC组中的表达Tab.2 The expression of CD 13 in NSCLC and control groups
2.3 CD4+CD25+FoxP3+Treg在对照组和NSCLC组中的表达 镜下可见CD4+CD25+FoxP3+Treg细胞形态完整,结构清晰,散在分布于肿瘤组织中,尤其在正常组织与癌组织的交界处密集分布。由图3和表3可知,NSCLC组织中 CD4+CD25+FoxP3+Treg细胞的表达水平(24.1±6.3)显著高于正常对照组(0.7±2.1),差异有统计学意义(P<0.05)。

图3 CD4+CD25+FoxP3+Treg在对照组和NSCLC组中的表达(SP,×400)Fig.3 The expression of CD4+CD25+FoxP3+Treg in NSCLC and control groups(SP,×400)

表3 CD4+CD25+FoxP3+Treg在对照组和NSCLC组中的表达Tab.3 The expression of CD4+CD25+FoxP3+Treg in NSCLC and control groups
3 结论
人CD13基因位于染色体的15q25-26,其基因编码序列包含有20个外显子,表达受近端和远端两个启动子的调节。CD13蛋白是一种肤链端水解酶,由967个氨基酸组成,分子量150 kD左右。一般表达于肿瘤干细胞膜的表面,当肿瘤细胞自我复制增殖时,CD13分子会迁移到细胞与细胞的接触部位,通过水解基底膜的基膜和基底膜蛋白来激活信号转换通路,从而参与肿瘤细胞的生长、浸润和转移[16-17]。目前,在许多实体肿瘤中均发现了CD13的高表达。推测其在肿瘤细胞中主要起一下几种作用[18-19]:①增强肿瘤细胞的侵袭性,有利于肿瘤的转移;②促进肿瘤血管的生成,有研究发现,当外界供养不足时,血管生成因子VEGF可诱导CD13的表达,促进新血管的生成;③通过降解IL-8、MHCⅡ型粘附抗原决定簇降低T细胞对抗原的识别能力,从而加速肿瘤细胞的增值和转移,导致肿瘤细胞的免疫逃逸。研究表明,CD13抑制剂可降低肿瘤细胞的侵袭力,破坏毛细血管网的形成,延长NSCLC患者的生存期。
调节性T细胞是一类具有免疫调节功能的特殊T细胞亚群。研究表明非小细胞肺癌患者外周血CD4+CD25+FoxP3+Treg的水平显著高于健康人,进一步的研究发现NSCLC患者Ⅲ期和Ⅳ期患者外周血CD4+CD25+FoxP3+Treg的水平高于Ⅰ期和Ⅱ期患者,随着化疗病情好转后CD4+CD25+FoxP3+Treg的水平也有所下降。近年来的研究发现肿瘤抗原能够活化Treg细胞,从而抑制机体肿瘤产生免疫应答,导致肿瘤逃逸。因此,Treg细胞介导的免疫抑制成为肿瘤免疫逃逸的重要机制。
本研究组采用RT-PCR和免疫组化法检测非小细胞肺癌患者和正常对照组中CD13和CD4+CD25+FoxP3+Treg的表达。研究结果显示,NSCLC患者CD13和CD4+CD25+FoxP3+Treg的表达均明显高于正常对照组,提示非小细胞肺癌患者免疫功能失调与机体CD13和CD4+CD25+FoxP3+Treg的表达水平可能相关。这也提示是否能通过抑制体内CD13和CD4+CD25+FoxP3+Treg的水平治疗非小细胞肺癌,以提高患者的生存率。
[1] Filippi AR,Franco P,RicardiU.Is stereotactic ablative radiotherapy an alternative to surgery in operable stage I non-small cell lung cancer[J].Rep Pract Oncol Radiother,2013,19(4):275-279.
[2] Ridge CA,Solomon SB,Thornton RH.Thermal ablation of stage Inonsmall cell lung carcinoma[J].Semin Intervent Radiol,2014,31(2):118-124.
[3] Fang S,Wang Z,Guo J,et al.Correlation between EGFR mutation status and response to first-line platinum-based chemotherapy in patientswith advanced non-small cell lung cancer[J].Onco Targets Ther,2014,7(6):1185-1193.
[4] Blanco R,Maestu I,de la Torre MG,et al.A review of themanagement of elderly patients with non-small-cell lung cancer[ J].Ann Oncol,2014,7(4):268.
[5] Bayry J.Regulatory T cells as adjuvant target for enhancing the viral disease vaccine efficacy[J].Virusdisease, 2014,25(1):18-25.
[6] Darrasse-Jèze G,Podsypanina K.How numbers, nature, and immune status of foxp3(+)regulatory T-cells shape the early immunological events in tumor development[J].Front Immunol, 2013,4(8):292.
[7] Nishimoto T,Kuwana M.CD4+CD25+Foxp3+regulatory T cells in the pathophysiology of immune thrombocytopenia[ J].Semin Hematol,2013, 50(Suppl 1):S43-49.
[8] Selvaraj RK.Avian CD4( +)CD25( +)regulatory T cells:properties and therapeutic applications[J].Dev Comp Immunol,2013,41(3):397-402.
[9] Duan MC,Zhong XN,Liu GN,et al.The Treg/Th17 paradigm in lung cancer[J].J Immunol Res, 2014, doi:10.1155/2014/730380.
[10] Johannesson B,Sattler S,Semenova E,et al.Insulin-like growth factor-1 induces regulatory T cell-mediated suppression of allergic contact dermatitis in mice[J].Dis Model Mech,2014, 7(8):977-985.
[11] Cui SX,Zhang HL,Xu WF,et al.13F-1, a novel 5-fluorouracil prodrug containing an Asn-Gly-Arg(NO2)COOCH3 tripeptide,inhibits human colonic carcinoma growth by targeting Aminopeptidase N(APN/CD13)[J].Eur JPharmacol,2014,734(7):50-59.
[12] Li G,Xing Y,Wang J, et al.Near-infrared fluorescence imaging of CD13 receptor expression using a novel Cy5.5-labeled dimeric NGR peptide[J].Amino Acids,2014,46(6):1547-1556.
[13] Li B,Zheng YB,Li DD,et al.Preparation and evaluation of a CD13/APN-targeting and hydrolase-resistant conjugate that comprises pingyangmycin and NGRmotif-integrated apoprotein[J].JPharm Sci,2014,103(4):1204-1213.
[14] Dalal BI,Al Mugairi A,Pi S,et al.Aberrant expression of CD13 identifies a subgroup of standard-risk adult acute lymphoblastic leukemia with inferior survival[J].Clin Lymphoma Myeloma Leuk,2014,14(3):239-244.
[15] 王菊,熊承良,李红刚,等.宫颈癌LeLa细胞株GCNF和Oct-4诱导分化表达[J].中华肿瘤防治杂志,2014,21(15):1153-1158.
[16] Ma C,Li X,Liang X,et al.Novelβ-dicarbonyl derivatives as inhibitors of aminopeptidase N(APN) [J].Bioorg Med Chem Lett,2013,23(17):4948-4952.
[17] Hahnenkamp A,Schäfers M,Bremer C,et al.Design and synthesis of small-molecule fluorescent photoprobes targeted to aminopeptdase N(APN/CD13)for optical imaging of angiogenesis[J].Bioconjug Chem,2013,24(6):1027-1038.
[18] Schmitt C,Voegelin M,Marin A,et al.Selective aminopeptidase-N(CD13)inhibitors with relevance to cancer chemotherapy[J].Bioorg Med Chem,2013,21(7):2135-2144.
[19] Su L,Cao J,Jia Y,et al.Development of Synthetic Aminopeptidase N/CD13 Inhibitors to Overcome Cancer Metastasis and Angiogenesis[J].ACSMed Chem Lett,2012,3(12):959-964.
(编校:吴茜)
Study on themechanism of CD 13 molecule on Treg cell immune suppression of non-small cell lung cancer patients
WANG Xin-xiao1,CHEN Xiao-zhen2
(1.Department of Respiratory Medicine,Haikou City People's Hospital,Central South University Xiangya Medical College Hospital,Haikou 570208,China;2.Department of Oncdogy,Medicine,Haikou City People's Hospital,Central South University Xiangya Medical College Hospital,Haikou 570208,China)
Objective To detect the expression of CD 13 molecule and CD4+CD25+FoxP3+Treg cells in NSCLC and control groups,in order to investigate themechanism of CD 13 molecule on Treg cell immune suppression of NSCLC patients.Methods 160 cases of NSCLC patients from June 2013 to May 2014 in our hospitalwere selected,and another 60 caseswithout NSCLCwere selected as control group.The expression of CD 13 molecule and CD4+CD25+FoxP3+Treg cells in NSCLC and control groupswere detected by RT-PCR and immunehistochemistry.Results ThemRNA expression of CD 13 and CD4+CD25+FoxP3+in control group were significantly lower than that in the NSCLC group(P<0.05).The expression of CD 13 protein in NSCLC group was significantly higher than that in control group.The positive expression rate of the control group were only 20.0%(12/60),and increased to 81.9%(131/160)in NSCLC group,the differencewas statistically significant(P<0.05).The expression level of CD4+CD25+FoxP3+Treg cells in NSCLC(24.1±6.3)was significantly higher than that in the control group(0.7±2.1,P<0.05).Conclusion The CD13 molecule can reduce MHCⅡepitope,thereby reducing the recognition ability of T cells to tumor cell,leading to no response or immune tolerance of tumor cell.This the possiblemainmechanism of CD 13 molecule on Treg cell immune suppression of non-small cell lung cancer patients.
CD 13 molecuar;non-small cell lung cancer;regulatory T cells;immune suppression
R734
A
1005-1678(2014)06-0011-04
海南省卫生厅科研课题(琼卫2010-70)
王心晓,女,本科,主治医师,研究方向:呼吸临床及基础,E-mail:hnhx123456@sohu.com。

