脱氢乙酸小鼠骨髓细胞微核试验
李佳常,杜玉峰,史玉静
(1.中国药科大学药学院,江苏南京210009;2.重庆市北碚区农业委员会,重庆400700)
脱氢乙酸(Dehydroacetic Acid,简称 DHA),CAS号:520-45-6,分子式为 C8H8O4,分子量为168.15,按系统命名法为3-乙酰基-6-甲基-二氢吡喃-2,4-(3H)-二酮(3-acetyl-4-hydroxy-6-methyl-2-pyrone),结构式见图1。
DHA作为一种广谱防腐剂,被广泛应用于乳制品、饼干、面包、鱼肉制品、饮料、果蔬、泡菜、酱菜等食品的防腐保鲜。现在有不少学者提出DHA对动物机体有较大的毒副作用,人体长期服用会引起肾结石、肝脏和中枢神经系统的损伤,还可能会引起体重的减少和慢性肺水肿。目前,DHA已被列入QS认证必检项目。有些学者认为其不宜作为食品防腐剂[1]。DHA作为食品添加剂的安全性倍受争议,但目前国内外关于DHA安全性的研究却很少见。
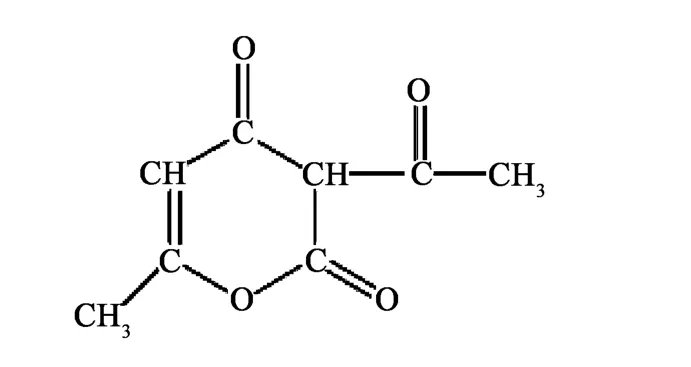
图1 DHA的化学结构式
小鼠骨髓微核试验是ICH推荐的致突变标准试验,以小鼠骨髓嗜多染红细胞中微核为评价指标,具有经济、快速、准确的特点[2~4]。微核的形成是细胞受遗传毒物作用后的一种遗传学终点,以观察细胞中微核的形成来检测遗传毒物,称为微核试验。微核试验是以动植物为材料,利用细胞生物学方法观察其出现的微核率(micronucleus rate)来表示材料受遗传损伤程度的一种检测遗传毒性的方法[5]。
本试验通过检测小鼠骨髓细胞中嗜多染红细胞(PCE)中的微核出现率来判断DHA是否具有致突变作用,为DHA作为广谱食品添加剂的安全性评价提供基本数据。
1 材料
1.1 药品及试剂 脱氢乙酸(DHA)标准品(纯度99.9%,力德士化工北京业务部,批号:20080320);羧甲基纤维素钠(CMC-Na);小牛血清,(产地:新西兰,品牌:Hyclone)。
1.2 仪器及器械 1 mL无菌注射器、灌胃针、Giemsa、手术剪、晾片架、载玻片及推片、定时钟、带油镜的显微镜、细胞计数器、培养箱、压力蒸汽消毒器、低温冰箱(-80℃)或液氮生物容器、天平(精密度0.1 g 和0.000 1 g)、菌落计数器、玻璃器皿等。
1.3 缓冲液及染色液 甲液:1/15 mol·L-1磷酸氢二钠(Na2HPO4)溶液,称取 Na2HPO4·12H2O 23.88 g,溶于1 000 mL蒸馏水。
乙液:1/15 mol·L-1磷酸二氢钾(KH2PO4)溶液,称取KH2PO49.08 g溶于1 000 mL蒸馏水。
pH 6.47磷酸盐缓冲液:取甲液30 mL和乙液70 mL混合即可。
Giemsa染液:取1.5 g Giemsa原粉,加50 mL 甘油,置于60℃温箱,约3 h后溶解。取出后加入50 mL甲醇,即为母液。使用前将母液与pH 6.47磷酸盐缓冲液按1∶10的比例混合即成工作液。
1.4 实验动物 ICR小鼠50只,SPF级,体重18~20 g,雌雄各半,购自扬州大学比较医学中心(动物合格证号:2121606)。
2 方法
2.1 染毒 按照1/10 LD50、1/5 LD50和1/2 LD50设置三个剂量组(LD50为 1 313.29 mg·kg-1),三个剂量组分别用130、260、660 mg·kg-1。三个剂量组分别配置 DHA 浓度为:1.3、2.6、6.6 mg·mL-1,按照1 mL·(10 g)-1体重给药。另设置正常对照组和环磷酰胺(CP)阳性对照组(100 mg·kg-1)。
每组10只小鼠,雌雄各半,灌胃给药,两次攻毒时间间隔24 h。在第二次灌胃后6 h,脱颈椎处死小鼠。
2.2 制片染色 取小鼠两侧股骨,剔去肌肉,用滤纸或纱布擦去血污和肌肉,剪去股骨两端。用配有6号针头的1 mL注射器吸取小牛血清0.05 mL,从股骨上端开口处冲洗骨髓腔数次,将冲洗物从股骨下端开口处滴在载玻片上。将载玻片上的冲洗物调匀后,推片。迅速干燥,可在酒精灯上短时烘烤。
将干燥的涂片置于甲醇中固定5~10 min,取出晾干。用1∶10的吉姆萨-磷酸盐缓冲液(pH 6.47)染色20 min。用蒸馏水冲洗,干燥,待检。
2.3 镜检及PCE微核细胞计数 油镜下,PCE呈灰蓝色,成熟的正染红细胞(NCE)呈粉红色。计数每只小鼠1 000个PCE中的微核细胞数,计算微核率。公式为:PCE微核率=有微核的PCE总数/检查PCE数×100%,微核率以‰表示。另外计数200个红细胞中的PCE和NCE数,求出PCE/NCE的值。
2.4 微核试验结果判定 数据采用SPSS 13.0统计软件处理,统计学比较采用单因素方差分析。
若微核率统计结果差异显著(P<0.05),并有剂量反应关系时判为阳性,反之则为阴性。
PCE/NCE的比值应在0.6~1.2的范围内。若比值小于0.1,则表示PCE形成受到严重抑制;若比值小于0.05,则表示受试物剂量过大,试验结果不可靠。
3 结果
各试验组PCE/NCE值在正常范围内,所以结果是可靠的。表中各组经方差分析得出:与正常对照组微核率相比,130 mg·kg-1和 260 mg·kg-1剂量差异不显著,660 mg·kg-1剂量组有显著差异(P<0.05),本次试验没有剂量依赖性关系;阳性对照组微核率与正常对照组及各剂量组相比均有显著差异(P<0.05)。DHA微核试验结果判为阴性。微核率和PCE/NCE统计见表1。
表1 微核率(±s)和PCE/NCE统计

表1 微核率(±s)和PCE/NCE统计
注:与正常对照组比较,*P<0.05;与阳性对照组比较,#P<0.05
1.05 ±0.08 130 mg·kg-1 10 3.01 ±1.24# 1.07 ±0.10 260 mg·kg-1 10 2.69 ±1.39# 1.09 ±0.11 660 mg·kg-1 10 5.17 ±1.67*# 1.11 ±0.08阳性对照组 10 32.9 ±6.46*PCE/NCE正常对照组 10 1.79 ±1.19#剂量组 动物数 微核率(‰)0.99 ±0.15
4 讨论
试验结果显示:660 mg·kg-1剂量组微核率与正常对照组有显著差异(P<0.05),其他剂量组未引起显著差异,且没有明显的剂量依赖性关系,故判定脱氢乙酸小鼠骨髓细胞微核试验为阴性。笔者认为尽管本次实验结果判定为阴性,但脱氢乙酸作为被广泛应用的食品添加剂,其安全性与人民群众的健康息息相关,因此有必要进一步对其安全性做更全面的评价。
[1]骆萌.脱氢醋酸及其相关化合物生产技术[J].化工中间体,2004,1(7):33 -34.
[2]傅鹏,张宗鹏.新药评价中遗传毒性试验方法学研究及其发展趋势[J].天津药学,2004,16(5):43-46.
[3]黄芳华.ICH遗传毒性标准试验组合的最新要求[J].药物评价研究,2009,32(1):10 -12.
[4]黄芳华.ICH遗传毒性结果评价和追加试验策略指导原则介绍[J].药物评价研究,2009,32(2):81 -83.
[5]李宏.微核试验的研究进展[J].安徽农业科学,2009,37(7):2864-2866.

