紫杉醇-顺铂联合药物控释系统对肺腺癌细胞系A549细胞生长的抑制作用
崔 永 柳明亮 吴炳群 段新春 龚 民
(首都医科大学附属北京友谊医院胸外科,北京100050)
肺癌的发病率及病死率均为恶性肿瘤的第一位,非小细胞肺癌(non-small cell lung cancer,NSCLC)占80%以上,总体预后不佳。化疗是一种重要的治疗方法。为提高化疗疗效同时降低不良反应,需要提高药物的局部浓度、延长药物作用时间并增加针对淋巴系统的靶向性。静电纺丝法制备载药纤维构建给药系统(drug delivery system,DDS)药物包封率高、稳定性好,而且能够实现控释给药及植入给药,已成为研究的热点。既往制备纺丝载药纤维面临的困难主要是药物释放速率的控制和多药联合载药。本研究采用静电纺丝技术,制备了聚碳酸亚丙酯(poly propylene carbonate,PPC)为药物载体的紫杉醇(Taxol)、顺铂(cisplatinum)两药联合控释系统(TP-DDS),得到微米甚至纳米级的载药纤维膜。本研究的主要目的是观察该系统对体外培养的肺腺癌细胞系A549细胞的抑制作用。
1 材料和方法
1.1 试验材料
人肺腺癌细胞系A549,由首都医科大学药学系实验室提供,属传代细胞系,可稳定传代培养。紫杉醇标准品购自胜天宇生物科技有限公司;顺铂购自齐鲁制药有限公司;PPC购自内蒙古蒙西高新技术集团有限公司;左旋聚乳酸(PLLA),相对分子质量50万,购买于山东医疗器械研究所;海藻酸钠、乙腈、氯化钙购买于北京化学试剂有限公司。试验所需各种空白或载药纤维膜均由清华大学高分子实验室制备。
1.2 试验方法
1.2.1 细胞培养
从液氮罐中取出A549细胞冻存管,在经紫外线照射消毒20 min的37℃温水中融化;1 000~2 000 r/min,3~5 min离心;在无菌操作台中以75%的乙醇彻底擦拭冻存管后,用1 mL枪头去除上清液,再加入1 mL预热的细胞培养液将细胞吹散,移至25 cm2培养瓶中;补充4 mL的RPMI 1640培养基,并添加10%的胎牛血清;倒置显微镜下观察,37℃、5%CO2培养;24 h后更换新的培养液。常规传代培养。
1.2.2 分组
共分为8个组,分别为紫杉醇单药DDS、顺铂单药DDS、两药DDS、紫杉醇裸药、顺铂裸药、两药裸药、PPC空白和完全空白对照组。在各药物组中,均分别采用4个级别的药物浓度,紫杉醇分别为0.1 mg/L、0.2 mg/L、0.4 mg/L、0.8 mg/L,顺铂分别为 0.4 mg/L、0.8 mg/L、1.2 mg/L、1.6 mg/L。
1.2.3 实验干预
将细胞接种于96孔板,密度为1×104细胞/孔,将培养板置于37℃,5%CO2饱和湿度培养箱内培养;24 h后取出培养板,无菌条件下去除旧培养液,加入不同浓度的控释药物,每组分3个亚组,最终结果取平均值,并分别设置对照组,加入培养箱内继续培养;48 h后取出培养板,加入20 μL噻唑蓝,放入培养箱内继续培养;4 h后,将培养板取出,将细胞内噻唑蓝与线粒体酶发生反应后形成的紫蓝色结晶物于倒置显微镜下观察;去上清液,每孔内加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO),水平摇床振动10~15 min;用酶标仪在490 nm波长下,测定吸光度(opacity absorption,OA),计算药物对肿瘤细胞抑制率:(对照组OA值-实验组OA值)/对照组OA值。
2 结果
2.1 紫杉醇DDS和紫杉醇裸药对肺腺癌A549细胞生长的抑制作用
紫杉醇DDS对A549细胞的抑制作用明显强于紫杉醇裸药组,但两组对A549细胞抑制率并未随药物浓度升高而表现出升高的趋势。PPC空白组对A549细胞基本无抑制作用,详见图1。
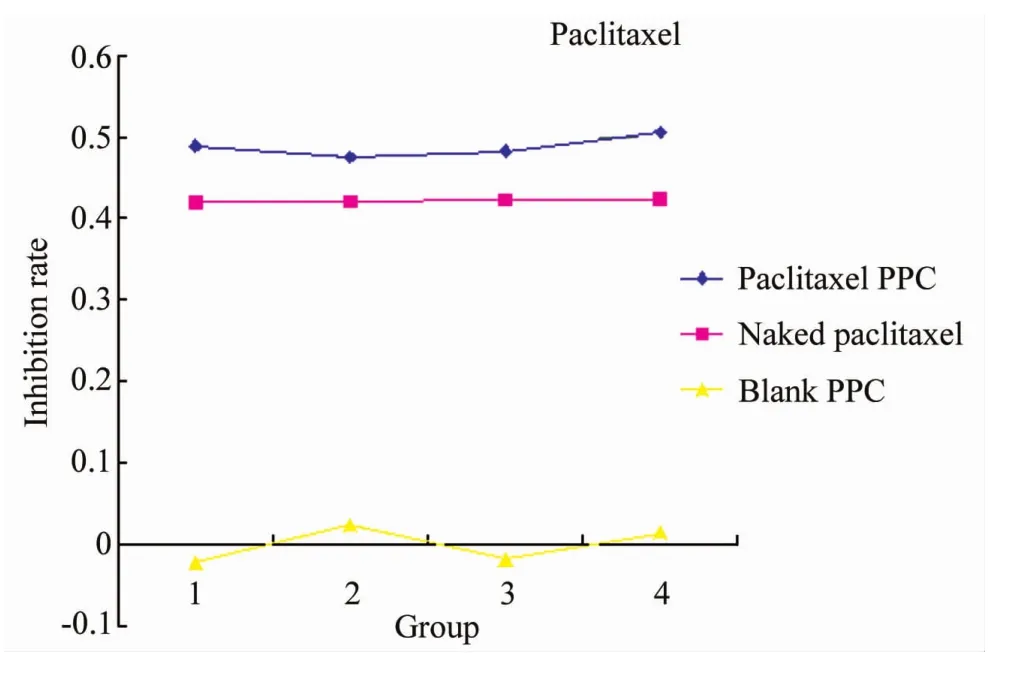
图1 紫杉醇DDS和紫杉醇裸药对肺腺癌A549细胞生长的抑制曲线Fig.1 Growth inhibition effect of taxol(DDS/naked)on A549 cells
2.2 顺铂DDS和顺铂裸药对肺腺癌A549细胞生长的抑制作用
顺铂DDS组和裸药组的细胞生长抑制作用均呈现良好的量效曲线。而且DDS组对A549细胞的抑制作用更为明显,PPC空白组对A549细胞基本无抑制作用,详见图2。
2.3 两药DDS和两药裸药对肺腺癌A549细胞生长的抑制作用
两药DDS和两药裸药对A549细胞的抑制率均随药物浓度的升高而递增。两药DDS对A549细胞的抑制作用更为明显。PPC空白组对A549细胞基本无抑制作用,详见图3。
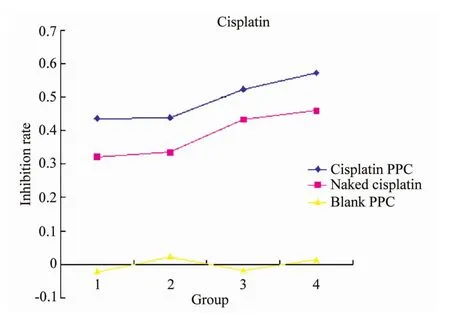
图2 顺铂DDS和顺铂裸药对肺腺癌A549细胞生长的抑制曲线Fig.2 Growth inhibition effect of cisplatin(DDS/naked)on A549 cells
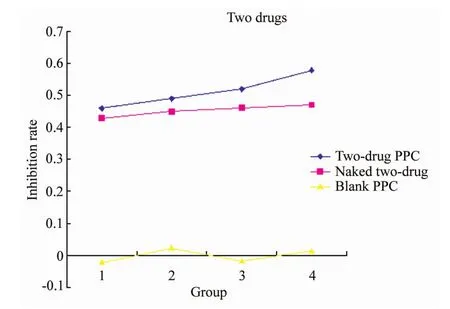
图3 两药DDS和两药裸药对A549细胞的抑制曲线Fig.3 Growth inhibition effect of two medicines(DDS/naked)on A549 cell
3 讨论
肺癌发病率和病死率均居恶性肿瘤的首位,肺癌中80%以上是非小细胞肺癌(NSCLC)[1-2]。化疗是NSCLC主要的治疗手段之一。紫杉醇+顺铂两药联合方案是NSCLC标准一线化疗方案之一。目前常规化疗用药方式是通过静脉输注的方式进行全身化疗或称系统化疗,此种给药方式难以在肿瘤局部维持足够时间和浓度,也难以进入淋巴结和淋巴管。总体而言,化疗单药有效率仅为20% ~30%,新药两药联合化疗的有效率也仅在40%左右[3]。理想的化疗药物需在肿瘤部位浓度高而正常组织浓度较低,同时能延长在肿瘤局部的作用时间。为提高对肿瘤细胞的杀伤并减少化疗的不良反应,需要提高肿瘤局部化疗药物浓度并延长作用时间。新型给药系统(drug delivery system,DDS)的研究或许可以给NSCLC化疗带来新的选择。在之前的研究[4]中笔者采用静电纺丝法,以聚碳酸亚丙酯(PPC)联合负载紫杉醇和顺铂制备了控释载药纤维。本研究的目的是验证与裸药相比,该系统在抑制肺腺癌细胞系A549方面的优势。
本实验结果显示,无论是紫杉醇或顺铂单药DDS,还是两药联合DDS,对A549细胞的抑制作用均明显强于相应的裸药组。而且,在顺铂-DDS组和两药-DDS组,肿瘤抑制率随药物浓度的增加而呈明显的上升趋势。这表明本研究制备的DDS,对体外培养的肿瘤细胞的抑制率强于裸药。
在应用静电纺丝技术制备载药纤维研究方面最早取得成功的是Baldoni等[5],他们率先制备出快速、缓慢、延时等不同释放性能的载药纤维。在抗肿瘤药物研究领域,Xie等[6]率先以可降解的聚乳酸-羟基乙酸共聚物(PLGA)纤维负载紫杉醇制备出直径在数十纳米至十微米的纤维毡,紫杉醇的负载率达90%以上,体外释放试验证实紫杉醇缓慢释放可达60余天。随后他们又负载顺铂制备出芯鞘结构的微粒,顺铂释放时间分别达到35 d和75 d(顺铂其他剂型的缓释药物释放时间不超过14 d),其体外毒性实验均优于顺铂裸药。Xu等[7]以可降解材料聚乙二醇-聚乳酸(PEG-PLLA)负载卡氮芥(BCNU)纺丝成控释给药系统,在体外细胞毒性实验中,对脑胶质瘤细胞的杀伤作用,BCNU裸药仅维持48 h,而负载BCNU的PEGPLLA可以维持72 h以上。
Chen等[8]以聚乳酸为载体,采用电纺法负载二氯二茂钛(titanocene dichloride)制备出纳米纤维,对人肺癌细胞系spca-1行毒性实验,结果显示:当二氯二茂钛浓度为 40、80、160、240 mg·L-1时,其对细胞的抑制率分别为11.2%、22.1%、44.2%、68.2%。Xie等[9]采用混合电纺的方式以聚乳酸聚丙烯(PELA)制备出负载羟喜树碱(HPCT)的纳米纤维,率先应用共纺物2-羟乙基-β-环糊精作为增溶剂,使不溶性、含有不稳定内酯环的HPCT在电纺纤维中具有较高的浓度,并调控其释放速度。在细胞毒性试验中,该药物对于乳腺MCF-7细胞系的毒性较HPCT裸药提高了7倍,在植入性化疗药物领域具有较好前景。Luo等[10]以不耐酸的 PBELA负载 HPCT纺丝(瘤体内通常为酸性环境),在 pH等于6.8时对HepG2肝癌细胞的杀伤作用为pH等于7.2时的6倍。Amna等[11]以 PLGA负载喜树碱/三氧化二铁PCT/Fe2O3)制备出复合纤维毡,该纺丝药物对鼠成肌细胞瘤C2C12也表现出了显著的抑制作用。
在肿瘤化疗时常应用两药或多药联合化疗方案,而将两药同时电纺可降低纺丝成本,并可更好体现联合化疗的优势。其中一个难题是亲水性药物与疏水性药物难以形成均一结构。Xu等[12]将亲水性的阿霉素与疏水性的紫杉醇混合后高速搅拌形成水包油型乳液(W/O),电纺形成含有两药的纺丝物,细胞毒性实验显示:两药共纺物较单药者对C6胶质瘤具有更明显的抑制作用,其动物试验尚在研究之中。紫杉醇属细胞周期特异性药物,对G2晚期和M有效,水溶性差,其溶媒是导致严重过敏反应的主要原因。顺铂水溶性好,属细胞周期非特异性药物[13-14]。PPC是二氧化碳和环氧丙烷的交替共聚物,具有完全可生物降解能力以及良好的生物相容性,是目前材料医学领域的常用材料,也是静电纺丝领域的研究热点[15]。
静电纺丝法制备控释载药纤维已成为目前的研究热点,该方式结合控释给药与局部给药的双重优势,可以减少给药间隔、维持解剖靶向区域的高药物浓度并降低化疗不良反应,具有较大的研究应用潜能。本研究证实前期制备的紫杉醇-顺铂-DDS,对体外培养的肿瘤细胞的抑制率强于裸药,为进一步的体内试验奠定了基础。
[1] 赵平,陈万青,雷正龙,等.2010中国肿瘤登记年报[M].北京:军事医学科学出版社,2011.
[2] 赫捷,陈万青,吴良有,等.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012.
[3] McElnay P,Lim E.Adjuvant or neoadjuvant chemotherapy for NSCLC[J].J Thorac Dis,2014,6 Suppl 2:S224-S227.
[4] Qi H,Hu P,Xu J,et al.Encapsulation of drug reservoirs in fibers by emulsion electrospinning:morphology characterization and preliminary release assessment[J].Biomacromolecules,2006,7(8):2327-2330.
[5] Baldoni J M,Ignatious F.Electrospun pharmaceutical compositions[J].EP:1251829 A4,2001.
[6] Xie J,Wang C H.Electrospun micro-and nanofibers for sustained delivery of paclitaxel to treat C6 glioma in vitro[J].Pharm Res,2006,23(8):1817-1826.
[7] Xu X,Chen X,Wang Z,et al.Ultrafine PEG-PLA fibers loaded with both paclitaxel and doxorubicin hydrochloride and their in vitro cytotoxicity[J].Eur J Pharm Biopharm,2009,72(1):18-25.
[8] Chen P,Wu Q S,Ding Y P,et al.A controlled release system of titanocene dichloride by electrospun fiber and its antitumor activity in vitro[J].Eur J Pharm Biopharm,2010,76(3):413-420.
[9] Xie C,Li X,Luo X,et al.Release modulation and cytotoxicity of hydroxycamptothecin-loaded electrospun fibers with 2-hydroxypropyl-β-cyclodextrin inoculations[J].Int J Pharm,2010,391(1-2):55-64.
[10]Luo X,Xu G,Song H,et al.Promoted antitumor activities of acid-labile electrospun fibers loaded with hydroxycamptothecin via intratumoral implantation[J].Eur J Pharm Biopharm,2012,82(3):545-553.
[11] Amna T,Hassan M S,Nam K T,et al.Preparation,characterization,and cytotoxicity of CPT/Fe2O3-embedded PLGA ultrafine composite fibers:a synergistic approach to develop promising anticancer material[J].Int J Nanomedicine,2012(7):1659-1670.
[12]Xu X,Chen X,Xu X,et al.BCNU-loaded PEG-PLLA ultrafine fibers and their in vitro antitumor activity against Glioma C6 cells[J].J Control Release,2006,114(3):307-316.
[13]任维维,米登海,李征,等.非小细胞肺癌紫杉醇类联合顺铂同步或序贯放化疗对比的Meta分析[J].中华肿瘤防治杂志,2013,20(5):377-382.
[14]杨怡敏,钱伟华,潘迎英.紫杉醇脂质体与紫杉醇联合顺铂治疗非小细胞肺癌的临床观察[J].解放军医药杂志,2013,25(6):50-52.
[15]Fan X,Ni S,Qi H,et al.Biodegradable microfibers deliver the antitumor drug temozolomide to glioma C6 cells in vitro[J].Pharmazie,2010,65(11):830-834.

