莪术油对棕榈酸诱导的肾小管上皮细胞脂毒性反应的抑制作用观察
胡道荣,李 杰
(重庆市合川区人民医院,重庆 401520)
慢性肾脏病(CKD)是各种原因引起的慢性肾脏结构和功能障碍。引起CKD的疾病主要包括各种原发性、继发性肾小球肾炎、肾小管损伤和肾血管病变等。CKD往往伴有不同程度的脂质代谢紊乱,后者既是许多原发性或继发性肾脏疾病的常见临床表现,同时也参与了肾脏疾病的发生发展[1]。棕榈酸是一种饱和高级游离脂肪酸,有研究表明一定浓度棕榈酸对肾小管上皮细胞有损伤作用[2,3]。莪术油是我国传统中药,有活血化瘀之功效,现已广泛应用于肾炎、脂肪肝等的治疗中[4~7]。2013年3月~2014年5月,我们采用棕榈酸诱导构建了人肾小管上皮细胞系HK-2脂毒性损伤模型,观察了莪术油对肾小管上皮细胞的保护作用,现分析结果,探讨其相关机制。
1 材料与方法
1.1 材料 HK-2细胞(中科院上海细胞所),1640培养基和胎牛血清(浙江天杭生物科技有限公司),棕榈酸(美国Sigma公司),莪术油注射液(浙江天瑞药业有限公司),Trizol试剂(美国 Invitrogen公司),RNA反转录试剂盒(宝生物工程大连有限公司),p53上调凋亡调控因子(PUMA)、细胞死亡调节因子(Bim)单抗(美国Sigma公司)。
1.2 实验方法
1.2.1 细胞培养与处理 HK-2细胞用含10%胎牛血清的1640培养基培养。培养瓶放置于37℃、5%CO2培养箱中,细胞生长至铺满瓶底80%左右时消化、传代。HK-2细胞接种于96孔板,将细胞分为对照组、棕榈酸组和莪术油组。对照组不作处理,棕榈酸组分别加入终浓度为0.2、0.8 mmol/L的棕榈酸,莪术油组分别加入终浓度为0.2、0.8 mmol/L的棕榈酸与20 mg/L的莪术油。每浓度设5个复孔,各组处理 24 h。根据文献[2,3],0.2 mmol/L 棕榈酸作用的细胞用于脂质沉积情况观察,0.8 mmol/L棕榈酸作用的细胞用于细胞增殖检测、相关基因及蛋白测定。
1.2.2 脂质沉积情况观察 各组培养18 h后吸弃培养基,将细胞接种于爬片,中性甲醛后油红O染色,显微镜下(200×)观察及采集图像。
1.2.3 细胞增殖检测 各组培养24 h后,每孔加入浓度为5 mg/mL的MTT溶液20 μL,继续培养4 h,吸弃培养基后每孔加入150 μL的二甲基亚砜。震荡后酶标仪测490 nm波长处的OD值,各组OD值表示细胞相对增殖量。
1.2.4 TNF-α、p53基因测定 各组培养24 h后,用Trizol试剂提取细胞总RNA,反转录试剂盒转成cDNA。用Real-time PCR法检测TNF-α和p53的相对表 达量。TNF-α 上游序列为 5'-GCAGGTCTACTTTGGGATCATTG-3',下游序列为 5'-GCGTTTGGGAAGGTTGGA-3';上游序列为 5'-TTGGATCCATGTTTTGCCAACTGGCC-3',下游序列为 5'-TTGAATTCAGGCTCCCCT TTCTTGCG-3'。
1.2.5 PUMA、Bim蛋白表达测定 各组培养24 h后,分别加入适量细胞裂解液于冰上裂解细胞提取总蛋白。碧云天BCA蛋白定量试剂盒进行蛋白定量。采用Western blot法检测 PUMA、Bim蛋白,按试剂盒说明书操作,采用Quantity One软件对条带灰度进行分析,实验重复3次,取均值。
1.3 统计学方法 采用SPSS 11.5统计软件。各组数据用±s表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 脂质沉积情况 对照组细胞无明显脂质沉积;棕榈酸组与莪术油组细胞内均有明显脂质沉积,但两组差异不大。见图1。
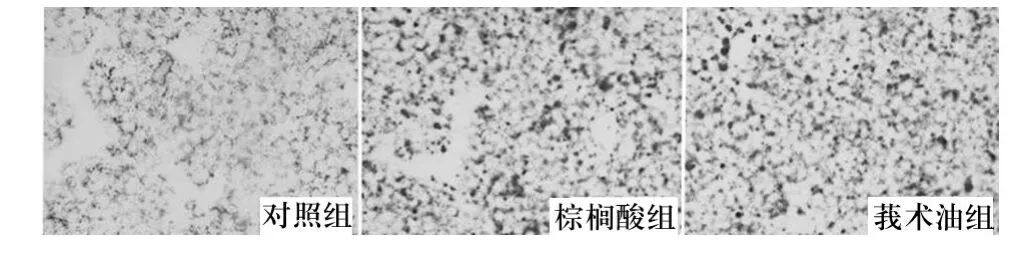
图1 各组细胞脂质沉积情况
2.2 细胞增殖情况 对照组、棕榈酸组与莪术油组OD 值分别为 1.02 ± 0.05、0.62 ± 0.04、0.79 ±0.03,其中对照组高于其他两组,莪术油组高于棕榈酸组(P均 <0.05)。
2.3 TNF-α、p53 mRNA 表达 对照组细胞 TNF-α、p53 mRNA相对表达量低于棕榈酸组与莪术油组,莪术油组低于棕榈酸组(P均<0.05)。见表1。
表1 各组TNF-α、p53 mRNA相对表达量比较(n=5,±s)

表1 各组TNF-α、p53 mRNA相对表达量比较(n=5,±s)
注:与对照组相比,*P <0.05;与棕榈酸组相比,#P <0.05
组别 TNF-αmRNA p53 mRNA棕榈酸组 1.64 ±0.07* 1.47 ±0.10*莪术油组 1.50 ±0.06# 1.30 ±0.05#对照组1.00 ±0.00 1.00 ±0.00
2.4 PUMA、Bim蛋白表达 与对照组相比,棕榈酸组的PUMA表达水平明显升高。与棕榈酸组相比,莪术油组PUMA表达明显降低(P<0.05)。各组Bim蛋白表达无明显差异。
表2 各组PUMA、Bim相对表达量比较(n=5,±s)

表2 各组PUMA、Bim相对表达量比较(n=5,±s)
注:与对照组相比,*P <0.05;与棕榈酸组相比,#P <0.05
组别PUMA Bim棕榈酸组 1.61 ±0.12*1.12 ±0.16莪术油组 1.34 ±0.08# 1.04 ±0.09对照组1.00 ±0.00 1.00 ±0.00
3 讨论
近来研究认为,脂质代谢紊乱是CKD发生发展的关键环节,代谢综合征状态可引起机体肾脏内脂质沉积和肾损伤[1]。“脂质肾毒性学说”认为,体内长期保持高游离脂肪酸水平,可诱导肾小管上皮细胞凋亡及促使肾脏疾病的发生,同时肾脏损害又可导致脂质代谢紊乱,过量游离脂肪酸在肾脏内积聚,导致发病[8~10]。此外游离脂肪酸本身的细胞毒性可损伤肾小管上皮细胞质、线粒体及溶酶体膜,引起肾小管上皮细胞变性、坏死和炎症细胞浸润。棕榈酸又称软脂酸,是一种饱和高级游离脂肪酸,以甘油酯的形式普遍存在于动植物油脂中,在自然界中分布很广[11]。莪术油是从莪术中提取出来的挥发油,其主要成分为多种倍半萜类,包括莪术醇、莪术二醇、吉马酮等,具有抗肿瘤、抗炎等功效,临床应用广泛[12,13]。
本研究体外培养了HK-2细胞,分别经棕榈酸与莪术油处理,发现0.2 mmol/L的棕榈酸可导致HK-2细胞脂质沉积,0.8 mmol/L的棕榈酸可导致HK-2细胞生长受抑,这与机体游离脂肪酸水平增高引发肾小管上皮细胞损害的病理过程相符。本研究发现,莪术油组与棕榈酸组油红染色结果差异不大,表明莪术油预保护对于棕榈酸诱导的细胞脂质沉积没有明显的抑制作用;但莪术油组细胞增殖情况好于棕榈酸组,提示莪术油对于棕榈酸诱导的细胞生长抑制有一定的保护作用。
为进一步明确莪术油的保护机制,我们观察了三组TNF-α、p53 mRNA及PUMA、Bim蛋白的表达变化。TNF-α诱导肾小管上皮细胞凋亡效应的产生很大程度上来自于其对损伤基因iNOS表达的诱导[14,15]。iNOS 是介导免疫性肾损伤、肾小管上皮细胞凋亡的关键基因,其表达增高可引起多种细胞发生凋亡和坏死。BH3-only蛋白是bcl-2家族中具有凋亡启动作用的亚家族,包括PUMA和与bcl-2相互作用的Bim等,PUMA与Bim通过与bc-2/bax相互作用启动内源性凋亡途径,导致细胞凋亡。本研究发现对照组细胞TNF-α、p53 mRNA、PUMA蛋白相对表达量低于棕榈酸组与莪术油组,莪术油组低于棕榈酸组,表明莪术油对肾小管上皮细胞的保护作用可能与调节BH3结构或下游通路有关。PUMA表达主要受p53调节,而Bim主要结合在微管动力蛋白上发挥促凋亡活性[11,12]
综上所述,莪术油对棕榈酸诱导的HK-2细胞的脂毒性损伤有一定保护作用,可改善细胞增殖抑制状态,其机制可能与抑制 TNF-α、p53 mRNA及PUMA蛋白表达有关。
[1]万克强,廖俊蕾,赵蕾,等.炎症对脂肪酸负荷的肾细胞FAT/CD36表达的影响[J].中国病理生理杂志,2012,28(2):308-313.
[2]Joshi-Barve S,Barve SS,Amancherla K,et al.Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes[J].Hepatology,2007,46(3):823-830.
[3]Akazawa Y,Cazanave S,Mott JL,et al.Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis[J].J Hepatol,2010,52(4):586-593.
[4]张静,彭六保,刘俏,等.中药某些活性成分治疗慢性肾衰的药理研究概况[J].中南药学,2011,9(9):696-699.
[5]刘红艳,彭安邦,廖爱军,等.莪术油注射液对肝星状细胞凋亡的影响[J].中华肝病杂志,2009,17(10):790-791.
[6]吴海霞,孙志明,王勤.莪术油的药理学研究及临床应用研究进展概况[J].中国医药导刊,2011,13(1):79-83.
[7]唐渊,李晓辉.莪术提取物对肝癌细胞系HepG2的抗癌作用及机制研究[J].中国药理学通报,2007,23(6):790-794.
[8]Lupi R,Dotta F,Marselli L,et al.Prolonged exposure to free fatty acids has cytostatic and pro-apoptotic effects on human pancreatic islets:evidence that beta-cell death is caspase mediated,partially dependent on ceramide pathway,and Bcl-2 regulated[J].Diabetes,2002,51(5):1437-1442.
[9]左洋洋,付蕾,王文健,等.清道夫受体:脂质肾损伤的关键[J].中华肾脏病杂志,2014.30(2):155-158.
[10]Akazawa Y,Cazanave S,Mott JL,et al.Palmitoleate attenuates palmitate-induced Bim and PUMA up-regulation and hepatocyte lipoapoptosis[J].J Hepatol,2010,52(4):586-593.
[11]刘芳,刘凯,刘道洁,等.棕榈酸对肝癌HepG2细胞自噬和凋亡的影响[J].山东医药,2014,54(12):8-10.
[12]梁莉萍,贾存东.莪术油对乳腺癌癌前病变大鼠的治疗效果及作用机制[J].中国老年学杂志.2013,33(12):2821-2823.
[13]刘阿红.复方莪术油栓治疗阴道炎160例临床观察[J].中国实用医药,2013,8(20):187-188.
[14]刘亮明,孙水林,叶长根,等.Pim-3基因抑制暴发性肾小管上皮细胞凋亡的机制[J].中华肝脏病杂志,2012,20(9):688-692.
[15]袁航屠,世良何,徐军.PUMA和BIM表达与结直肠癌浸润转移及预后的关系[J].中华外科学杂志,2013,51(6):547-551.

