一种球蚧类蚧虫基因组DNA 的提取方法
李惠萍,王静慧,张龙霞,刘海峰,刘晓琳
(山西出入境检验检疫局,太原 030024)
球蚧类蚧虫在分类学上属于蚧科(Coccidae),因其雌成虫在发育过程中虫体膨大成半球状并变硬,而被归为球蚧类(汤祊德,1991)。球蚧类雌成虫发育前期虫体较扁,易于制作玻片标本,形态比较规则,鉴定特征明显(汤祊德,1991),但此期较短,甚至只有几天,因此样本的获得变得困难;发育中期虫体体壁鼓起成半球状,有些种类高达14 mm;发育后期虫体皱缩干枯,变脆变硬,甚至木质化,几乎不能用来制作标本,实现对种类的鉴定(谢映平,1998)。
目前,生物技术已越来越广泛地运用于生物领域,已开始从分子水平上探讨物种进化以及相似种的鉴定。在蚧虫的系统进化方面,国外科学家在功能基因,亲本起源和协同进化等方面进行了部分研究,也有运用分子标记做蚧虫近似种的区分或复合种鉴别(Rung et al.,2008;Edwards et al.,2008;Provencher et al.,2005),Park 等(2011)对粉蚧和盾蚧两科的蚧虫进行了DNA 条码数据的研究。在我国,蚧虫分子系统学研究刚刚起步,仅高宝嘉等(2007)采用RAPD 技术测定分析了河北省皱大球蚧和瘤坚大球蚧8个地理种群的遗传结构。马力等(2007)筛选出了适合蚧虫DNA 扩增的引物“AGAGGTGGGCAGGTG”。
基因组DNA 的提取是任何分子学研究的前提,因此许多研究致力于建立快速、稳定地提取高质量基因组方法。果蝇、瓢虫、蝗虫等大型昆虫,因材料易取,运用常规提取方法(SDS)或改进的提取方法或提取试剂盒即可完成基因组DNA的提取(Harrison 1987;Taylor,1993;代金霞等,2004),对于小型昆虫如蚧虫,因其活动器官严重退化,只剩下膜质或革质或木质化的体壁和体液,使得其基因组的提取难度加大。因此国内外学者正努力尝试多种提取方法来获得基因组,如采用试剂盒方法(Edwards et al.,2008;Provencher et al.,2005),sunnucks 盐析法(Morse et al.,2006),silica 方法或玻璃纤纬方法替代了酚氯仿抽提(Park et al.,2011),CTAB 和NaCL 方法(石晶等,2005)等等均有报道。
但这些报道大多是对盾蚧和粉蚧的研究,材料常选择高浓度酒精浸泡的新鲜虫体。石晶等(2005)和高宝嘉等(2007)对枣大球蚧和皱大球蚧的研究中,同样选择了新鲜虫体试验,而且对于材料的前处理过程描述不多或简单。这些方法在蚧虫分子研究的实际应用中会有些限制,如材料不一定新鲜,或用常规浓度的酒精固定的样本,或遇到特殊的体壁极其硬化甚至木质化的球蚧类蚧虫。那么材料前处理是否成为解决基因组提取的关键环节也有待研究。本文尝试在材料的选择和前处理过程两个关键环节进行试验,并进行SDS、CTAB、TES、NaCl 和TNES 五种提取方法的筛选,旨在获得一种适合球蚧基因组DNA 提取的有效方法。
1 材料与方法
1.1 材料
本实验以枣大球蚧 Eulecanium gigantea(Shinji)、皱大球蚧Eulecanium kuwanai(Kanda)、盔蚧属一种 Saissetia sp.、沙里院褐球蚧Rhodococcus sariuoni Borchsenius、朝鲜毛球蚧Didesmococcus koreanus Borchsenius、扶桑绵粉蚧Phenacoccus solenopsis Tinsley、白蜡绵粉蚧Phenacoccus fraxinus Tang 和桔小粉蚧Pseudococcus cryptus Hempel 为研究对象(表1)。所有标本的成虫都经准确的鉴定,供试材料置于-20℃冰箱中保存待用。

表1 供试的蚧虫种类一览表Table 1 The list of scale insect species for testing
1.2 试剂及仪器
1.2.1 试剂:
CTAB、EDTA、TRIS 购自上海索莱宝生物科技有限公司;蛋白酶K、RNA 酶购自Takala 宝生物工程(大连)有限公司;Agarose 购自Invitrogen公司;β-巯基乙醇购自美国Amresco。
1.2.2 仪器:
EYEL4 恒温水槽(日本)、Miniplus 离心机(德国Eppendorf)、Bio-RAD Power Pac 300 电泳系统(美国伯乐)、GENE GENIUS 全自动凝胶成像分析系统(英国Syngene)、微量紫外分光光度仪(德国jena)。
1.3 样品采集和保存
采集球蚧样品时,一部分用75%酒精溶液直接固定,尽快置于-4℃冰箱保存,一部分连同寄主枝干一起采回。尽快将采回的样品在室内剥离寄主置-20℃冰箱冷冻保存。本实验所用样品大都在此条件下保存1-3年。
1.4 基因组提取前的样品选择和清洗
本实验选择不同的样品材料,一是整头虫体,二是虫体外骨髂,即表皮。试验前,对于整头虫体的材料须进行显微检查,选择单头非寄生的虫体,用100%酒精清洗至虫体表面干净,再用蒸馏水浸泡清洗三次,每次浸泡30 min,自然晾干;对于虫体外骨骼的材料,同样要用100%酒精清洗干净体内物质,再用蒸馏水洗涤4-5 次,凉干待用。
1.5 基因组提取第一步骤样品磨碎处理改进
本实验将选择好的样品材料放入1.5 mL 离心管中,分别加入 SDS、CTAB、TES、NaCL 和TNES 法的提取缓冲液或裂缓冲液以刚刚淹没材料,始终保持在冰上剪碎。
1.6 基因组提取的随后步骤按SDS、CTAB、TES、NaCl 和TNES 法分别进行
1)SDS 法(童丽娟等,2002)
在本文1.5 剪碎样品的EP 管中,补加入SDS法裂解缓冲液(100 mmol/L NaC1,10 rnmol/L Tris-HCl,50 mmol/L EDTA,0.5% SDS,蛋白酶K100 ug,0.2% β-巯基乙醇)至400μL,65℃水浴1 h。室温下,12000 r/min 离心10 min。取上清液加入300μL 饱和NaC1 溶液混匀,12000 r/min离心10 min。取上清液移加等体积异丙醇,轻轻混匀后置-20℃冰箱1 h。在4℃下,12000 r/min离心15 min。弃液体,用70%酒精洗涤沉淀,待完全干燥后加适量TE 溶解DNA,4℃或-20℃保存待用。
2)CTAB 法(Boyce T.M.等,1989)
在本文1.5 剪碎样品的EP 管中,补加入CTAB 法提取缓冲液(Tris-HC1 100 mmol/L,20 mmol/L EDTA,1.4 mol/L NaC1,0.2% β-巯基乙醇,50 mmol/L CTAB,pH 8.3)至400μL,65℃水浴1 h。加入等体积酚:氯仿:异戊醇(25∶24∶1),12000 r/min 离心10 min。取上清加入等体积的氯仿:异戊醇(24∶1),12000 r/min离心10 min。取上清加入等体积预冷的异丙醇,轻轻混后置-20℃ 沉 淀 1 h,4℃,12000 r/min离心15 min。弃液体,用500μL 70%乙醇溶液洗涤DNA,4℃,12000 r/min 离心1 min。弃液体,待完全干燥后,加入适量TE 溶解,4℃或-20℃保存待用。
3)TES 法(张敏等,2008)
在本文1.5 mL 剪碎样品的EP 管中,补加入TES 法提取冲液(100 mmol/L Tris-HCl,1.4 mol/L NaCl,20 mmol/L EDTA,pH8.0,l%SDS,0.2 mg/mL 蛋白酶K)至400μL,55℃水浴10 h。加入等体积饱和酚,颠倒混匀,12000 r/min离心10 min。取上清,加入等体积的酚:氯仿:异戊醇(25∶24∶1),12000 r/min 离心10 min。取上清加入等体积的氯仿:异戊醇(24∶1),12000 r/min 离心10 min。取上清液加入2 倍体积预冷的无水乙醇,-20℃沉淀1 h,4℃,12000 r/min离心15 min。弃液体加500μL 70%乙醇溶液,洗涤DNA,4℃,12000 r/min 离心1 min。弃液体,待完全干燥后,加入适量TE 溶解,4℃或-20℃保存待用。
4)NaCl 法(石晶等,2005)
在本文1.5 mL 剪碎样品的EP 管中,补加入NaCl 法提取缓冲液(10 mmol/L Tris-HCI,pH 8.0,100 mmol/LNaCl,1 mmol/L EDTA)至400μL,加90-100μL 10%SDS、4-5 uLRNA酶,37℃水浴1 h。加4-5μL 蛋白酶K,55℃消化6-12 h 或者过夜消化,12000 r/min 离心10 min。取上清,加6 mol/L NaCl 溶液600μL,12000 r/min 离心30 min。取上清加2 倍体积预冷的无水乙,-20℃冰箱静 1 h,4℃,12000 r/min离心15 min。弃液体加500μL 70%乙醇溶液洗涤DNA,4℃,12000 r/min 离心1 min。弃液体,待完全干燥后,加入适量TE 溶解,4℃或-20℃保存待用。
5)TNES 法(Paul Sunnucks 等,1996)
在本文1.5 剪碎样品的EP 管中,补加入TNES 法提取缓冲液(50 mmol/L Tris-HCI,pH 8.0,400 mmol/L NaCl,20 mmol/L EDTA,0.5 %SDS)至300 ul,加入0.1 mg/mL 蛋白酶K,37℃中水浴8 h。加入5 mol/L 氯化钠溶液85μL,剧烈摇晃20 s,13000 r/min 离心10 min。取上清,加入2 倍体积预冷的无水乙醇,轻轻混匀后置于-20℃冰箱中沉淀1 h,4℃ 12000 r/min 离心15 min。弃液体加入500μL 70% 乙醇溶液洗涤DNA,4℃,12000 r/min 离心1 min。弃液体,加入适量TE 溶解,4℃或-20℃保存待用。
1.7 基因组DNA 检测
用1%琼脂糖凝胶、1×TAE 电泳缓冲液检测所提取的DNA,各取5μL;电压120 V,室温下电泳30-45 min,EB 染色,用凝胶成像系统拍照分析。用微量紫外分光光度仪测定OD260nm和OD280nm,以OD260nm/OD280nm比值分析DNA 的纯度。
1.8 PCR 扩增
对运用CTAB 法提取的球蚧基因组DNA,采用C.Simon 等(1994)报道的mtDNA 中COⅠ和CO Ⅱ通用引物 C1-J-2753ywr(5'-GTAAACCTAACATTTTTYCCWCARCA-3')和C2-N-3662(5'-CCACAAATTTCTGAACATTGACC-3')进行PCR 扩增。
扩增体系:Taq DNA 聚合酶0.25μL、10×Buffer 5μL、dNTP 4μL、上游引物1μL、下游引物1μL,模板5μL,ddH2O 补足50μL。扩增条件:94 ℃3 min 后,按94 ℃,1 min;50-40℃(-2℃/1 cycle),1 min;72 ℃,2 min 进行33个循环,72 ℃,10 min。4℃保存。
PCR 扩增结束后取6μL 扩增产物与溴酚蓝混匀,以1×TAE 缓冲液、1%琼脂糖凝胶电泳,附带Marker 检测。
2 结果与分析
2.1 样品保存方式对结果影响
实验结果表明,球蚧类蚧虫材料无论是冷冻保存还是75%酒精固定液-4℃保存均可完成基因组的提取。
2.2 材料处理方式对结果影响
实验结果表明,对于球蚧类蚧虫,虫体体壁更容易提取出全基因组。表2 给出用五种蚧虫整虫提取的DNA OD 值为1.3-1.5,而用体壁提取的DNA OD 值为1.7-1.8。显然选择蚧虫体壁作为提取材料,更适全基因组的获得。
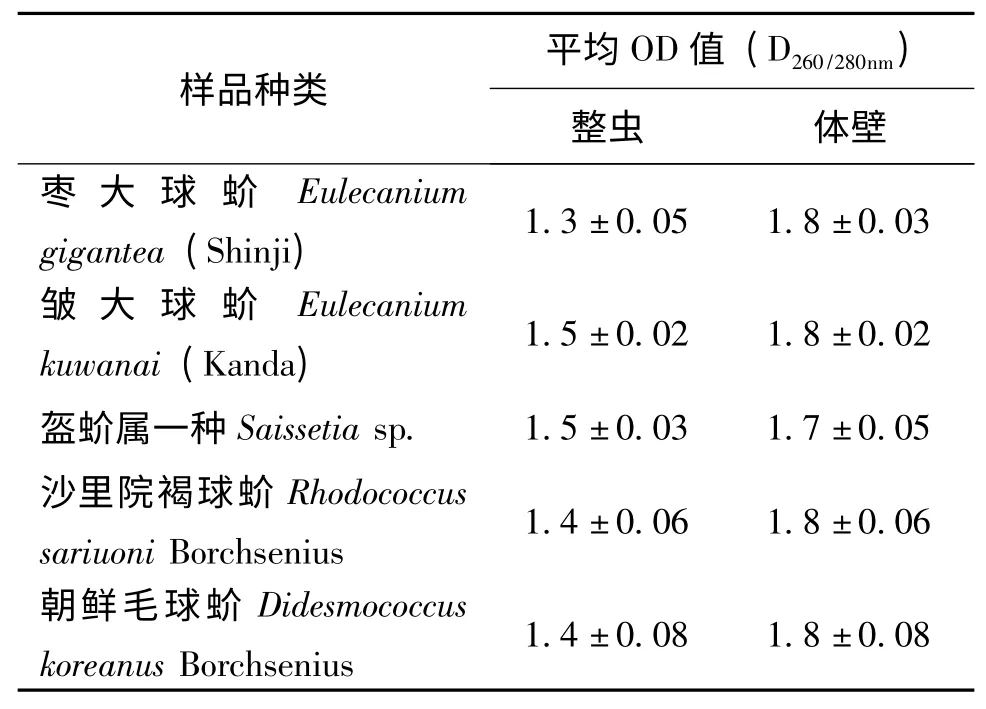
表2 用不同材料提取DNA 的OD 值Table 2 OD value of genomic DNA from different samples
2.3 样品磨碎处理方式对结果影响
实验结果表明,用剪刀剪碎的方式更适合球蚧类蚧虫的基因组的提取,实验过程中不难发现,球蚧类蚧虫的外骨骼木质化,有韧性,研磨杵很难将其分开磨碎。
2.4 选择冷冻保存的样品材料或75%酒精保存的材料,取用虫体体壁,经冷冻剪碎后再通过SDS、CTAB、TES、NaCL 和TNES 法比较提取结果
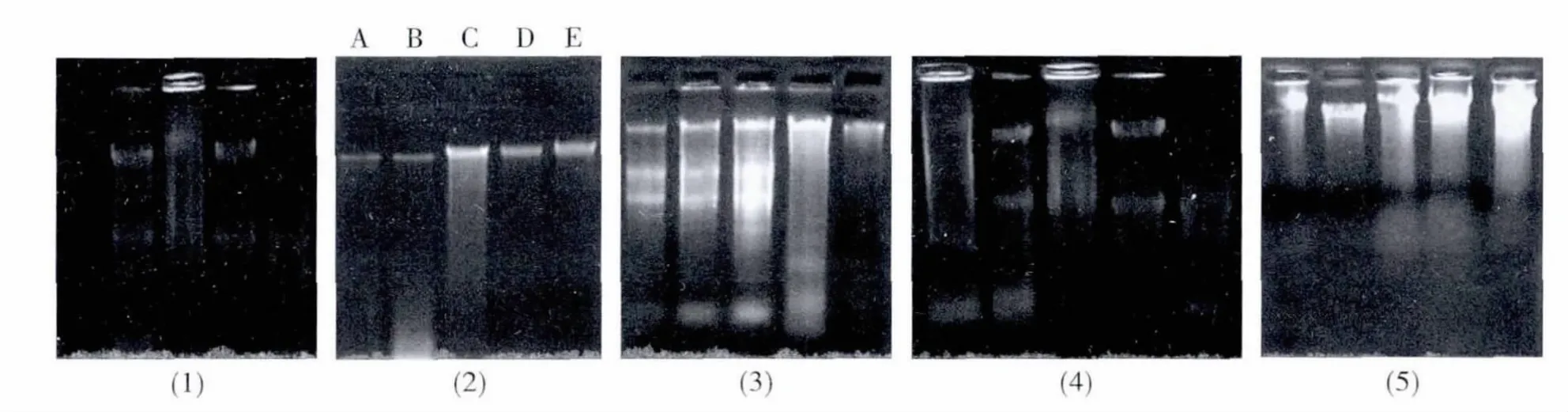
图1 五种方法提取基因组的电泳图Fig.1 The electrophorgram of genomic DNA abstracted using SDS、CTAB、TES、NaCL and TNES methods
由图1 可知,CTAB 法、TES 法和TNES 法对五种球蚧均可提出较为完整的基因组,而用SDS法和NaCl 法对枣大球蚧则没能获得基因组。同时结果表明TES 和TNES 法获得的基因组DNA 混有或多或少蛋白质、色素或RNA,而CTAB 法提取的基因组DNA 主条带清晰整齐,无拖尾降解现象,DNA 纯度很高。
总体来看,材料选择和样品前处理方法对后续的基因组提取至关重要,本研究所尝试的以球蚧体壁作为提取材料及运用剪碎的样品处理方法,更是五种后续提取方法得以成功获得基因组DNA的关键所在,图1 也可看出,除枣大球蚧外,其它球蚧运用这五种方法,均获得了基因组,只是基因组的纯度有差异而已,完全可通过修改纯化步骤来改进。
2.4 对CTAB 法提取的基因组进行PCR 扩增结果

图2 五种球蚧基因扩增电泳图Fig.2 Gene amplification electrophorgram of five scale insect species
经过后续验证试验,表明利用CTAB 法提取的五种球蚧基因组DNA 扩增的目的片段稳定,且扩增条带单一、亮度高,显然CTAB 法提取球蚧基因组DNA 的效果非常好。
3 结论与讨论
用于分子试验的生物样本,采用冷冻低温保存是目前最好的保存方法,无水乙醇保存方法也是有效的,但不宜长期保存(李梦,2006),用福尔马林常温浸泡和75%酒精常温密封保存的昆虫数周后也可用于分子试验(林万华等,2006)。本试验表明,用75%酒精密封-4℃可保存较长时间,甚至达到冷冻低温保存的时间和效果。但在试验前,样本必须经过蒸馏水充分洗涤,以置换样本体内酒精,消除酒精对后续实验的影响。同时75%酒精溶液保存样本的方法是常规的生物学方法,便于野外采集标本的保存和运输,更有利于生物学研究和分子学研究的进一步开展。
基因组提取的关键步骤是材料的破碎,对小型昆虫的破碎,大多数文献报道采用匀浆棒捣碎或者研碎,但对于蚧虫,由于虫体极小,在提取缓冲液中容易漂浮;且体壁韧性大,不易捣碎或研碎。同时如果捣碎或研碎的时间太长会使基因组降解。当然也有利用液氮研磨以及超声破碎的(安瑞生等,2002),但这两种方法却不适合球蚧类蚧虫体壁的研碎,且因虫体小,液氮研磨后,材料粘壁,不易收集。本实验将蚧虫放入装有提取缓冲液的离心管中置于-20℃冰箱中冷冻,然后用预冷的小剪刀在冰上剪碎,既解决了虫体在提取缓冲液中漂动的问题,又使得基因组不易被自身的核酸酶降解。
本实验在对球蚧进行基因组DNA 提取过程中,发现有很多色素和蛋白质,这就给如何获得高质量的DNA 带来了困扰。五种提取方法比较表明,CTAB 法的去除效果最好。但DNA 损失较大。另外,我们也尝试运用试剂盒(Qiagen Dneasy tissue kit)进行了试验,发现对于体壁硬化的球蚧类,无法提取出基因组,而对于膜质的粉蚧类,可以提取出来,这跟国外大多数文献报道相一致(Edwards et al.,2008;Provencher et al.,2005)。但蚧虫种类多,结构差异也大,不会有固定的提取方法,还需大量的试验来建立相关类群的有效提取方法。
References)
An RS,Tan SJ,Chen XF,2002.Improvement in grinding tissue during extracting DNA from small insects[J].Entomological Knowledge,39(4):311-312.[安瑞生,谭生江,陈晓峰,2002.小型昆虫DNA 提取时匀浆方法的改进[J].昆虫知识,39(4):311-312]
Boyce TM,Zwick ME,Aquado CF,1989.Mitochondrial DNA in the bark weevils:size,structure and heteroplasmy.Genetics,825-836
Dai JX,Yu YZ,Zheng ZM.Comparative Study on Genome DNA Extraction of Tenebrionidae Insects[J].Journal of Ningxia University(Natural Science Edition),2004,25(1):66-68.[代金霞,于有志,郑哲民,2004.拟步甲昆虫基因组DNA 提取的比较研究[J].宁夏大学学报(自然科学版),25(1):66-68]
Edwards R,Carraher C,Poulton J,et al.DNA Diagnostics of three armored scale species on kiwifruit in new zealand[J].Journal of economic entomology,2008,101(6):1944-1949.
Gao BJ,LiM,Wang CH,et al.RAPD analysis of genetic divergence among populations in Kuwanai Kandan and Eulecanium gigantean shinji[J].Acta Ecologica Sinica,2007,27(3):918-923.[高宝嘉,李梦,王春和,等。皱大球蚧(Eulecanium kuwanai)和瘤坚大球蚧(Eulecanium gigantean)地理种群的RAPD 遗传分化[J].生态学报,2007,27(3):918-923]
Harrison RG,Rand DM,Wheeler W C.Mitochondrial DNA variation in field crickets across anarrow hybrid zone[J].Mol.Biol.Evol,1987,144-158.
Li M.Study on the population Differentiation and Genetic Diversity of the partial Coccoidea[D].Agricultural University of Hebei(Master's thesis),2006,26-27.[李梦.部分蚧科昆虫种群分化及遗传多样性的研究[D].河北农业大学(硕士学位论文),2006,26-27]
Lin WH,Li ZZ,Chen ZP,et al.Preservation and Extraction of Genomic DNA from Insects[J].Journal of Guangxi Normal University(Natural Science Edition),2006,24(2):26-27.[林万华,黎宗展,陈振鹏,等.昆虫全基因组DNA 的保存及提取[J].广西师范大学学报,2006,24(2):86-88]
Ma L,X YP,Xue JL.Rapid Identification of Scale Insect by Total DNA Extraction and PCR[J].Journal of Anhui Agri.Sci.,2007,35(5):1302-1304.[马力,谢映平,薛皎亮.蚧虫DNA 的提取及PCR 法虫种快速鉴定技术[J].安徽农业科技,2007,35(5):1302-1304]
Morse GLEL,Normark B.A molecular phylogentic study of armoured scale insects(Hemiptera:Diaspididae)[J].Systematic Entomology,2006,338-349.
P.Sunnucks,DF.Hales.Numerous Transposed Sequences of Mitochondrial Cytochrome Oxidase I-II in Aphids of the Genus Sitobion(Hemiptera:Aphididae)[J].Mol.Biol.Evol.,1996,13(3):510-524.
Provencher LM,Morse GE,Weeks AR,et al.Parthenogenesis in the Aspidiotus nerii Complex(Hemiptera:Diaspididae):A single origin of a worldwide,polyphagous lineage associated with Cardinium Bacteria[J].Ann.Entomol.Soc.Am.,2005,98(5):629-635.
Rung S,Scheffer SJ,Evans G,et al.Molecular identification of two closely related species of mealybugs of the Genus Planococcus(Homoptera:Pseudococcidae)[J].Annals of the Entomological Society of America,2008,101(3):525-532.
Simon C,Frati F,Beckenbach Crespi,et al.Evolution,weighting,and phylogenetic utility of mitochondrial gene sequences and a compilation of conserved polymerase chain reaction primers[J].Annals of the Entomological Society of America,1994,651-701
SJ,XieYP,Xue JL,Yao GQ,2005.Comparative study of methods for isolation of genomic DNA of scale insects.Chinese-Bulletin of Entomology,42(2):207-211.[石晶,谢映平,薛皎亮,姚国亲,2005.蚧虫基因组DNA 不同提取方法的比较.昆虫知识,42(2):207-211]
Tang FD,1991.The Coccidae Of China.Shanxi:Shanxi university joint publishing house.[汤祊德,1991.中国蚧科.山西:山西高校联合出版社]
Taylor MFJ,McKechnie SW,Pierce N,Kreitman M,1993.The lepidopteran Mitochomdrial control region:structure and evolution.Mol.Biol.Evol.,10(6):1259-1272.
Tong LJ,Wang YJ,Pan ZC,Sun CX,Zhang YJ,2002.Comparative Study of Methods for the Isolation of Spiders,Genomic DNA.Chinese Journal of Zoology,37(6):53-55.[童丽娟,王亚军,潘志崇,孙彩霞,张永靖,2002.蜘蛛基因组DNA 提取方法的比较.动物学杂志,37(6):53-55]
Xie YP,1998.The Scale Insects of the forest and fruit trees in Shanxi of China.Shanxi:China Forestry Publishing house.[谢映平,1998.山西林果蚧虫.北京:中国林业出版社]
Zhang M,Ma EB,2008.Study on Genetic Diversity and Molecular Phylogenetic relationships of Partial Species in Nymphalidae in China.Shanxi University(Thesis for Doctor,s Degree),23-28.[张敏,马恩波,2008.蛱蝶科遗传多样性及分子系统发育研究.山西大学(博士学位论文),23-28]

