人肌球蛋白轻链9在前列腺癌的表达水平及其对生化复发的预测价值
张增强 叶永康 黄亚强 吴永定 李牧 何慧婵
临床研究论著
人肌球蛋白轻链9在前列腺癌的表达水平及其对生化复发的预测价值
张增强 叶永康 黄亚强 吴永定 李牧 何慧婵
目的研究人肌球蛋白轻链9(MYL9)在前列腺癌中的表达水平及其对临床生化复发的预测价值。方法利用蛋白质组学技术检测前列腺癌及癌旁良性前列腺组织MYL9的表达水平,再通过蛋白免疫印迹法验证蛋白质组学结果,最后使用Taylor的数据对MYL9进行生物信息学分析,分析不同年龄、血清PSA水平、Gleason评分、病理分期、转移与否及生存与否的前列腺癌患者间MYL9水平的差异。结果蛋白质组学结果显示,MYL9在前列腺癌组织中的表达水平比癌旁良性前列腺组织下调5.67倍(P<0.01);蛋白免疫印迹法结果也显示,前列腺癌组织中MYL9表达水平比癌旁良性前列腺组织明显下调(0.23±0.08 vs.0.73±0.06,P<0.001);前列腺癌患者中,年龄<66岁、Gleason评分<8分、病理分期<T3A、肿瘤无转移、存活者的MYL9表达水平明显高于年龄≥66岁、Gleason评分≥8分、病理分期≥T3A、肿瘤发生转移、死亡者(P均<0.001),血清PSA水平是否<4 μg/L对MYL9表达无影响(P>0.05)。MYL9低表达组前列腺癌患者的无生化复发生存率明显低于MLY9高表达组(χ2=11.575,P<0.001)。结论MYL9在前列腺癌中比癌旁前列腺组织表达下调,且MYL9表达水平较低者的临床预后较差。
前列腺癌;肌球蛋白轻链;蛋白质组学;临床预后
前列腺癌是男性常见的恶性肿瘤之一[1]。高危患者与低危患者所需要接受的治疗方案完全不同[2]。但是,每年仍有20%被诊断为低危的患者因为保守疗法无效而致病情恶化甚至死亡[3]。所以,寻找新的前列腺肿瘤标志物以提高患者病情的预测精准度并协助确定最佳治疗方案已成当务之急。癌细胞的生长、侵袭和转移是一个复杂多变的过程,主要由细胞表面受体、肿瘤微环境和肌动蛋白细胞骨架的运动性之间的相互作用引导[4]。肿瘤细胞的可塑性使得其能够高度适应肿瘤微环境,逃避侵入性治疗[5]。肌动球蛋白的收缩性使肿瘤细胞能够产生对抗所处微环境的运动力而发生迁移[6]。人肌球蛋白轻链(MYL9)属于肌动蛋白结合蛋白质的一种,能辅助调节细胞运动、分裂和黏附等过程[7-8]。目前,用于界定前列腺癌高危和低危程度的重要指标主要有肿瘤临床分期、肿瘤病理分级、Gleason评分以及前列腺特异性抗原(PSA)。本研究通过蛋白质组学方法分析前列腺癌与癌旁组织的MYL9蛋白表达差异,并探讨MYL9在前列腺癌组织中表达下调对患者临床预后的影响,现报告如下。
材料与方法
一、标本来源
用于蛋白质组学检测的4例新鲜前列腺癌组织及4例配对癌旁组织、用于蛋白免疫印迹法检测的20对前列腺癌及癌旁前列腺组织均来源于2007年1月至2011年12月在广州医科大学附属广州市第一人民医院行根治性前列腺癌切除术的前列腺癌患者。本研究经广州市第一人民医院伦理委员会批准并征得所有入组患者的知情同意,所有标本均根据伦理和法律标准进行匿名处理和制作。
二、主要试剂
硝酸纤维素薄膜购于美国Millipore公司;ECL发光液体购于美国ECL Thermo公司;单抗购于北京博奥森公司;IgG抗体购于武汉博士德公司。
三、方法
1.蛋白质组学检测
经苏木素-伊红染色鉴定前列腺癌组织块,利用显微切割获得较纯净的癌及癌旁组织,再进行双向荧光差异凝胶电泳及质谱分析,比较MYL9在前列腺癌和癌旁组织的蛋白表达水平。
2.蛋白免疫印迹法
前列腺癌及癌旁组织经蛋白裂解液裂解后离心取上清,用二喹啉甲酸(BCA)法对上清进行蛋白定量后取适量蛋白样品进行电泳,转膜后孵一抗,反复洗膜后,加入二抗继续孵育,再反复洗膜后,与ECL发光液体充分反应,根据蛋白条带发光强弱,于暗室中以不同时间分别曝光,将胶片放入显影液中显影后用定影液定影,用水冲洗后晾干。结果扫描后用图像分析系统进行半定量分析,β-actin用作内参对照。
3.基于表达谱芯片的临床大样本分析
为了能从更大样本量上研究MYL9与前列腺癌临床指标的相关性,笔者从GEO网站下载了Taylor等的前列腺癌基因表达谱数据集(http://www. ncbi.nlm.nih.gov/geo/accessionnumber GSE21032)。该数据集含有218例肿瘤样本和149例配对癌旁边正常样本[6]。本研究重点分析含有MYL9 mRNA表达谱数据的149例肿瘤样本的MYL9基因表达与临床及病理指标的关系,并进行生存分析。
四、统计学处理
结 果
一、前列腺癌及癌旁组织的蛋白质组学检测结果比较
4例新鲜前列腺癌组织及4例配对癌旁组织,应用蛋白组学检测结果分析发现MYL9在前列腺癌组织的表达水平比癌旁组织下调5.67倍(t=6.668,P=0.007),见图1。
二、前列腺癌及癌旁组织的蛋白印迹法结果比较
蛋白印迹法检测了20对前列腺癌及癌旁前列腺组织,结果显示前列腺癌组织中MYL9蛋白比癌旁边前列腺组织明显下调(0.23±0.08 vs.0.73± 0.06,t=3.946,P<0.001),见图2。
三、MYL9表达水平与前列腺癌患者临床及病理指标的关系
Taylor数据库的149例前列腺癌患者中,年龄≥66岁、Gleson评分≥8分、病理分期≥T3A、有转移、死亡患者的MYL9表达水平相应高于年龄<66岁、Gleson评分<8分、病理分期<T3A、无转移、存活的患者(P均<0.05),前列腺癌患者的MLY9表达水平与血清PSA水平无关(P>0.05),见表1。
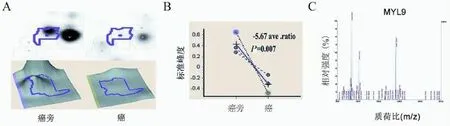
图1 前列腺癌和癌旁前列腺组织的蛋白质组学检测结果
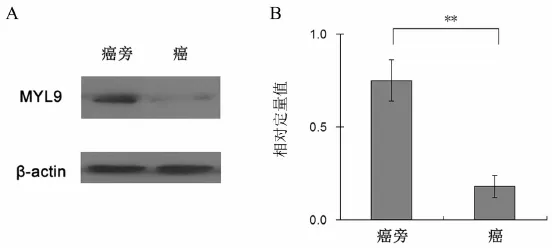
图2 前列腺癌及癌旁组织的蛋白印迹结果比较
表1 Taylor数据库中MYL9的表达与临床病理特征的关系(n=149,±s)
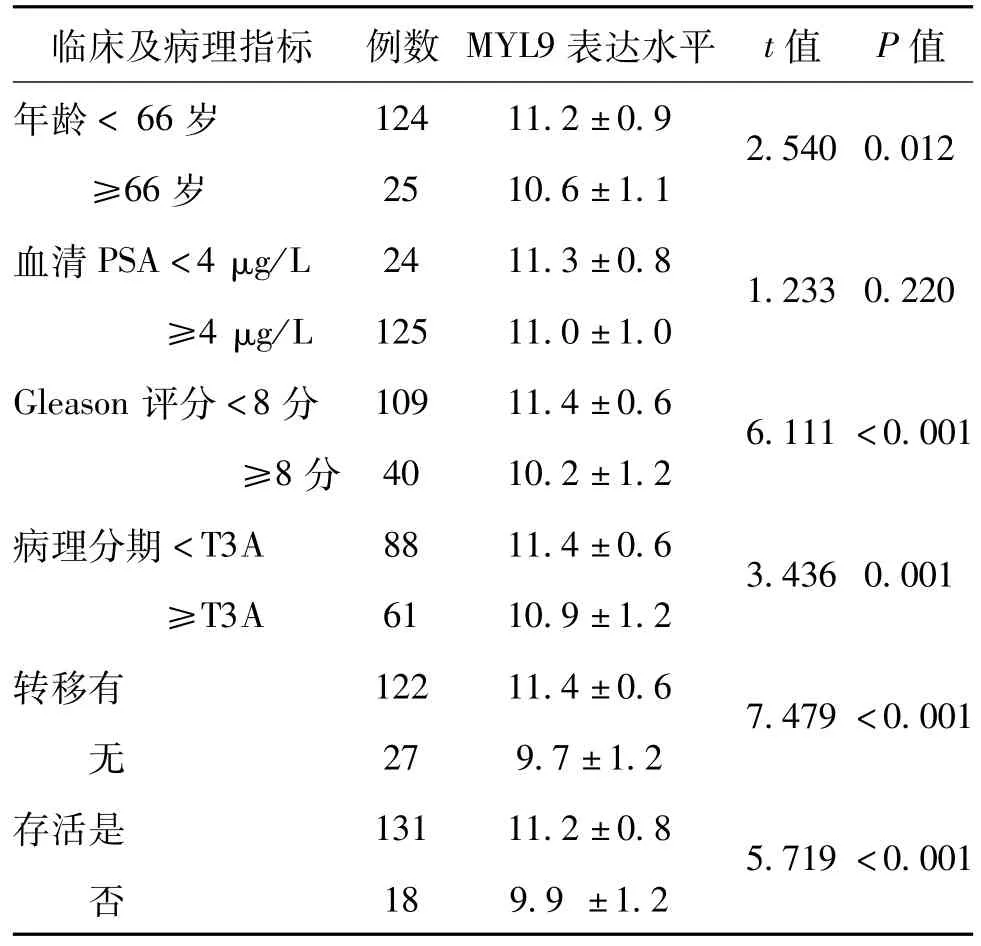
表1 Taylor数据库中MYL9的表达与临床病理特征的关系(n=149,±s)
临床及病理指标例数MYL9表达水平t值P值年龄<66岁12411.2±0.92.540 0.012 ≥66岁2510.6±1.1血清PSA<4 μg/L2411.3±0.81.233 0.220 ≥4 μg/L12511.0±1.0 Gleason评分<8分10911.4±0.66.111<0.001 ≥8分4010.2±1.2病理分期<T3A8811.4±0.63.436 0.001 ≥T3A6110.9±1.2转移有12211.4±0.67.479<0.001 无279.7±1.2存活是13111.2±0.85.719<0.001 否189.9±1.2
四、前列腺癌患者MYL9表达水平与临床预后的关系
根据MYL9的表达水平,以中位数11.34将其分为低表达组及高表达组,进一步采用Kaplan-Meier生存曲线分析MYL9与临床预后的关系。MYL9低表达组前列腺癌患者的无生化复发生存率明显低于MLY9高表达组(χ2=11.575,P<0.001),见图3。
讨 论
根据肿瘤临床分期和Gleason评分等指标的不同,前列腺癌患者的临床过程呈明显个体差异,即使病理分期和Gleason评分相同的患者接受相同的临床治疗,也有可能会出现不同的治疗效果,说明现行的标准组织学方法和诊断模式也有其不足之处。因此,对前列腺癌患者的临床预后显得十分重要,近期,前列腺癌研究的热点主要集中在寻找和评估新的对临床预后有指导作用的分子因素,希望它们能有助于对患者病情做出更准确的评估,为前列腺癌患者制定出更个性化的治疗方案。
MYL9在不同器官恶性肿瘤中的表达及磷酸化模式不尽相同。据报道,MYL9在膀胱癌和结肠癌中表达下调[9-10]。在肺癌、乳腺癌细胞中,MYL9表达上调并且促进肿瘤细胞的侵袭、转移和增殖,且肺癌的转移潜能受肺癌细胞中MYL9的磷酸化水平的调控[11-12]。但也有报道说在乳腺癌中srGAP3 和miR-145过度表达的同时,MYL9磷酸化水平升高,并抑制肿瘤细胞的侵袭和增长[13-14]。
在有关前列腺癌的研究中,间质因素与前列腺癌进展的相关性也被大量报道,认为肿瘤间质比例、生物分子在间质中表达水平变化与前列腺癌的恶性程度相关并可作为预测前列腺癌预后的潜在指标[15-18]。然而上述研究均未提及肿瘤细胞中MYL9的表达变化与肿瘤预后的关系。笔者团队前期研究发现,MYL9主要在前列腺间质区域表达,在前列腺癌标本中MYL9表达下调的同时肿瘤间质成分明显减少,并且肿瘤间质容积越少,前列腺癌的预后越差,表明MYL9表达的变化在前列腺癌进展中可能发挥着重要作用。文献报道,MYL9的活化能调节细胞间的黏着能力,细胞间黏着连接的解聚有利于肿瘤细胞的运动和侵袭。Ayala等[19]认为前列腺癌标本中间质体积的变化可以预测前列腺癌的生化复发风险,间质容积小的前列腺癌预后较差。Sturge等[20]认为由MYL9诱导的细胞收缩性不仅参与细胞-间质黏附的解聚而且还参与破坏细胞-细胞间黏着连接的稳定性。结合本研究结果,MYL9表达下调越明显,前列腺癌的转移及生化复发可能性越大。由此推测,前列腺癌中MYL9表达下调可以降低肿瘤细胞间的黏着连接,促进肿瘤细胞的运动,增强前列腺癌细胞的转移和侵袭力。因此,前列腺癌MYL9的表达下调可能对前列腺癌不良预后的预测具有重要指导作用。

图3 前列腺癌患者MYL9表达水平与无生化复发生存率的关系
[1]Siegel R,Ma J,Zou Z,Jemal A.Cancer statistics,2014.CA Cancer J Clin,2014,64(1):9-29.
[2]Lin HY,Amankwah EK,Tseng TS,Qu X,Chen DT,Park JY.SNP-SNP interaction network in angiogenesis genesassociatedwithprostatecanceraggressiveness.PLoS One,2013,8(4):e59688.
[3]Albertsen PC.PSA and the conservative treatment of early prostate cancer.Arch Ital Urol Androl,2006,78 (4):152-153.
[4]Cermák V,Kosla J,Plachý J,Trejbalová K,Hejnar J,Dvorák M.The transcription factor EGR1 regulates metastatic potential of v-src transformed sarcoma cells.Cell Mol Life Sci,2010,67(20):3557-3568.
[5]Sahai E,Garcia-Medina R,Pouysségur J,Vial E. Smurf1 regulates tumor cell plasticity andmotility through degradation of RhoA leading to localized inhibition of contractility.J Cell Biol,2007,176(1):35-42.
[6]Wilkinson S,Paterson HF,Marshall CJ.Cdc42-MRCK and Rho-ROCK signalling cooperate in myosin phosphorylation and cell invasion.Nat Cell Biol,2005,7 (3):255-261.
[7]Park I,Han C,Jin S,Lee B,Choi H,Kwon JT,Kim D,Kim J,Lifirsu E,Park WJ,Park ZY,Kim do H,Cho C.Myosin regulatory light chains are required to maintain the stability of myosin II and cellular integrity.Biochem J,2011,434(1):171-180.
[8]Han ZD,Zhang YQ,He HC,Dai QS,Qin GQ,Chen JH,Cai C,Fu X,Bi XC,Zhu JG,Liao DJ,Lu XP,Mo ZY,Zhu YP,Zhong WD.Identification of novel serological tumor markers for human prostate cancer using integrative transcriptome and proteome analysis.Med Oncol,2012,29(4):2877-2888.
[9]Yan Z,Li J,Xiong Y,Xu W,Zheng G.Identification of candidate colon cancer biomarkers by applying a random forest approach on microarray data.Oncol Rep,2012,28(3):1036-1042.
[10]Lu Y,Liu P,Wen W,Grubbs CJ,Townsend RR,Malone JP,Lubet RA,You M.Cross-species comparison of orthologous gene expression in human bladder cancer and carcinogen-induced rodent models.Am J Transl Res,2010,3(1):8-27.
[11]Wong CC,Wong CM,Ko FC,Chan LK,Ching YP,Yam JW,Ng IO.Deleted in liver cancer 1(DLC1)negatively regulates Rho/ROCK/MLC pathway in hepatocellular carcinoma.PLoS One,2008,3(7):e2779.
[12]Orr KS,Shi Z,Brown WM,O'Hagan KA,Lappin TR,Maxwell P,Percy MJ.Potential prognostic marker ubiquitin carboxyl-terminal hydrolase-L1 does not predict patient survival in non-small cell lung carcinoma.J Exp Clin Cancer Res,2011,30:79.
[13]Lahoz A,Hall A.A tumor suppressor role for srGAP3 in mammary epithelial cells.Oncogene,2013,32(40):4854-4860.
[14]Götte M,Mohr C,Koo CY,Stock C,Vaske AK,Viola M,Ibrahim SA,Peddibhotla S,Teng YH,Low JY,Ebnet K,Kiesel L,Yip GW.miR-145-dependent targeting of junctional adhesion molecule A and modulation of fascin expression are associated with reduced breast cancer cell motility and invasiveness.Oncogene,2010,29(50):6569-6580.
[15]Morris DS,Tomlins SA,Rhodes DR,Mehra R,Shah RB,Chinnaiyan AM.Integrating biomedical knowledge to model pathways of prostate cancer progression.Cell Cycle,2007,6(10):1177-1187.
[16]Veltri RW,Park J,Miller MC,Marks L,Kojima M,van Rootselaar C,Khan MA,Partin AW.Stromal-epithelial measurements of prostate cancer in native Japanese and Japanese-American men.Prostate Cancer Prostatic Dis,2004,7(3):232-237.
[17]Comito G,Giannoni E,Segura C,Barcellos-de-Souza P,Raspollini MR,Baroni G,Lanciotti M,Serni S,Chiarugi P.Cancer-associated fibroblasts and M2-polarized macrophages synergize during prostate carcinoma progression.Oncogene,2014,33(19):2423-2431.
[18]Tsunoda T,Furusato B,Takashima Y,Ravulapalli S,Dobi A,Srivastava S,McLeod DG,Sesterhenn IA,Ornstein DK,Shirasawa S.The increased expression of periostin during early stages of prostate cancer and advanced stages of cancer stroma.Prostate,2009,69 (13):1398-1403.
[19]Ayala G,Tuxhorn JA,Wheeler TM,Frolov A,Scardino PT,OhoriM,WheelerM,SpitlerJ,Rowley DR.Reactive stroma as a predictor of biochemical-free recurrence in prostate cancer.Clin Cancer Res,2003,9(13):4792-4801.
[20]Sturge J,Wienke D,Isacke CM.Endosomes generate localized Rho-ROCK-MLC2-based contractile signals via Endo180 to promote adhesion disassembly.J Cell Biol,2006,175(2):337-347.
Expression level and predictive value of myosin light chain 9 in biochemical recurrence of prostate cancer
Zhang Zengqiang,Ye Yongkang,Huang Yaqiang,Wu Yongding,Li Mu,He Huichan.Department of Urology,Guangdong Key Laboratory of Clinical Molecular Medicine and Diagnostics,Guangzhou First People's Hospital,Guangzhou Medical University,Guangzhou 510180,China
Corresponding autor,He Huichan,E-mail:xiaohejian@21cn.com
ObjectiveTo investigate the expression level and predictive value of myosin light chain 9 (MYL9)in the biochemical recurrence of prostate cancer.MethodsThe expression levels of MYL9 in the prostate cancer and adjacent benign prostate tissues were assessed by proteomics technique and the results were further validated by western blot.Eventually,the bioinformatics analysis of MYL9 was performed using Taylor data to analyze the difference in the expression of MYL9 among prostate cancer patients with different ages,serum PSA levels,Gleason scores,pathological stages,whether metastasis or not and whether survived or not.ResultsProteomics results revealed that the expression level of MYL9 in the prostate cancer tissue was downregulated by 5.67 times compared with that in the adjacent benign prostate tissue(P<0.01);Western blot analysis indicated that the expression level of MYL9 in the prostate cancer tissue was 0.23±0.08,significantly lower compared with 0.73±0.06 in the adjacent benign prostate tissue(P<0.001);The expression of MYL9 in prostate cancer patients aged<66 years,with Gleason score<8,pathological staging<T3A,no tumor metastasis and the survived was significantly higher than that in their counterparts aged≥66 years,Gleason score ≥8,with pathological staging≥T3A,tumor metastasis and the dead(all P<0.001).Whether serum PSA level<4 μg/L exerted no effect on the expression of MYL9(P>0.05).The biochemical recurrence-free survival rate in prostate cancer patients with low expression of MYL9 was significantly lower compared with that in their counterparts highly expressing MLY9(χ2=11.575,P<0.001).ConclusionsMYL9 expression in theprostate cancer tissue was down-regulated compared with that in adjacent normal prostate tissue.Patients with lower expression level of MYL9 yielded worse clinical prognosis.
Prostate cancer;Myosin light chain;Proteomics;Clinical prognosis
2015-05-16)
(本文编辑:林燕薇)

10.3969/j.issn.0253-9802.2015.11.005
广东省科技计划项目(2013B021800055)
523059东莞,东莞市人民医院泌尿外科(张增强,叶永康,李牧);510180广州,广州医科大学广州市第一人民医院泌尿外科(黄亚强,吴永定,何慧婵)
,何慧婵,E-mail:xiaohejian@21cn.com

