罗非鱼骨胶原蛋白质的提取及其性质
叶 韬, 林 琳, 张晓霞, 姜绍通, 陆剑锋
(合肥工业大学 生物与食品工程学院,安徽 合肥230009)
罗非鱼骨胶原蛋白质的提取及其性质
叶 韬, 林 琳, 张晓霞, 姜绍通, 陆剑锋*
(合肥工业大学 生物与食品工程学院,安徽 合肥230009)
为充分利用鱼片加工废弃物鱼骨中的胶原蛋白质,采用单因素以及正交实验法,研究胃蛋白酶在酸性介质条件下提取罗非鱼骨胶原蛋白质的最佳工艺,精制后的胶原蛋白质采用SDSPAGE电泳、紫外及傅立叶变换红外扫描,圆二色检测,氨基酸分析,热变性温度测定等方法,分析胶原蛋白质的理化性质。结果显示:乳酸溶液pH 2.6,温度30℃,料液比1∶30(g/mL),加酶量200 U/g,提取时间24 h,此工艺条件下的粗胶原蛋白质提取率达到70.28%,得率为12.76%;罗非鱼骨胶原蛋白质含有2条α链和1条β链,属于典型的I型胶原蛋白质;罗非鱼骨胶原蛋白质的主要氨基酸为甘氨酸、脯氨酸、羟脯氨酸、谷氨酸和丙氨酸;罗非鱼骨胶原蛋白质的热变性温度为34.5℃。研究表明,采用胃蛋白酶提取鱼骨胶原蛋白质,提取率和纯度均较高。
罗非鱼骨;胶原蛋白质;理化性质
Keywords:Tilapia bone,collagen,physicochemical property
罗非鱼是目前我国出口创汇的优势养殖品种,2012年养殖产量约为145万t,出口产品以冻鱼片为主。在加工鱼片的过程中,产生大量低商业价值的下脚料,其中大部分是鱼骨,而鱼骨蛋白质含量丰富,且主要为胶原蛋白质,因此大量的下脚料蕴含着巨大的胶原蛋白质资源[1]。
胶原蛋白质是动物体内含量最多的一类蛋白质,占机体总蛋白质含量的30%左右,它在医疗保健、食品工业、美容与化妆品、新型生物材料等领域有着广泛应用[2]。传统工业上的胶原蛋白质来源主要为牛羊的皮和骨,但由于畜传染病,宗教信仰等原因,致使水产动物胶原蛋白质的安全性和适用人群范围均优于传统来源的牲畜类胶原蛋白质[3]。此外,从水产品加工废弃物中提取胶原蛋白质,不仅有助于降低加工成本,增加产品的附加值,而且可以减少环境污染。
Zeng等[4]采用乙酸提取罗非鱼皮胶原蛋白质,研究了胶原蛋白质的氨基酸含量、紫外吸收特性、变性温度及溶解性等理化性质;曾少葵等[5]用胃蛋白酶从罗非鱼鳞中提取胶原蛋白质,并对酶解产物的抗氧化性进行研究,表明酶解产物具有良好的抗氧化效果;段宙位等[6]以罗非鱼尾为原料,研究鱼尾脂溶性色素的去除方法及胶原蛋白质的提取工艺,测定胶原蛋白质的纯度为84.61%,并通过紫外吸收光谱和蛋白电泳初步鉴定为Ⅰ型胶原蛋白质。然而,国内外学者对罗非鱼骨胶原蛋白质的研究报道较少。鉴于此,本文作者对罗非鱼骨胶原蛋白质的提取工艺进行优化,并对其理化性质进行检测,为今后综合开发利用罗非鱼片加工副产物提供了理论依据。
1 材料与方法
1.1 材料与试剂
罗非鱼骨,取自广东明基水产品有限公司;胃蛋白酶(1∶3 000,活力为5 346 U/g),购于上海源聚生物科技有限公司;柠檬酸、乳酸、乙酸和浓盐酸等,均为分析纯,购于合肥美丰化工仪器有限公司。
1.2 仪器与设备
722E型可见分光光度计,上海光谱仪器有限公司制造;DHG-9123J精密恒温鼓风干燥箱,上海三发科学仪器有限公司制造;FD-1B-50型冷冻干燥机,北京博医康实验仪器有限公司制造;TU-1901型双光束紫外分光光度计,北京普析通用器有限公司制造;Nicolet 67型傅里叶红外光谱仪,美国Thermo Nicolet公司制造;L-8800型氨基酸分析仪,日本日立公司制造;DYY-11型电泳仪,北京六一仪器厂制造;VP-DSC微量差示扫描量热仪,美国MICROCAL公司制造;J-810圆二色光谱仪,日本JASCO公司制造。
1.3 罗非鱼骨基本营养成分测定
水分,参照GB 5009.3-2010《食品中水分的测定》中的直接干燥法进行测定;灰分,参照GB 5009.4-2010《食品中灰分的测定》中的灼烧称重法进行测定;粗蛋白质,参照GB 5009.5-2010《食品中蛋白质的测定》中的凯氏定氮法测定;粗脂肪,参照GB/T 5009.6-2003《食品中脂肪的测定》中的索氏抽提法测定。
1.4 胶原蛋白质提取原料的制备
1.4.1 工艺流程罗非鱼骨→粉碎→脱脂→脱矿物质→脱杂蛋白质→脱杂鱼骨
1.4.2 工艺说明脱脂:在粉碎的鱼骨中加入30倍的体积分数10%的异丙醇,浸泡24 h,过滤,蒸馏水洗净;脱矿物质:15℃条件下,加入8倍0.5 mol/L的盐酸,浸泡1 h,重复3次,蒸馏水洗净;脱杂蛋白质:先用 NaOH(0.1 mol/L)溶液浸泡6 h,过滤,蒸馏水洗净,再用30倍体积的质量分数2.5%NaCl溶液浸泡6 h,蒸馏水洗净。详见文献[7]。
1.5 胶原蛋白质提取工艺与纯化
1.5.1 工艺流程脱杂鱼骨→调节料液比→加酶控温酶解→离心→取上清液→粗提的胶原蛋白质→盐析→透析→冷冻干燥→精制的胶原蛋白质。
1.5.2 工艺说明盐析:取上清液加NaCl至其终浓度为 0.9 mol/L,4℃盐析过夜,盐析后4℃下6 000 r/min离心20 min,沉淀用0.5 mol/L乙酸溶解,重复操作1次;透析:将盐析后的蛋白质液移入透析袋,用蒸馏水透析3 d,每天更换透析水3次,最后真空冷冻干燥[8]。
1.6 L-羟脯氨酸标准曲线的绘制
用0.001 mol/L盐酸将L-羟脯氨酸分别配制成2、4、6、8 μg/mL的标准溶液;取1 mL标准液,经过氯胺T和高氯酸氧化,生成含有吡咯环的氧化物,与对二甲基氨基苯甲醛进行显色反应,以浓度0.001 mol/L盐酸为空白,测定在560 nm处的吸光度。取吸光值为纵坐标,L-羟脯氨酸质量浓度为横坐标,绘制标准曲线,如图1所示。经计算得到回归方程y=0.068x-0.001;变异系数R2=0.998。

图1 L-羟脯氨酸标准曲线Fig.1 Standard curve of L-hydroxyproline
1.7 胶原蛋白质含量及提取率的测定
参照陆剑锋等[8]的方法。取15 mg罗非鱼骨至安瓿瓶中,加入6 mol/L的盐酸溶液1 mL,用酒精喷灯封口,于130℃下消化3 h;水解液定容至50 mL,并取稀释后的水解液1 mL,按羟脯氨酸标准曲线法,将吸光度值由回归方程进行换算,可得羟脯氨酸含量,再乘以换算系数11.1,即可得胶原蛋白质的含量。

式(1)中:W为粗胶原蛋白质质量分数,ρ为羟脯氨酸质量浓度,n为稀释倍数,m为鱼骨质量。
取0.5 mL胶原蛋白质提取液,按照粗胶原蛋白质含量测定的方法测定其胶原蛋白质含量。

式(2)中:r为胶原蛋白质提取率,ρ为羟脯氨酸质量浓度,n为稀释倍数,w为脱杂罗非鱼骨胶原蛋白质质量浓度。
1.8 胶原蛋白质的SDS-PAGE凝胶电泳测定
参照Senaratne等[9]的方法。样品处理:取0.5 g精制的胶原蛋白质,加入4.5 mL质量分数5%的SDS溶液,于85℃水浴锅内加热1 h,充分溶出蛋白质,冷却后于10 000 r/min离心10 min,上清液与SDS缓冲液按体积比1∶1混合,置沸水浴煮沸5 min,冷却后分别稀释2倍和5倍进样,进样量10 μL;电泳:用质量分数10%分离胶和质量分数5%浓缩胶,电压100 V,待指示剂距凝胶底部3~5 mm左右停止电泳。用考马斯亮蓝R-250染色液染色10 min,脱色液脱色至条带清晰,并拍照。
1.9 胶原蛋白质的紫外(UV)光谱扫描
用0.5 mol/L乙酸溶解适量冷冻干燥后的罗非鱼骨胶原蛋白质,配制成约为0.5 mg/mL的胶原蛋白质溶液,并用0.5 mol/L乙酸溶液作为参照,在190~360 nm波长范围内进行吸收波谱扫描,分辨率为1 nm。
1.10 胶原蛋白质的傅立叶变换红外(FT-IR)扫描
称取冷冻干燥后的纯化样品约1 mg,与一定量干燥好的KBr混合置于玛瑙研钵中,研磨成细微粉末状后装样,手动压片,采用傅立叶变换红外扫描仪在400~4 000 cm-1区间内进行吸收波谱扫描。
1.11 胶原蛋白质的热变性温度测定
用0.5 mol/L乙酸溶解适量冷冻干燥后的罗非鱼骨胶原蛋白质,配制成约3 mg/mL的胶原蛋白质溶液,并以0.5 mol/L乙酸作为参比,放入VP-DSC微量差示扫描量热仪中,加热温度为5~60℃,升温速率1℃/min。
1.12 胶原蛋白质的圆二色性测定
用0.5 mol/L乙酸溶解适量冷冻干燥后的罗非鱼骨胶原蛋白质,配制成10 mg/mL的胶原蛋白质溶液,比色皿光径为1 mm,分辨率1.0 nm,扫描速率100 nm/min,扫描5次,测定190~230 nm的圆二色光谱图。
2 结果与分析
2.1 罗非鱼骨基本营养成分
由表1可知,罗非鱼骨的粗蛋白质含量丰富,质量分数约为23%,高于鮰鱼骨中 (质量分数19.4%)以及鲢鱼骨中(质量分数8.9%)的[10],因此有必要充分开发利用罗非鱼的鱼骨蛋白质资源。此外,灰分含量也较高,表明骨钙等矿质元素较多,今后可以考虑进一步综合开发利用。
2.2 鱼骨及脱杂鱼骨的胶原蛋白质含量
经测定,罗非鱼骨的初始总胶原蛋白质质量分数为18.3%,约占粗蛋白质总量的80%;而脱杂后的罗非鱼骨其胶原蛋白质质量分数为20.4%。叶小燕等[11]和张颖洁[12]的研究表明,罗非鱼皮和鱼鳞的胶原蛋白质质量分数分别为27.8%和26.3%。由此可见,罗非鱼骨的胶原蛋白质含量较高,仅次于罗非鱼皮和鱼鳞中胶原蛋白质含量。
表1 罗非鱼骨的基本营养成分(以湿基计)Table 1 Content of basic nutrition in tilapia bone(on wet basis)±SD

表1 罗非鱼骨的基本营养成分(以湿基计)Table 1 Content of basic nutrition in tilapia bone(on wet basis)±SD
基本营养成分质量分数/%水分18.56±1.88灰分54.68±2.15粗蛋白质22.99±0.49粗脂肪2.72±0.05
2.3 胶原蛋白质提取介质的选取
在料液比为1∶30(g/mL),加酶量为200 U/g,30℃条件下,使用柠檬酸、乳酸、乙酸为介质,在pH值分别为1.7、2.0、2.3、2.6、2.9和3.2时提取12 h,结果如图2所示。

图2 不同pH条件下采用柠檬酸、乳酸和乙酸为介质的胶原蛋白质提取率Fig.2 Extraction yield of collagen with different pH conditions by using citric acid,lactic acid and acetic acid as medium
由图2可知,不同种类的酸介质,在相同的pH值条件下,对罗非鱼骨胶原蛋白质的提取效果不同。其中,选择pH值为2.6的乳酸为介质时,胶原蛋白质的提取率最高,其次是pH值为2的乙酸介质,而柠檬酸的提取率最低。这可能是由于氢离子的质子化作用使得胶原蛋白质在酸溶液中易充分溶胀,但相比于醋酸和柠檬酸,乳酸溶液在pH为2.6时含有更多能形成氢键作用的基团,从而提高了胶原蛋白质在乳酸溶液中的溶解度[13]。同时考虑到无水乙酸在常温下具有强烈的刺激性气味,且低温时也易形成冰状结晶析出(熔点16.6℃),不利于后续的试验操作[14],因此本试验中选取乳酸为提取介质。
2.4 胶原蛋白质提取温度的确定
以pH 2.6的乳酸为提取介质,料液比1∶40(g/ mL),加酶量为200 U/g,提取12 h,考察不同温度对提取率的影响。由图3可知,在10~30℃范围内,提取温度越高,酶促反应越快,胶原蛋白质的提取率随温度的升高而增大,这与程波等[15]用胃蛋白酶提取鲟鱼皮和刁雪洋[16]用木瓜蛋白酶提取猪皮胶原蛋白质时得到的结论一致。此外,Potaros等[17]的研究表明,采用胃蛋白酶在22℃和4℃条件下提取罗非鱼皮胶原蛋白质,得到的胶原蛋白质在氨基酸含量、热变性温度以及相对分子质量方面均无显著性差异。根据本试验的结果,同时考虑到过高的温度可能会引起胶原蛋白质变性,需将提取温度控制在变性温度以下,因此本试验中选取的提取温度为30℃。
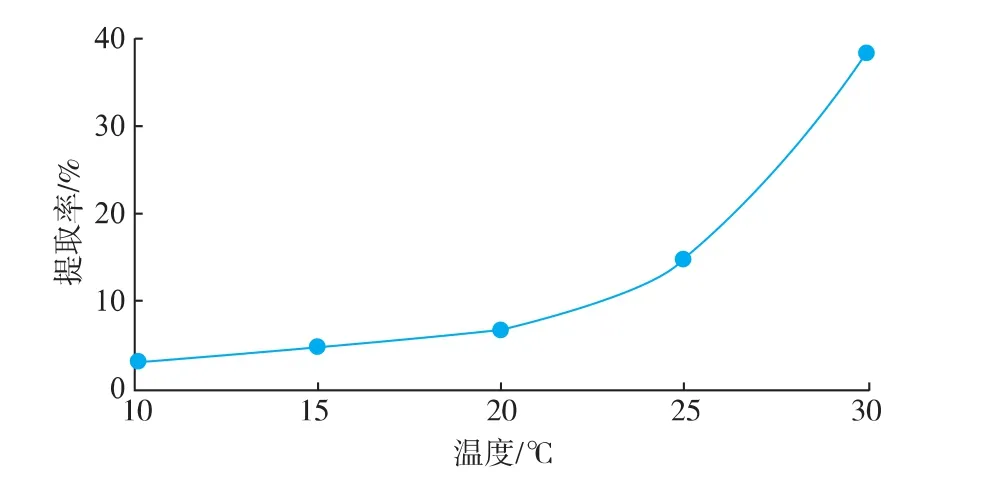
图3 温度对胶原蛋白质提取率的影响Fig.3 Effect of different temperature on extraction rate of collagen
2.5 胶原蛋白质提取料液比的确定
以pH 2.6的乳酸为提取介质,加酶量为200 U/ g,30℃条件下,提取时间为12 h,考察不同料液比对提取率的影响。由图4可知,提取率随底物浓度的减小而增大,当底物浓度减小到一定程度时,提取率趋于平稳。段宙位等[6]利用胃蛋白酶法提取罗非鱼尾胶原蛋白质,料液比达到一定程度时,胶原蛋白质溶出基本达到平衡,提取率增加的幅度不大,这与本试验的结果一致。当底物浓度过大时,酶促反应被抑制,而当底物被分散到一定程度时,反应达到平衡,因此本试验中选取料液比为1∶40(g/ mL)进行正交优化。
2.6 胶原蛋白质提取加酶量的确定
胃蛋白酶只对胶原蛋白质的非螺旋末端的分子交联区域起作用,不会破坏三股螺旋结构,采用胃蛋白酶制备胶原蛋白质是有效的方法[18]。以pH为2.6的乳酸为提取介质,料液比为1∶40(g/mL),加酶量为200 U/g,30℃条件下提取12 h,考察不同加酶量对提取率的影响。由图5可知,随着加酶量的增加,提取率先升高后降低,在200 U/g时到达最大值。该结果表明,此时反应体系中的酶活力可能处于最大,酶与底物恰好能够完全反应,如果继续添加酶量则反而会起到阻碍作用,抑制酶解反应的进行[19]。因此本试验中选取的加酶量为200 U/g。

图4 不同料液比对胶原蛋白质提取率的影响Fig.4 Effect of different solid-liquid ratio on extraction rate of collagen

图5 不同加酶量对胶原蛋白质提取率的影响Fig.5 Effect of different enzyme dosage on extraction rate of collagen
2.7 胶原蛋白质提取时间的确定
以pH 2.6的乳酸为提取介质,料液比1∶40(g/ mL),加酶量为200 U/g,30℃条件下考察提取时间对提取率的影响。由图6可知,随着时间的延长,提取率不断升高,当提取时间达到21 h时左右,增幅明显减小,因此本试验中选取提取时间21 h进行正交优化。
2.8 酶水解条件的正交优化
在单因素试验基础上,选择料液比(A)、提取时间(B)与加酶量(C)作为试验因子,以胶原蛋白质提取率为指标,采用L9(34)正交试验设计,对罗非鱼骨胶原蛋白质的提取条件进行优化,因素水平见表2,不同因素水平组合的正交试验设计方案与试验结果见表3。

图6 提取时间对胶原蛋白质提取率的影响Fig.6 Effect of extraction duration on extraction rate of collagen

表2 正交试验设计表Table 2 Orthogonal design of experiment
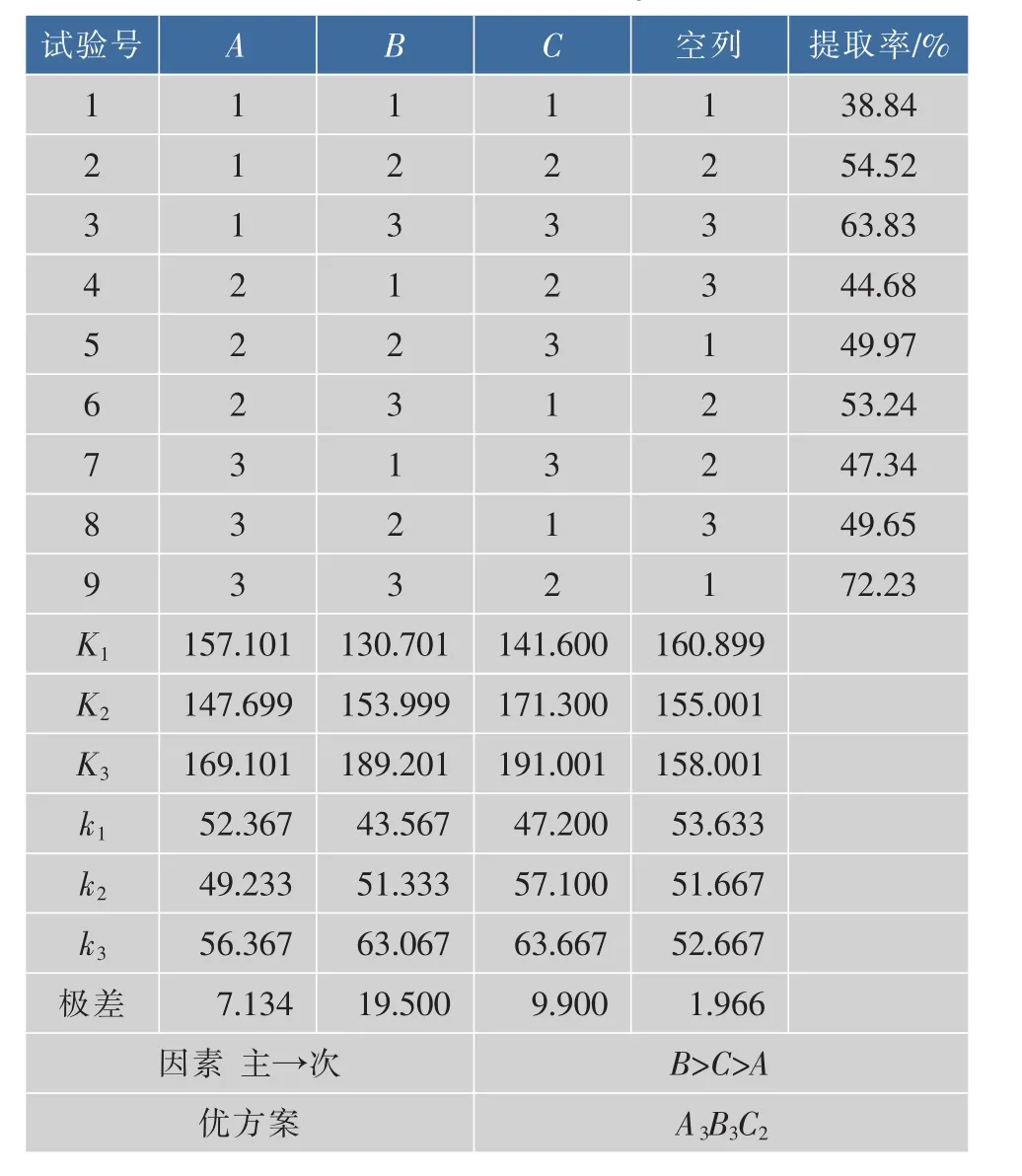
表3 L9(34)正交分析Table 3 L9(34)analysis
由极差分析结果可知,影响罗非鱼骨胶原蛋白质提取率的主次因素为B>C>A(较显著的因素是提取时间,其次为酶添加量,料液比不显著),最佳因素水平的组合为B3C2A3,即提取时间24 h,加酶量200 U/g,料液比1∶50(g/mL)。鉴于料液比对罗非鱼骨胶原蛋白质提取率的影响不显著,进一步选取料液比为1∶30(g/mL),酶添加量200 U/g,提取时间24 h,此时提取率达到70.28%,相对误差仅为2.77%。从节约成本考虑,最后选择料液比1∶30(g/mL)进行后续试验。此条件下,相对于原料鱼骨的初始质量而言,罗非鱼骨胶原蛋白质的最终得率为12.76%。
2.9 紫外扫描图谱
胶原蛋白质肽链所含的C=O、—COOH、CONH2都是生色基团,分子中的价电子吸收能量发生跃迁,可在220 nm附近产生较强的紫外吸收。大多数蛋白质由于含有一定量的色氨酸,因而在280 nm处具有较强的紫外吸收,但是胶原蛋白质几乎不含色氨基酸,所以在280 nm处无明显吸收[4]。罗非鱼骨胶原蛋白质的紫外吸收光谱如图7所示,罗非鱼骨胶原蛋白质在220~240 nm处有较强吸收峰,在228 nm处有最大吸收峰,而在280 nm处没有显著吸收峰,符合胶原蛋白质的紫外吸收特征。Duan等[20]报道了鲤鱼骨胶原蛋白质在223 nm处有最大吸收峰,与罗非鱼骨胶原蛋白质略有差异,可能是由于不同动物胶原蛋白质的氨基酸种类和含量不同导致。

图7 罗非鱼骨胶原蛋白质的紫外扫描图谱Fig.7 UV scanning spectra of collagen from tilapia bone
2.10 氨基酸组成分析
胶原蛋白质较其他蛋白质的氨基酸组成有一个明显的特征,即含有大量的甘氨酸以及丰富的亚氨基酸(脯氨酸和羟脯氨酸)等[14]。由表4可知,在罗非鱼骨胶原蛋白质中,甘氨酸质量分数最高,占22.85%;其次是亚氨基酸(脯氨酸和羟脯氨酸),占21.47%;谷氨酸和丙氨酸质量分数也较高,分别占9.77%和9.46%;几乎不含或仅含少量的苯丙氨酸和半胱氨酸。
2.11 SDS-PAGE凝胶电泳
由图8可知,用胃蛋白酶经乳酸介质提取的罗非鱼骨胶原蛋白质含3条链,即α1、α2和β,表明提取的胶原蛋白质属于典型的Ⅰ型胶原蛋白质[21]。α1链的相对分子质量约为120 kD,α2链的相对分子质量在100~120 kD之间,β链的相对分子质量略大于200 kD。α1链的含量最高,其次是α2链,而β链含量最低。此外,无论是高浓度样品(泳道2),还是稀释后的样品(泳道3和4),电泳图谱中几乎不含杂带,可见所提胶原蛋白质纯度较高。
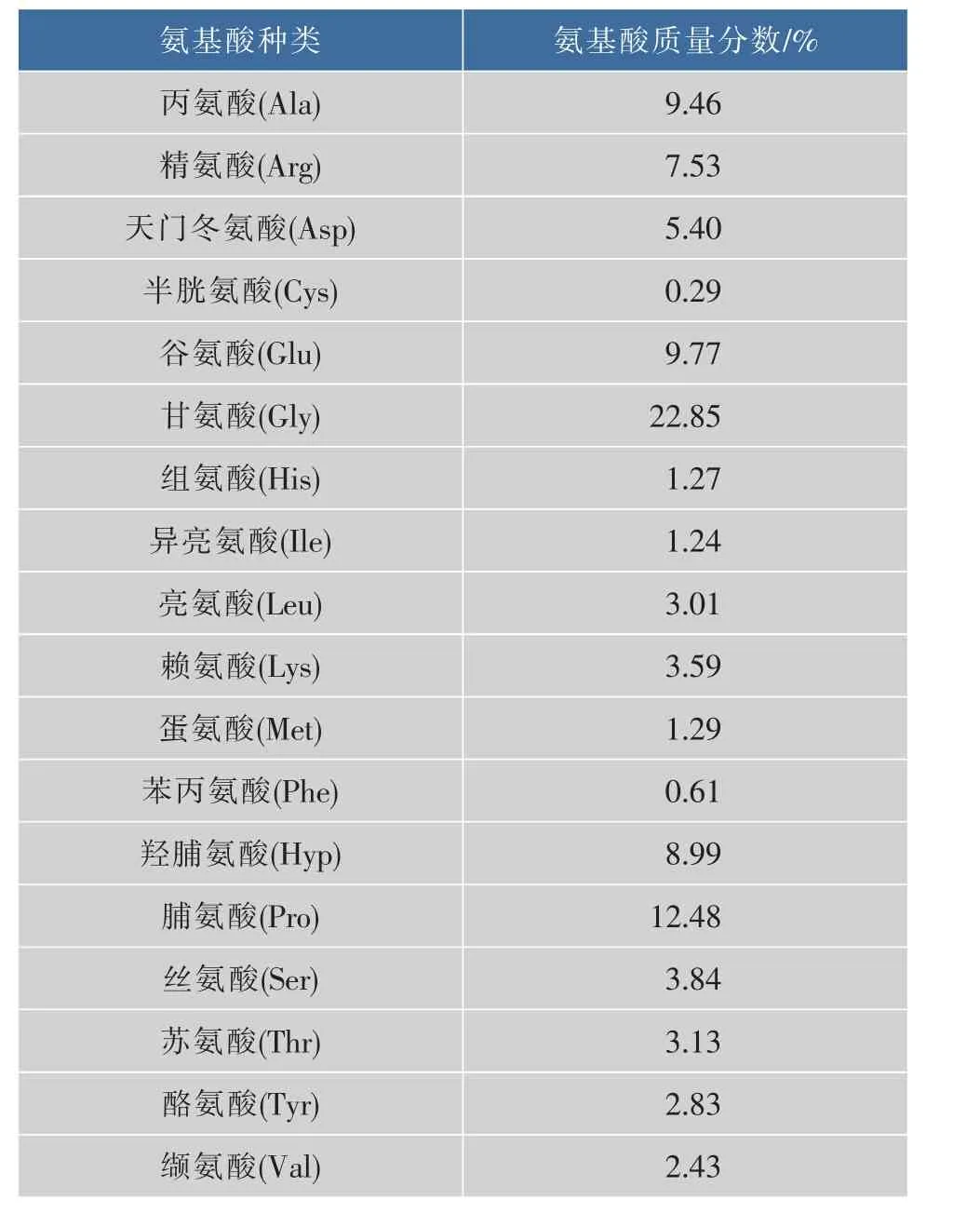
表4 罗非鱼骨胶原蛋白质的氨基酸组成Table 4 Amino acid composition of collagen from tilapia bone
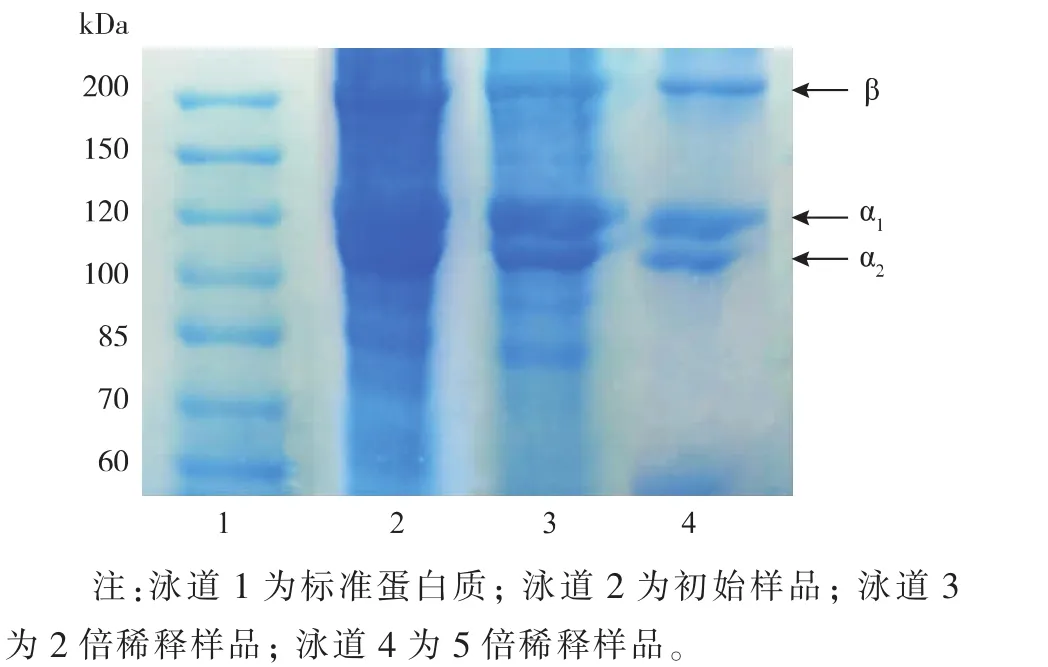
图8 罗非鱼骨胶原蛋白质的电泳图谱Fig.8 SDS-PAGE pattern of collagen from tilapia bone
2.12红外扫描图谱
酰胺A带主要是由N—H伸缩振动产生的,吸收峰出现在3 400~3 440 cm-1,但它与氢键缔合后,将向低波数发生位移;酰胺B是由CH2的不对称伸缩振动产生的;酰胺Ⅰ带是由蛋白多肽骨架的C=O伸缩振动引起,特征吸收频率位于1 600~1 700 cm-1之间,为蛋白质二级结构变化的敏感区域,且其吸收最强,常被用于蛋白质的二级结构分析;酰胺Ⅱ带由C—N伸缩振动与N—H弯曲振动产生,其特征吸收频率为1 500~1 600 cm-1,是胶原蛋白肽链α螺旋、β折叠、转角和无规卷曲叠加,以及精氨酸、天门冬氨酸和谷氨酸侧链的吸收带;酰胺Ⅲ带是由C—N伸缩振动和N—H弯曲振动形成的,特征吸收范围为 1 200~1 360 cm-1,属于甘氨酸骨架和脯氨酸侧链的CH2摇摆振动峰,是胶原蛋白质不同于其它蛋白质的特征吸收峰[22]。罗非鱼骨胶原蛋白质的傅立叶变换红外扫描(FT-IR)图谱如图9所示,酰胺A出现在3 324 cm-1处,表明N—H伸缩振动与氢键形成了缔合体,2 923 cm-1处的吸收是由酰胺B带的C—N伸缩振动产生的,酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带分别出现在 1 652、1 544 cm-1和1 234 cm-1,均符合胶原蛋白质的特征吸收峰。这与Sigma I型标准胶原蛋白质[23]具有较高的相似度。

图9 罗非鱼骨胶原蛋白质的傅立叶红外转换扫描图谱Fig.9 Fourier transform infrared spectrum of collagen from tilapia bone
2.13 胶原蛋白质的热变性温度的测定
图10为罗非鱼骨胶原蛋白质的差示量热扫描(DSC)图谱。由图10可知,罗非鱼骨胶原蛋白质的变性温度为34.5℃,高于变性温度为30.0℃的鲤鱼骨酶溶性胶原蛋白质[24]。Pati等[25]的研究认为,水产动物胶原的热变性温度不仅与栖息环境的温度有关,还与胶原蛋白质的亚氨基酸(脯氨酸和羟脯氨酸)含量有关,因为亚氨基酸的吡咯环和羟脯氨酸的羟基所形成的氢键对胶原结构的稳定起着重要作用。Ikoma等[26]的研究表明,真鲷、罗非鱼的Ⅰ型鱼鳞胶原蛋白质的热变性温度与羟脯氨酸的含量之间呈良好的线性关系。而罗非鱼属于热带鱼类,抗冻能力差,其栖息水温不仅高于鲤鱼,而且其骨胶原蛋白质中的亚氨基酸质量分数(21.47%)也高于鲤鱼骨胶原蛋白质的(20.4%),推测这可能是罗非鱼骨胶原蛋白质的变性温度高于鲤鱼骨胶原蛋白质的变性温度所致。

图10 罗非鱼骨胶原蛋白质的热变性温度图谱Fig.10 DSC spectrum of collagen from tilapia bone
2.14 胶原蛋白质的圆二色光谱
罗非鱼骨胶原蛋白质在远紫外区的圆二色谱图见图11。圆二色光谱分析(Circular dichroism简称CD)是研究稀溶液中蛋白质构象的一种快速、简单、较准确的方法[27]。由图11可知,罗非鱼骨胶原蛋白质在198 nm处有一负峰,在222 nm处有一正峰,表明提取的胶原蛋白质具有完整的3股螺旋结构,这也符合Ⅰ型胶原蛋白质的典型特征[26]。

图11 罗非鱼骨胶原蛋白质的圆二色图谱Fig.11 CD spectrum of collagen from tilapia bone
3 结语
1)胃蛋白酶提取脱杂罗非鱼骨中胶原蛋白质的最佳工艺条件为:选择pH 2.6的乳酸为提取介质,在温度30℃下,调整料液比为1∶30(g/mL),加酶量200 U/g,提取时间24 h,此时粗胶原蛋白质提取率可以达到70.28%,而相对于原料鱼骨初始质量的得率为12.76%。
2)罗非鱼骨胶原蛋白质的酸溶液在228 nm处有最大紫外吸收峰,蛋白质电泳、红外光谱扫描和圆二色光谱结果均表明其结构符合Ⅰ型胶原蛋白质的典型结构特征,即由3条肽链(α1,α2和β)组成的3股螺旋结构。
3)罗非鱼骨胶原蛋白质的主要氨基酸为甘氨酸和亚氨基酸(脯氨酸和羟脯氨酸),其次为谷氨酸和丙氨酸,其蛋白质变性温度为34.5℃。
[1]焦道龙,陆剑锋,张伟伟,等.水产动物胶原蛋白的研究现状及发展趋势[J].食品科学,2009(17):334-338.
JIAO Daolong,LU Jianfeng,ZHANG Weiwei,et al.Current research status and development of aquatic animal collagen[J].Food Science,2009(17):334-338.(in Chinese)
[2]Aberoumand A.Isolation and characteristics of collagen from fish waste material[J].World Journal of Fish and Marine Sciences,2010,2(5):471-474.
[3]Ahmad M,Benjakul S.Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket(Aluterus monocerous)[J].Food Chemistry,2010,120(3):817-824.
[4]Zeng S,Zhang C,Lin H,et al.Isolation and characterisation of acid-solubilised collagen from the skin of Nile tilapia(Oreochromis niloticus)[J].Food Chemistry,2009,116(4):879-883.
[5]曾少葵,蓝海明,章超桦,等.罗非鱼鳞胶原蛋白的提取及其酶解产物的抗氧化性[J].上海海洋大学学报,2009,18(5):599-603.
ZENG Shaokui,LAN Haiming,ZHANG Chaohua,et al.Study on the extraction of collagen from scale of tilapia and antioxidant activity of its hydrolysate[J].Journal of Shanghai Ocean University,2009,18(5):599-603.(in Chinese)
[6]段宇位,申铉日,陈秀明,等.罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学,2012,33(6):59-64.
DUAN Yuwei,SHEN Xuanri,CHEN Xiuming,et al.Extraction and identification of collagen from tilapia tail[J].Food Science,2012,33(6):59-64.(in Chinese)
[7]Nagai T,Suzuki N.Isolation of collagen from fish waste material—skin,bone and fins[J].Food Chemistry,2000,68(3):277-281.
[8]陆剑锋,万全,殷章敏,等.中华鳖裙边胶原蛋白的提取及其特征[J].水产学报,2010,34(6):801-808.
LU Jianfeng,WAN Quan,YIN Zhangming,et al.Extraction and characterization of collagen from calipash of Chinese soft-shelled turtle(Pelodiscus sinensis)[J].Journal of Fisheries of China,2010,34(6):801-808.(in Chinese)
[9]Senaratne L S,Park P J,Kim S K.Isolation and characterization of collagen from brown backed toadfish(Lagocephalus gloveri)skin[J].Bioresource Technology,2006,97(2):191-197.
[10]吴缇,陈舜胜.斑点叉尾鲴鱼骨胶原蛋白的提取与特性研究[J].食品工业科技,2009(3):263-266.
WU Ti,CHEN Shunsheng.Study on extraction and characteristics of the collagen from channel catfish bone[J].Science and Technology of Food Industry,2009(3):263-266.(in Chinese)
[11]叶小燕,曾少葵,余文国,等.罗非鱼皮营养成分分析及鱼皮明胶提取工艺的探讨[J].南方水产,2008,4(5):12.
YE Xiaoyan,ZENG Shaokui,YU Wenguo,et al.Study on nutrient components and the extracting condition of the skin gelatin of tilapia[J].South China Fisheries Science,2008,4(5):12.(in Chinese)
[12]张颖洁.罗非鱼鳞胶原蛋白提取的研究[D].广州:华南理工大学,2010.
[13]Gómez-Guillén M C,Giménez B,López-Caballero M E,et al.Functional and bioactive properties of collagen and gelatin from alternative sources:A review[J].Food Hydrocolloids,2011,25(8):1813-1827.
[14]宫子慧.鮰鱼皮胶原蛋白的提取、特性和生物活性的研究[D].合肥:合肥工业大学,2012.
[15]程波,吴洁,张玉蓉,等.酶法提取人工养殖鲟鱼皮中胶原蛋白的工艺研究[J].食品研究与开发,2009,30(3):1-4.
CHENG Bo,WU Jie,ZHANG Yurong,et al.Study on the extraction of collagen with enzyme from the skin of farmed sturgeon[J]. Food Research and Development,2009,30(3):1-4.(in Chinese)
[16]刁雪洋.猪皮胶原蛋白提取及理化特性的研究[D].重庆:西南大学,2010.
[17]Potaros T,Raksakulthai N,Runglerdkreangkrai J,et al.Characteristics of collagen from Nile Tilapia(Oreochromis niloticus)skin isolated by two different methods[J].Kasetsart Journal,2009,43:584-593.
[18]Zelechowska E,Sadowska M,Turk M.Isolation and some properties of collagen from the backbone of Baltic cod(Gadus morhua)[J].Food Hydrocolloids,2010,24(4):325-329.
[19]刘静波,赵颂宁,林松毅,等.酶解法提取黑木耳中胶原蛋白的工艺优化[J].农业工程学报,2012,28(13):282-286.
LIU Jingbo,ZHAO Songning,LIN Songyi,et al.Process optimization on extracting collagen with enzymolysis method from black fungus[J].Transactions of the Chinese Society of Agricultural Engineering,2012,28(13):282-286.(in Chinese)
[20]Duan R,Zhang J,Du X,et al.Properties of collagen from skin,scale and bone of carp(Cyprinus carpio)[J].Food Chemistry,2009,112(3):702-706.
[21]Mori H,Tone Y,Shimizu K,et al.Fish scale collagen of the Pacific saury(Cololabis saira)[J].Materials Science and Engineering:C,2013,33(1):174-181.
[22]Liu D,Liang L,Regenstein J M,et al.Extraction and characterisation of pepsin-solubilised collagen from fins,scales,skins,bones and swim bladders of bighead carp(Hypophthalmichthys nobilis)[J].Food Chemistry,2012,133(4):1441-1448.
[23]刘苏锐,王坤余,琚海燕.猪皮Ⅰ型胶原蛋白的提取及其结构表征[J].中国皮革,2007,36(7):43-46.
LIU Suru,WANG Kunyu,JU Haiyan.Isolation and characterization of typeⅠcollagen from pigskins[J].China Leather,2007,36(7):43-46.(in Chinese)
[24]段蕊,张俊杰,陈玲,等.鲤鱼鱼皮和鱼骨酶溶性胶原蛋白的性质比较[J].食品与发酵工业,2008,34(5):10-13.
DUAN Rui,ZHANG Junjie,CHEN Lin,et al.Characteristics comparison of pepsin-soluble collagen from skin and bone of carp(cyprinus carpio)[J].Food Research and Development,2008,34(5):10-13.(in Chinese)
[25]Pati F,Adhikari B,Dhara S.Isolation and characterization of fish scale collagen of higher thermal stability[J].Bioresource Technology,2010,101(10):3737-3742.
[26]Ikoma T,Kobayashi H,Tanaka J,et al.Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis niloticus[J].International Journal of Biological Macromolecules,2003,32(3-5):199-204.
[27]沈星灿,梁宏,何锡文,等.圆二色光谱分析蛋白质构象的方法及研究进展[J].分析化学,2004,32(3):388-394.
SHEN Xingcan,LIANG Hong,HE Xiwen,et al.Recent trends and spectroscopic methods for analysis of the protein conformation with circular dichroism[J].Chinese Journal of Analytical Chemistry,2004,32(3):388-394.(in Chinese)
Extraction and Characterization of Collagen from Tilapia Bone
YE Tao, LIN Lin, ZHANG Xiaoxia, JIANG Shaotong, LU Jianfeng*
(College of Biotechnology and Food Engineering,Hefei University of Technology,Hefei 230009,China)
Fish bone,containing plenty of collagen,is the main offal from fish fillet processing.The collagen from Tilapia bone after removing impurities was extracted by pepsin digestion in acid medium condition.The effects of extraction medium,temperature,material to liquid ratio,pepsin addition,extraction duration on yield of collagen were investigated.The optimum conditions using lactic acid as medium to extract collagen were pH 2.6,material to liquid ratio(w/v)1∶30,30℃,200 U/g pepsin addition,extraction time 24 h,and the yield of extracted collagen reached 70.28%(12.76%when compared with the initial weight of Tilapia bone).Then,the extracted crude collagen was further purified and its physicochemical property was determined by the methods of SDSPAGE,UV and FT-IR scanning,DSC,CD and amino acid analysis.The results indicated that the extracted Tilapia bone collagen belongs to typical collagenⅠwith two α and one β chains. Furthermore,the Tilapia bone collagen contains high percentages of Gly,Pro,Hyp,Glu and Ala and its denaturation temperature was 34.5℃.In conclusion,the extracted Tilapia bone collagen by pepsin digestion has a higher yield and purity.
TS 254.9;S 986.3
A
1673—1689(2015)03—0302—09
2014-03-08
安徽省115产业创新团队计划项目(2012d5t146);省部产学研结合重点项目(2012B091000121)。
*通信作者:陆剑锋(1976—),男,江苏常州人,理学博士,教授,硕士研究生导师,主要从事水生动物资源的保护和综合利用研究。
E-mail:lujf@sibs.ac.cn

