磷酸肌酸对大鼠子宫缺血再灌注损伤的影响
吕丽贤,张陈彦,安雪丽,张铭娜,张立新
磷酸肌酸对大鼠子宫缺血再灌注损伤的影响
吕丽贤,张陈彦,安雪丽,张铭娜,张立新

[作者单位]050011 石家庄,石家庄市第一医院产科
[摘要]目的探讨外源性磷酸肌酸预处理对大鼠子宫缺血再灌注损伤的保护作用及其机制。方法选择SD雌性大鼠45只,随机分为假手术组、缺血再灌注组和干预组,每组15只。干预组于缺血前30 min经腹腔注射磷酸肌酸注射液10 mg/kg,测定子宫组织中超氧化物歧化酶(SOD)活性和丙二醛(MDA)水平,并观察子宫病理组织学改变。结果与假手术组比较,缺血再灌注组和干预组大鼠子宫组织SOD活性明显降低,MDA含量明显增加(P<0.05);与缺血再灌注组比较,干预组SOD活性升高,MDA含量降低(P<0.05)。干预组病理组织学观察炎性反应较缺血再灌注组明显减轻。结论磷酸肌酸对大鼠子宫缺血再灌注损伤有保护作用,其机制可能与其增强SOD活性有关。
[关键词]磷酸肌酸;再灌注损伤;子宫;大鼠, Sprague-Dawley
子宫缺血再灌注损伤是造成大出血和子宫坏死等并发症的原因之一,如何减轻或防治子宫缺血再灌注损伤是目前研究热点。本实验通过建立大鼠子宫缺血再灌注模型,经磷酸肌酸预处理,观察子宫缺血再灌注损伤后超氧化物歧化酶(SOD)、丙二醛(MDA)变化及子宫病理组织学改变,探讨磷酸肌酸对大鼠子宫缺血再灌注损伤的保护作用及可能机制,为临床防治子宫缺血再灌注损伤提供依据。
1材料与方法
1.1实验动物及分组成年SD雌性大鼠45只(由河北医科大学动物实验中心提供,合格证号:1409115),体重(250±20)g,随机分为假手术组、缺血再灌注组和干预组,每组15只。
1.2试剂SOD免疫试剂盒(南京建成试剂有限公司提供),MDA测定试剂盒(上海谷研试剂有限公司提供),磷酸肌酸注射液(海口奇力制药股份有限公司提供)。
1.3动物模型制备缺血再灌注组和干预组禁食12 h,自由饮水,10%水合氯醛(350 mg/kg)腹腔注射麻醉。腹部正中切口进入腹腔,暴露子宫,在髂总动脉分叉处上方0.5 cm处用无创动脉夹夹闭腹腔动脉30 min,然后松开动脉夹再灌注60 min,造成子宫缺血再灌注模型[1]。假手术组以相同方法切开显露子宫及血管,但不夹闭动脉。缺血前30 min,干预组经腹腔注射磷酸肌酸10 mg/kg,假手术组和缺血再灌注组于相同时间给予同等体积生理盐水。
1.4SOD活性和MDA检测切取子宫组织2.0 cm×0.2 cm,碾磨制成组织匀浆,3000 r/min,离心,10 min,取上清液;SOD活性检测按照试剂盒说明书操作。MDA试剂盒测定大鼠子宫MDA水平:取大鼠子宫组织,滤纸拭干,称质量后,加入4℃ HEPES缓冲液中,其体积是子宫组织块质量的9倍,用玻璃匀浆器制成匀浆,以3000 r/min离心15 min,分装于-70℃冰箱中保存备用。按试剂盒说明书利用分光光度计检测子宫组织MDA水平。
1.5子宫病理组织学观察各组大鼠缺血或再灌注相应时间后取大鼠子宫。将所取大鼠子宫组织部分置于40 g/L多聚甲醛中4℃后固定,常规脱水,石蜡包埋后切片,苏木精-伊红染色显微镜下观察。将剩余的大鼠子宫组织置于冷生理盐水中漂洗干净,用于MDA的测定。
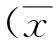
2结果
2.1SOD活性及MDA的变化与假手术组比较,缺血再灌注组和干预组大鼠子宫组织SOD活性明显降低,MDA含量明显增加(P<0.05);与缺血再灌注组比较,干预组SOD活性升高,MDA含量降低(P<0.05)。见表1。
表13组大鼠子宫组织中SOD活性
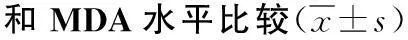

组别鼠数SOD(U/g)MDA(nmol/g)缺血再灌注组1523.63±3.16a59.54±8.71a干预组 1534.16±5.48ac41.08±5.96ac假手术组 1538.86±7.0135.81±7.41
注:SOD为超氧化物歧化酶,MDA为丙二醛;干预组经腹腔注射磷酸肌酸;与假手术组比较,aP<0.05;与缺血再灌注组比较,cP<0.05
2.2子宫组织形态学改变缺血再灌注组子宫组织细胞及间质明显水肿,渗出增加,肌纤维排列紊乱,部分溶解,可见较多炎细胞浸润;干预组子宫组织细胞及间质肿胀,肌纤维排列尚整齐,部分细胞及间质可见炎细胞浸润减少,明显轻于缺血再灌注组;假手术组子宫组织细胞及间质、肌纤维结构清晰,偶见炎细胞浸润。见图1~3。
3讨论
磷酸肌酸是参与细胞能量代谢重要的物质之一,是存在于细胞内的一种高能磷酸化合物[2-4],其通过促进磷酸核糖焦磷酸合成酶的作用,使细胞核苷酸得以保存,以合成二磷腺苷(ADP),为三磷腺苷(ATP)补充能量,而ATP是任何细胞代谢过程中最重要的能量来源。补充磷酸肌酸能够通过增加细胞中磷酸肌酸水平和ATP再合成的速率提高肌酸激酶/磷酸肌酸系统的功能[5]。在多数病理状态下,磷酸肌酸对靶细胞的能量损伤具有明显的疗效[6]。缺血缺氧引起细胞内磷酸肌酸耗竭,ATP生成减少,导致细胞膜上Na+-K+-ATP酶失活,Na+内流,细胞因钠水潴留出现肿胀[7]。外源性磷酸肌酸能够直接通过进入细胞膜内,显著增加磷酸肌酸的总体水平,使肌浆网上的钙ATP酶活性恢复,钙离子进入肌质网,避免细胞内钙超负荷激活黄嘌呤去氢酶转化为黄氧化酶,使氧自由基的产生减少[8]。
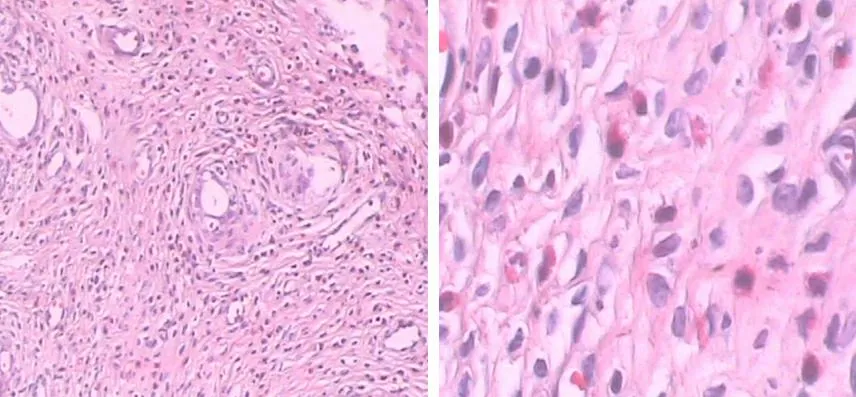
图1 缺血再灌注组子宫组织形态学显微镜观察所见
A.HE×100;B.HE×400

图2 干预组子宫组织形态学显微镜观察所见
A.HE×100;B.HE×400
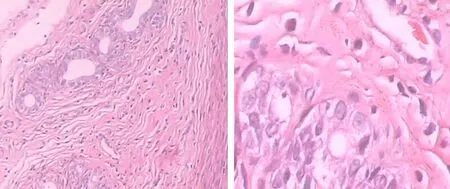
图3 假手术组子宫组织形态学显微镜观察所见
A.HE×100;B.HE×400
目前,磷酸肌酸广泛应用于心脏和肾缺血再灌注的疾病。磷酸肌酸可能是通过抑制炎性反应和激活磷脂酰肌醇3-激酶(PI-3K)/AKT/Bcl-2的信号传导途径对大鼠心肌缺血再灌注损伤起保护作用[9]。本实验对大鼠子宫缺血30 min前给予磷酸肌酸预处理,再灌注60 min,研究其对子宫缺血再灌注有无保护作用及其可能机制,为临床防治子宫缺血再灌注损伤提供实验依据。
目前在大多数器官系统中缺血再灌注是一个公认的灌注不良的后果[10-11]。缺血/缺氧导致细胞消耗存储的ATP和磷酸肌酸,恢复再灌注过程中,这些高能量磷酸盐是维持细胞稳态功能必不可少的。一般情况下,缺血再灌注损伤机制由自由基大量释放、白细胞的活化、内皮系统功能障碍和补体途径的激活等介导[12]。缺血/再灌注时组织及血浆中脂质过氧化物显著增高,脂质过氧化增强造成细胞结构损伤和功能代谢障碍,导致细胞膜氧化破坏引起细胞凋亡和坏死[13]。因此,脂质过氧化反应已证实与缺血再灌注损伤引起的组织损伤密切相关,并且脂质过氧化反应代谢产物——MDA是用来评估脂质率过氧化反应的良好指标[14]。内源性抗氧化酶,如SOD通过消除氧自由基阻碍活性氧的产生,抑制脂质过氧化作用,保护细胞免受活性氧的不利影响。SOD活性增加被认为是缺血再灌注过程自由基产生的标志[15],该抗氧化酶水平已被用来衡量在缺血再灌注损伤所发生的氧化应激的程度[16]。研究发现缺血再灌注损伤可广泛发生于人体各脏器,对于器官移植手术,如肝移植、肾移植等,缺血再灌注损伤的轻重,直接影响着移植器官的存活,但是对于子宫组织的缺血再灌注损伤相关研究较少[1]。
本研究结果显示,干预组子宫组织病理学改变较缺血再灌注组减轻,提示磷酸肌酸在减轻子宫缺血再灌注损伤方面有明显的保护作用;与假手术组比较,缺血再灌注组和干预组子宫组织MDA含量增高,SOD活性降低,但与缺血再灌注组比较,干预组子宫组织MDA含量降低,SOD活性升高,提示磷酸肌酸能使MDA生成减少,从而减轻缺血再灌注子宫组织的脂质过氧化损伤,提高子宫组织内SOD活性,增强其清除自由基的能力,维持了子宫肌细胞氧化和抗氧化平衡,从而保护子宫肌细胞。
综上所述,磷酸肌酸对大鼠子宫缺血再灌注损伤有保护作用,具体机制尚不清楚,可能与其增强SOD活性有关,有待进一步研究证实。
[参考文献]
[1]吉小微,王冬,张爽,等.子宫缺血再灌注损伤大鼠模型的建立[J].中国组织工程研究,2012,16(33):6164-6168.
[2]王霞.磷酸肌酸钠治疗新生儿窒息后心肌损害43例疗效观察[J].中国医药指南,2013(3):96.
[3]洪艳,姜赤秋.磷酸肌酸钠治疗新生儿窒息后心肌损害临床观察[J].医学理论与实践,2012,25(6):639-640.
[4]郑瑜.磷酸肌酸钠治疗窒息新生儿心肌损害的临床观察[J].中国临床医生,2013,41(1):42-43.
[5]Ireland Z, Castillo-Melendez M, Dickinson H,etal. A maternal diet supplemented with creatine from mid-pregnancy protects the newborn spiny mouse brain from birth hypoxia[J].Neuroscience, 2011,194:372-379.
[6]Strumia E, Pelliccia F, D'Ambrosio G. Creatine phosphate: pharmacological and clinical perspectives[J].Adv Ther, 2012,29(2):99-123.
[7]张彬,赵宏.磷酸肌酸的心肌保护机制及其在心脏疾病中的应用[J].医学综述,2008,14(2):262-264.
[8]Lankford A R, Yang J N, Rose'Meyer R,etal. Effect of modulating cardiac A1 adenosine receptor expression on protection with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol, 2006,290(4):1469-1473.
[9]Zhang W, Zhang H, Xing Y. Protective effects of phosphocreatine administered post-treatment combined with ischemic post-conditioning on rat hearts with myocardial ischemia/reperfusion injury[J].J Clin Med Res, 2015,7(4):242-247.
[10]Eltzschig H K, Eckle T. Ischemia and reperfusion-from mechanism to translation[J].Nat Med, 2011,17(11):1391-1401.
[11]Yamazaki K, Endo T, Kitajima Y,etal. Elevation of both cyclooxygenase-2 and prostaglandin E2 receptor EP3 expressions in rat placenta after uterine artery ischemia-reperfusion[J].Placenta, 2006,27(4-5):395-401.
[12]Gorsucha W B, Chrysanthoub E, Schwaebleb W J,etal. The complementsystem in ischemia-reperfusion injuries[J].Immunobiology, 2012,217:1026-1033.
[13]Kim J, Jang H S, Park K M. Reactive oxygen species generated by renal ischemia and reperfusion trigger protection against subsequent renal ischemia and reperfusion injury in mice[J].Am J Physiol Renal Physiol, 2010,298(1):F158-F166.
[14]Ersahin M, Ozsavcl D, Sener A,etal. Obestatin alleviates subarachnoid haemorrhage-induced oxidative injury in rats via its anti-apoptotic and antioxidant effects[J].Brain Inj, 2013,27(10):1181-1189.
[15]Canacankatan N, Sucu N, Aytacoglu B,etal. Affirmative effects of iloprost on apoptosis during ischemia-reperfusion injury in kidney as a distant organ[J].Ren Fail, 2012,34(1):111-118.
[16]Dobashi K, Ghosh B, Orak J K,etal. Kidney ischemia-reperfusion: modulation of antioxidant defenses[J].Mol Cell Biochem, 2000,205(1-2):1-11.
(收稿时间:2015-01-18修回时间:2015-02-28)
·论著·
Effect of Phosphocreatine on Uterine Ischemia-reperfusion Injury in Rats
LYU Li-xian, ZHANG Chen-yan, AN Xue-li, ZHANG Ming-na, ZHANG Li-xin (Department of Gynecology and Obstetrics, the First Hospital of Shijiazhuang, Shijiazhuang 050011, China)
[Abstract]ObjectiveTo study the protective effect and its mechanisms of exogenous creatine phosphate (PCr) preconditioning on uterine ischemia-reperfusion injury in rats. MethodsA total of 45 SD female rats were randomly divided into sham operation group (n=15), ischemia-reperfusion group (n=15) and intervention group (n=15). The intervention group was given 10 mg/kg PCr injection via intraperitoneal injection 30 min before ischemia. The activity of superoxide dismutase (SOD) and malondialdehyde (MDA) level in uterine tissues were detected, and the pathological changes of uterus were also observed. ResultsCompared with those in the sham operation group, the SOD activities were significantly reduced, while MDA levels were significantly increased in ischemia-reperfusion and intervention groups (P<0.05); compared with those in ischemia-reperfusion group, the SOD activity was significantly increased, and MDA level was significantly reduced in the intervention group (P<0.05). Histopathological observation showed that inflammatory reaction in the intervention group was significantly alleviated compared with that in the ischemia-reperfusion group. ConclusionPCr may protect uterine ischemia-reperfusion injury to a certain degree in rats, and the mechanisms may be related with its activation to SOD activity.
[Key words]Phosphocreatine; Reperfusion injury; Uterus; Rats, Sprague-Dawley
[DOI]10.3969/j.issn.2095-140X.2015.05.008
[文献标志码][中国图书资料分类号]R965;R-332A
[文章编号]2095-140X(2015)05-0026-03
[基金项目]石家庄市科技指导计划(141462453)

