三七多糖对大鼠脑缺血再灌注损伤的保护作用
李世英,谢云亮,于忠慧
三七(panax notoginseng)为我国传统名贵中药材,应用历史悠久,主产于云南、广西等省份,具有消肿定痛和活血化瘀等功效,临床上主要用于心绞痛、冠心病等心血管系统疾病的防治[1]。三七的主要活性成分包括皂苷、黄酮、多糖等,其中皂苷类成分研究的最为系统,而其它活性成分的研究报道较少[2]。三七多糖的活性研究主要集中在免疫调节及降血糖等方面,关于三七多糖在脑缺血再灌注方面的研究未见报道[3,4]。因此,本研究通过三七多糖预处理大鼠后,建立脑缺血再灌注损伤模型,考察三七多糖对大鼠脑缺血再灌注损伤是否具有保护作用,并初步探讨其可能的机制。
1 材料与方法
1.1 实验材料 三七多糖由本实验室分离、纯化;MDA、GSH-Px 和SOD 检测试剂盒购自南京建成生物研究所;TNF-α、IL-1β 及IL-10 检测试剂盒购自美国R&D 公司;其余试剂为国产分析纯。
1.2 模型建立、分组及给药 雄性Wistar 大鼠,体重250~300 g,购自吉林大学实验动物中心,适应性饲养1 w 后,随机分成5 组,假手术组、模型组、尼莫地平组[10 mg/(kg·d)]、三七多糖高剂量组[300 mg/(kg·d)]、三七多糖低剂量组[100 mg/(kg·d)],每组10 只。尼莫地平及三七多糖组连续灌胃给药15 d,每天1 次。假手术组和模型组则灌胃给予等体积生理盐水。采用Longa 改良方法[5],应用颈内动脉线栓法建立大鼠脑缺血再灌注模型。
1.3 脑组织含水量检测 缺血2 h 再灌注24 h 后,断头处死大鼠,取脑。称取脑组织湿重后,置105℃烘箱至恒重,再秤干重。用下列公示计算脑组织含水量:
脑组织含水量(%)=(脑组织湿重-脑组织干重)/脑组织湿重×100%
1.4 脑梗死面积检测 缺血2 h 再灌注24 h后,断头处死大鼠,取脑。经连续2 mm 冠状切片及TTC(2%)溶液染色,用多聚甲醛(4%)固定。不能被TTC 染色的白色区域为梗死区,应用美国NIH 公司的ImageJ 1.41 图像分析软件计算梗死面积大小。
1.5 脑组织MDA、GSH-Px、SOD、TNF-α、IL-1β和IL-10 测定 于再灌注后24 h 将各组大鼠处死,取缺血再灌注侧大脑,用滤纸吸去残血,准确称重。在冰水浴条件按下,加入4 ℃生理盐水上(1∶ 9),匀浆后,离心(4000 r/min,10 min),分装上清液于冰箱中保存备用。分别采用化学比色法测定脑组织MDA 含量和GSH-Px、SOD 活性,采用ELISA 测定TNF-α、IL-1β 和IL-10 含量,具体操作按试剂盒说明书进行。
1.6 统计学分析 采用SPSS 19.0 统计软件对实验数据进行分析处理,所得结果以()表示,与模型组比较,P <0.05或P <0.01认为具有显著性差异。
2 结果
2.1 三七多糖对大鼠脑组织含水量及脑梗死面积比的影响 如表1 所示,假手术组大鼠脑组织含水量显著低于模型组(P <0.01),而尼莫地平和三七多糖高、低剂量组均可以明显降低大鼠脑缺血再灌注后脑组织含水量(P <0.05 or P <0.01);同时,大鼠脑缺血再灌注后有明显的脑梗死发生,而尼莫地平及三七多糖高、低剂量组均可以显著降低脑组织梗死面积比(P <0.05)。
表1 三七多糖对大鼠脑组织含水量及脑梗死面积比的影响(,n=10)

表1 三七多糖对大鼠脑组织含水量及脑梗死面积比的影响(,n=10)
与模型组比较,* P <0.05,**P <0.01
2.2 三七多糖对大鼠脑组织MDA 含量和GSH-Px、SOD 活性的影响 如表2 所示,与模型组比较,假手术组大鼠脑组织MDA 含量低于脑缺血再灌注模型组,而GSH-Px 和SOD 活性高于模型组(P <0.01)。与模型组比较,尼莫地平组及高、低剂量三七多糖组均能使缺血再灌注损伤大鼠脑组织MDA 含量降低,GSH-Px、SOD 活性升高(P <0.01),且存在一定的剂量关系。
表2 三七多糖对大鼠脑组织MDA 含量和GSH-Px、SOD 活性的影响(,n=10)

表2 三七多糖对大鼠脑组织MDA 含量和GSH-Px、SOD 活性的影响(,n=10)
与模型组比较,* P <0.05,**P <0.01
2.3 三七多糖对大鼠脑组织TNF-α、IL-1β 和IL-10 含量的影响 如图1 所示,与模型组比较,假手术组大鼠脑组织TNF-α 和IL-1β 含量明显降低,而IL-10 含量明显升高(P <0.01)。与模型组比较,尼莫地平组及高、低剂量三七多糖组均能使缺血再灌注损伤大鼠脑组织TNF-α 和IL-1β 含量降低,升高IL-10 含量(P <0.01),且存在一定的剂量关系。
3 讨论
脑血管疾病是危害人类健康最重要的疾病之一,而缺血性脑血管疾病占全部脑血管疾病的60%~80%,具有发病率高、复发率高和致残率高的特点。治疗脑缺血性损伤应尽早恢复血液再灌注,而研究发现,缺血后的血流恢复在特定情况下可导致组织损伤和功能障碍,即缺血再灌注损伤[6]。因此,预防和治疗脑缺血再灌注损伤已成为防治缺血性脑血管疾病的重要环节。本研究发现,三七多糖预处理可以显著减少脑缺血再灌注大鼠模型脑组织含水量及脑梗死面积(P <0.05 or P <0.01),表明三七多糖对大鼠脑缺血再灌注损伤具有一定的保护作用。
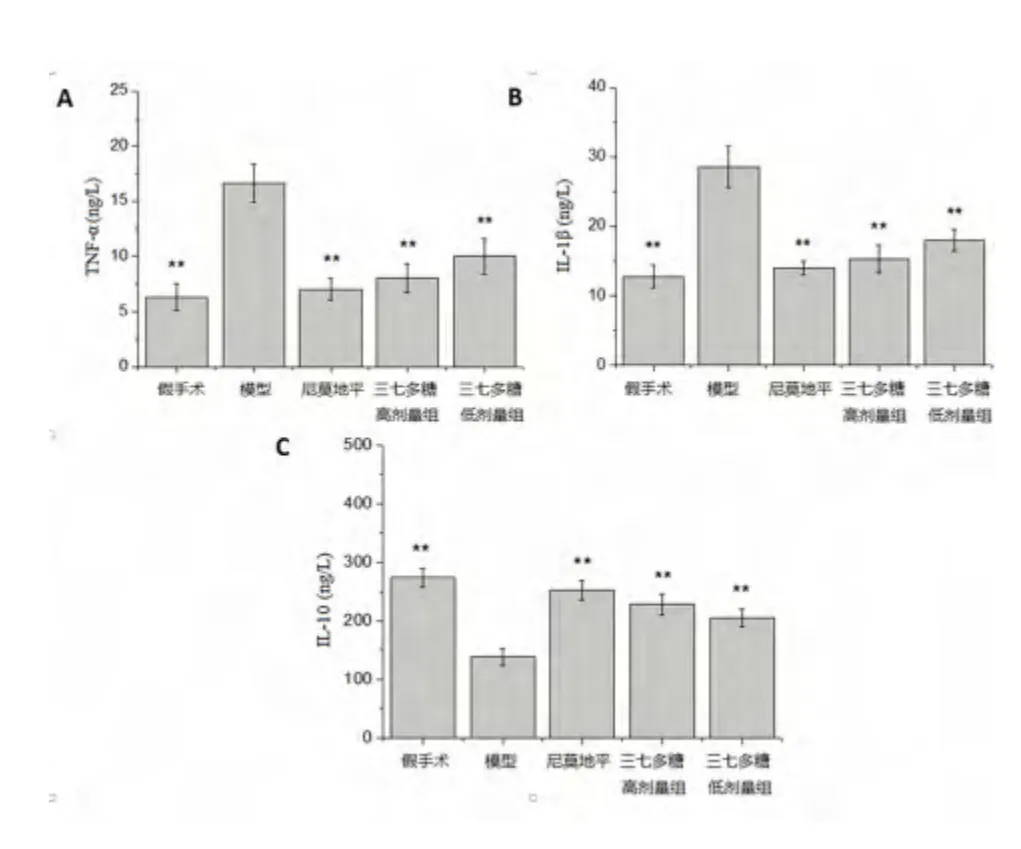
图1 三七多糖对大鼠脑组织TNF-α(A)和IL-1β(B)、IL-10(C)含量的影响(,n=10)
氧化应激是导致脑缺血再灌注后组织损伤的重要因素之一,特别是氧自由基理论在其中占有重要地位,MDA、GSH-Px 和SOD 与氧自由基密切相关[7]。MDA 为脂质过氧化产物,可以反应机体受氧化应激损害的程度[8];GSH-Px 能够催化过氧化氢使其分解成氧化型GSH 和水,从而减少体内过氧化氢的含量,起到保护机体免受氧化损伤的作用[9];而SOD 是机体内清除氧自由基最重要的酶,广泛存在于各种生物体内,能清除氧自由基保护机体免受氧化损伤[10]。本研究发现,高、低剂量的三七多糖均能使缺血再灌注损伤大鼠脑组织的MDA 含量降低,SOD 活性和GSH-Px 含量升高(P <0.01)。此结果表明,三七多糖具有一定的抗氧化作用,可以改善缺血再灌注大鼠脑组织氧化应激水平,三七多糖对大鼠脑缺血再灌注损伤发挥保护作用的机制可能与其提高脑组织抗氧化能力有关。
氧化应激可以导致促炎症反应细胞因子增加,从而使炎性细胞因子产生,这是脑缺血再灌注损伤炎症机制的核心调控因素之一[11]。在脑缺血再灌注损伤中,与炎症反应相关的因子主要有TNF-α 和IL 等。其中TNF-α 在脑缺血后诱发的组织损伤和白细胞浸润中起重要作用,可使多核白细胞聚集并释放炎症介质,阻断TNF-α 的表达是减少缺血性神经元损伤的有效措施[12];IL-1β 能够协同其他细胞因子促进B、T 细胞活化,并且能够诱导包括TNF-α在内的炎性因子的产生[13];IL-10 是一种细胞免疫反应抑制剂,可以抑制IL-1 和TNF-α 等细胞因子生成,从而具有保护神经细胞的作用[14]。本研究结果发现,高、低剂量的三七多糖均能够降低缺血再灌注损伤大鼠脑组织IL-1β 和TNF-α 含量,提高IL-10 含量(P <0.01)。此结果表明,三七多糖对大鼠脑缺血再灌注损伤的保护作用与抑制炎症因子的产生有关。总之,通过以上研究结果表明,三七多糖对大鼠脑缺血再灌注损伤具有一定的保护作用,该保护作用与其提高脑组织抗氧化能力、抑制炎症因子的过度产生有关。
[1]杨志刚,陈阿琴,俞颂东.三七药理研究新进展[J].上海中医药杂志,2005,39(4):59-62.
[2]鲍建才,刘 刚,丛登立,等.三七的化学成分研究进展[J].中成药,2006,28(2):246-253.
[3]陈新霞,顾呈华,杨明晶,等.三七多糖对小鼠免疫功能调节的研究[J].江苏预防医学,2007,18(3):10-11.
[4]姜曼花,胡剑卓,邱文高,等.白背三七多糖和黄酮降血糖及耐缺氧作用[J].中国医院药学杂志,2009,29(13):1074-1076.
[5]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Jian LK,Rosenberg GA.Matrix metalloproteinases and free radicals in cerebral ischemia[J].Free Radic Biol Med,2005,39:71-80.
[7]Wang TF,Lei Z,Li YX,et al.Oxysophoridine protects against focal cerebral ischemic injury by inhibiting oxidative stress and apoptosis in mice[J].Neurochem Res,2013,38(11):2408-2417.
[8]Pirinccioglu AG,Gökalp D,Pirinccioglu M,et al.Malondialdehyde(MDA)and protein carbonyl(PCO)levels as biomarkers of oxidative stress in subjects with familial hypercholesterolemia[J].Clin Biochem,2010,43(15):1220-1224.
[9]Djordjevic A,Spasic S,Jovanovic-Galovic A,et al.Oxidative stress in diabetic pregnancy:SOD,CAT and GSH-Px activity and lipid peroxidation products[J].J Matern Fetal Neonatal Med,2004,16(6):367-372.
[10]Reddi AR,Jensen LT,Naranuntarat A,et al.The overlapping roles of manganese and Cu/Zn SOD in oxidative stress protection[J].Free Radic Biol Med,2009,46(2):154-162.
[11]Hou SZ,Li Y,Zhu XL,et al.Ameliorative effects of diammonium glycyrrhizinate on inflammation in focal cerebral ischemic-reperfusion injury[J].Brain Res,2012,1447:20-27.
[12]Benveniste EN.Inflammatory cytokines within the central nervous system:sources,function,and mechanism of action[J].Am J Physiol,1992,263:1-16.
[13]Castellanos M,Castillo J,Garcia MM,et al.Inflammation-mediated damage in progressing lacunar infarctions:a potential therapeutic target[J].Stroke,2002,33:982-987.
[14]Cyktor JC,Turner J.Interleukin-10 and immunity against prokaryotic and eukaryotic intracellular pathogens[J].Infect Immun,2011,79:2964-2973.

