神经生长因子和脑源性神经营养因子对神经干细胞迁移的影响①
魏春杰,江清林,朱晓峰
(佳木斯大学附属第一医院神经三科,黑龙江 佳木斯 154003)
神经生长因子和脑源性神经营养因子对神经干细胞迁移的影响①
魏春杰,江清林,朱晓峰
(佳木斯大学附属第一医院神经三科,黑龙江 佳木斯 154003)
目的:探讨神经生长因子(nervegrowthfactor,NGF)与脑源性神经营养因子(brain-derivedneurotrophicfactor,BDNF)体外实验对神经干细胞迁移的影响。方法:体外应用半固体培养法连续14天观察不同浓度的NGF、BDNF及NGF+BDNF组合诱导神经干细胞迁移的情况。结果:体外条件下不同浓度的神经营养因子的组间和组内比较显示,100μg/LBDNF诱导神经干细胞迁移作用最明显。BDNF+NGF联合组在诱导神经干细胞迁移方面未见协同效应。结论:NGF、BDNF二者皆有诱导神经干细胞迁移的作用,100μg/LBDNF组诱导迁移作用最明显。
神经生长因子;脑源性神经营养因子;神经干细胞;迁移
神经干细胞是神经科学领域研究的热点问题,它的发现为神经系统疾病治疗开拓了新的前景[1,2]。其增殖、定向诱导分化研究方面都取得了一定的成绩,但针对神经干细胞迁移方面的研究较少。本实验在体外条件下探讨不同浓度的NGF、BDNF及其组合诱导NSCs迁移中的作用,并对两种因子及组合进行择优,选出最佳浓度的因子,为下一步体内实验奠定基础。
1 材料和方法
1.1 材料
Wistar新生鼠,由本校动物实验中心提供。 主要试剂:DMEM/F12、B27、荧光FITC标记试剂,DAB显色试剂,BrdU、NSE、nestin、GFAP一抗,SABC-FITC、SABC-CY3,EGF、bFGF、BDNF因子,羊抗小鼠Cy3,低熔点琼脂糖。
1.2 方法
神经干细胞的分离及培养:选用Wistar新生鼠,取海马组织,经D-Hanks,液漂洗后将脑组织置入小瓶中剪碎,加入无血清培养基吹打成单细胞悬液,台盼兰染色计数,于每个培养瓶中加入密度约为5×105/mL细胞悬液4mL左右。置于37℃、5%CO2饱和湿度孵育箱内培养。待原代克隆形成后再次分离制作单细胞悬液,此后每隔3d半量换液,5~7d分离神经球进行传代[3]。
半固体培养:①取盖玻片置于3.5cm培养皿底部,基本培养液为含0.3%低熔点琼脂和2%B27的DMEM/F12(撤走bFGF)。在盖玻片上用5%的琼脂和神经营养因子(neurotrophicfactor,NTF)制成NTF扩散源,将传代三代后得神经干细胞分散放置于NTF扩散源周围的盖玻片上,培养于基本培养液中,观察不同因子不同浓度制成的扩散源诱导NSCs迁移情况,并跟踪观察各组实验细胞迁移行为及形态学变化[4]。
②分组:BDNF:浓度1μg/L、10μg/L、100μg/L,共3组。NGF: 浓度1μg/L、10μg/L、100μg/L,共3组。BDNF+NGF:从上述六组中筛选出两种因子的最佳浓度组成1组。空白对照组:不加任何NTF。
免疫细胞组织化学及荧光实验:nestin标记:将传代三次后的细胞团贴壁培养48h后进行nestin免疫细胞化学鉴定。数码照相机拍照,各组均设阴性对照,阴性对照切片以PBS替代一抗,其余步骤相同。
1.3 统计学方法

2 结果
连续14d观察接种在培养皿上的神经干细胞,见细胞生长状态良好,倒置显微镜下细胞折光性强 (见图2) 。神经干细胞球贴壁培养后24h,作Nestin免疫荧光鉴定绝大部分细胞显示nestin阳性细胞团呈绿色,迁出分化的NSCs呈阴性(见图1)。BrdU标记移植前之神经干细胞,免疫组化见大量神经细胞呈胞核被染色而胞浆未被染色Brdu标记阳性细胞,少部分未被标记。(见图3)。镜下见BDNF各组神经元样细胞多,胞体面积大,突起长,14d时胞体多呈现三角行或多边形,分支丰富。NGF各组细胞呈现类圆形或类星形,胞体较大,细胞伸出较多突起并逐渐延长,突起末端分支可见膨大的生长锥。镜下观察见BDNF组及NGF组细胞迁出均有方向性趋势,但不同浓度的因子诱导NSCs迁移现象是有差别的。高浓度组中细胞团细胞向培养皿中心即因子扩散源方向迁出趋势明显,向这一个方向伸出的突触也较长较粗。这种效果距离因子越近就越明显,部分干细胞球团伸出类柱状的突起,迁向因子方向。各浓度组细胞突起均随时间推移逐渐增长,100?g/LBDNF组诱导迁移距离最长可达1200μm以上(见图4)。而对照组干细胞团的细胞是向四周均匀分散迁出的,与实验组相比较迁移距离较近(见图5)。
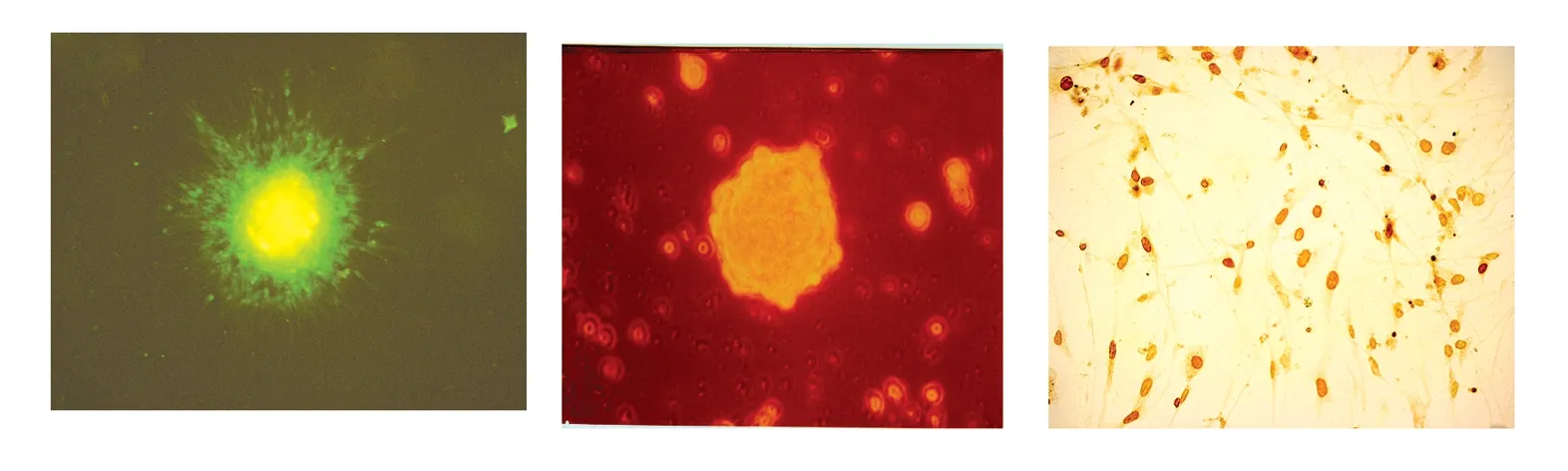
图1 图2 图3
图1 神经干细胞球团的nestin免疫荧光染色,迁出分化的NSCs呈阴性。(×100)
图2 原代培养3d时悬浮生长的神经干细胞渐聚集成不规则的球形细胞团,细胞结合疏松(×200)
图3 神经干细胞的BrdU免疫组化染色,胞核着色,DAB显色。(×100)

图4 图5
图4 镜下观察见100μg/LBDNF组神经干细胞具有向BDNF因子中心方向迁移的趋向性(×200)
图5 对照组中半固体培养24h,基础培养液的中神经干细胞有向四周分散迁出趋势,无明显方向性。 (×200)
每组取距离因子扩散源1.5mm内的10个干细胞球团迁移距离的平均值:(×100)
表1 14d时不同组别迁移距离平均值
*:与对照组比较,P<0.05。
组内比较:①1μg/LNGF与10μg/LNGF两浓度组诱导迁移作用比较,差异无显著性(P>0.05),但二者与100μg/LNGF诱导迁移作用比较(P<0.01)。②BDNF各浓度组差异皆有显著性(P<0.01),提示BDNF对神经干细胞的诱导迁移作用具有浓度依赖性。 组间比较:除1μg/LBDNF外,其余所有实验组与对照组比较(P<0.05),说明神经生长因子与脑源性神经营养因子具有诱导神经干细胞迁移的作用。100μg/LBDNF与(100μg/LNGF+100μg/LBDNF)两组作用皆优于100μg/LNGF(P<0.05),而100μg/LBDNF组与(100μg/LNGF+100μg/LBDNF)组合之间比较(P<0.05)差异无显著性。本实验未观察到两种因子在诱导神经干细胞迁移方面有协同效应。
3 讨论
神经干细胞的迁移机制非常复杂,目前主要有放射状迁移和正切迁移两种模式[5]。NGF通过物理和化学两个方面对神经前体细胞迁移起诱导作用。①物理因素方面:即神经前体细胞沿着放射状胶质细胞的长突起方向迁移。NGF仅出现在迁移期的神经前体细胞中,其受体erb表达于迁移期的放射状胶质细胞,阻断受体erb后,神经前体细胞迁移受到抑制。外源性的NGF还可稳定原来的突触接触和防止突触可塑性变化[6]。②在化学因素方面:即神经前体经细胞沿着化学趋化物的方向发生迁移。神经生长因子的弥散浓度梯度为神前体细胞的迁移提供了化学信号,研究表明,表达高亲和力受体TrkA的鼠脊索成神经元细胞, 在低浓度的NGF诱导下即能沿着化学梯度直接发生迁移[7]。 有研究表明,BDNF能触发干细胞的趋化和运动[8]。BDNF的主要作用位点是在中枢神经系统的突触上,其不仅能促进突起的再生,而且能提高神经元表面BDNF受体TrkB的表达水平,其对突触的延伸作用强于NGF[9]。这正与本实验体外条件下100μg/LBDNF诱导神经干细胞迁移作用优于100μg/LNGF的结论相符。BDNF在神经系统可塑性及祖细胞迁移中起至关重要的作用。在神经元迁移时期,脑皮质内存在BDNF高亲和力受体TrkB及BDNFmRNA,研究表明,TrkB高亲和力受体主要存在于有迁移细胞的区域,许多TrkB阳性细胞均表现出典型迁移神经元的特性[10]。我们认为,BDNF的浓度与其受体TrkB的表达有直接的关系,是BDNF在诱导神经干细胞迁移方面存在浓度依赖性的原因。
本实验表明神经营养因子BDNF对体外培养的神经干细胞迁移诱导作用优于NGF,且神经干细胞迁移对其存在浓度依赖性。结论提示BDNF可在NSCs准确到达病灶部位,修复损伤组织方面起到积极的作用,为如何应用NSCs治疗神经系统疾病提供新的思路。
[1]BacigaluppiM,PluchinoS,MartinoG,etal.Neuralstem/precursorcellsforthetreatmentofischemicstroke[J].JNeurolSci,2008,265(1-2):73-77
[2]TakagiN.Pathologyandstrategiesforthetreatmentofischemicbraininjury[J].YakugakuZasshi,2009,129(10):1215-1219
[3]徐忠烨,朱晓峰.新生大鼠海马神经干细胞的分离培养及鉴定[J].黑龙江医药科学,2002,25(5):2-4
[4]张晓梅,金玉玲,朱晓峰. 体外培养海马神经干细胞分化前后离子通道检测[J].黑龙江医药科学,2005,28(1):4-5
[5]胡旭慧,黄昕艳,朱晓峰.AB25-35寡聚体对原代培养海马神经元突触的损伤作用[J].黑龙江医药科学,2010,33(3):113
[6]张素,陈崇宏,郑至.神经生长因子的研究[J].海峡药业,2003,15(2):8-10
[7]陆艳红.神经生长因子及其受体的神经发育调节[J].中国儿童保健杂志,2003,11(6):397-398
[8]ChiaramelloS,DalmassoG,BezinL,etal.BDNF∕TrkBinteractionregulatesmigrationofSVZprecursorcellsviaPI3-KandMAPKsignalingpathways[J].EurJNeurosci,2007,26:1780-1790
[9]苗增利,蔺玉昌,缪亦锋,等.神经营养因子NGF、BDNF对AD模型鼠海马[J].齐齐哈尔医学院学报,2003,24(12):1323-1325
[10]武衡,黎杏群.脑源性神经营养因子与神经干细胞[J]. 国外医学脑血管疾病分册,2003,11(2):128-131
黑龙江省教育厅资助项目,编号:12521543。
魏春杰(1980~)女,黑龙江佳木斯人,硕士,主治医师。
朱晓峰(1963~)男,山东蓬莱人,博士,教授,博士研究生导师。E-mail:sjkx2727@163.com。
R329.2+
A
1008-0104(2015)03-0026-02
2015-02-18)

