基于生物分子网络的人参皂苷Rg1的生物效应①
那丽莎,刘夕琳,李 想,孙长海
(佳木斯大学药学院,黑龙江 佳木斯 154007)
基于生物分子网络的人参皂苷Rg1的生物效应①
那丽莎,刘夕琳,李 想,孙长海
(佳木斯大学药学院,黑龙江 佳木斯 154007)
目的:运用代谢组学及生物效应网络方法研究人参皂苷Rg1的生物效应的机制。方法:采用高效液相色谱-质谱(HPLC-MS)联用技术结合偏最小二乘判别分析方法,考察空白组与人参皂苷Rg1给药组的内源性物质差异,并确定生物标志物。结果:筛选出对分组贡献较大的25种潜在生物标记物,通过数据库确定了6个目标物的结构、代谢途径,相关酶和作用靶点,分别为吡哆醛与醛氧化酶、氨基葡萄糖和己糖激酶、甲基尿酸及黄嘌呤脱氢酶、多巴醌转化酪氨酸酶、氟尿苷与胸苷磷酸化酶、卵磷脂和卵磷脂胆固醇酰基转移酶。通过网络药理学及文献解释了人参皂苷Rg1在嘧啶代谢通路中为胸苷磷酸化酶的抑制剂;还可促进卵磷脂通过血浆卵磷脂胆固醇酰基转移酶催化成血浆胆固醇酯。结论:代谢组学及生物效应网络方法能用于人参皂苷Rg1生物效应机制的研究,为进一步揭示人参皂苷Rg1药理作用机制提供了新方法。
人参皂苷Rg1;代谢组学 ;生物效应网络
三七为五加科植物[Panaxnotoginseng(Burk)F.H.Chen],是我国传统的名贵药材。人参皂苷Rg1(ginsenosideRg1)是三七的主要单体成分,也是临床应用的药理活性成分。人参皂苷Rg1具有具有活跃的生物活性,抗肿瘤、抗疲劳、抗衰老、心脑血管系统、神经系统保护作用[1]。研究表明,人参皂苷Rg1可抑制肿瘤细胞蛋白质合成、促进BGC-823细胞凋亡[2];其影响Caspase-3、Bcl-2的表达,可对脑缺血再关注损伤有明显保护作用[3];可明显抑制TF-1细胞的增值并促进其凋亡,对人白血病TF-1细胞EPOR信号通路具有影响[4]。但是,如何应用生物分子网络同时探索药物多种生物效应机制的方法尚未见报道。因此,本研究以代谢组学分析方法研究空白组与人参皂苷Rg1给药组代谢差异,根据差异性代谢物结合网络药理学解释其相关酶、靶点及代谢途径,为阐明人参皂苷Rg1引起的多种生物效应机制提供了新方法[5]。
1 材料与方法
1.1 材料
①实验动物:选择清洁级Wistar雄性大鼠12只,体重(200±20)g,购自长春亿斯实验动物技术公司,许可证号:SCXK-(吉)2011-0004; ②仪器与试药Agilent1200/6300型高效液相色谱-质谱联用仪;KQ-250DE台式数控超声波清洗器(昆山市超声仪器有限公司);人参皂苷Rg1标准品(大连美仑生物技术有限公司,CAS:22427-39-0);乙腈(色谱纯,天津市科密欧化学试剂有限公司);甲酸(分析纯,天津市科密欧化学试剂有限公司);实验室用水为自制三蒸水;
1.2 实验方法
①实验分组:将大鼠随机分为空白组与人参皂苷Rg1给药组。人参皂苷Rg1组以100mg·kg-1剂量隔日灌胃给药一次,连续7d。空白组给予等量的生理盐水。实验前,每只大鼠眼眶取0.5mL空白血,实验时,每只大鼠于1d,3d,5d,7d灌胃给药1h后取血:取血0.5mL,静置半小时,于3500r·min-1离心10min,分离血清,-80℃下保存。 ②血清的前处理:取100μL血清样品,加入200μL甲醇,涡旋30s,于10000r·min-1离心10min,移取上清液,40℃N2流下吹干,残渣用100μL甲醇复溶,涡旋30s后离心5min,取10μL上清液进样。 ③实验条件:色谱条件AgilentBC-C18柱(4.6mm×100mm,2.7μm);C18保护柱(5mm×2.1mm,1.7μm);流动相:(A)0.1%甲酸+5%水+甲醇(B)0.1%甲酸+5%甲醇+水,梯度洗脱(初始0%A,100%B;20min,100%A,0%B;25min,100%A,0%B;30min,0%A,100%B) ;流速:0.6mL·min-1;柱温:25℃;进样量为10μL。质谱条件 离子肼ESI源;正离子模式自动二级在m/z50~1000内进行全扫描;毛细管电压为13V,温度为350℃;鞘气(N2)流量为10mL·min-1;辅助气(N2)流量为0.15mL·min-1;碰撞气为He。
2 结果
2.1 给药后大鼠血清总离子流图
全扫描监测的血清的总离子流图(图1)。图1A为空白组,图1B为给药组,由图可知,给予人参皂苷Rg1后引起大鼠血清明显代谢差异。

图1A 空白组
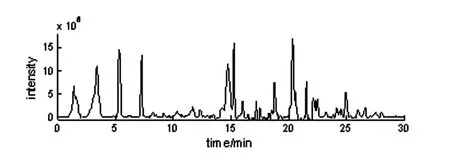
图1B 人参皂苷Rg1给药组
2.2 模式识别
利用MATLAB程序对色谱峰平滑、对齐、匹配处理,提取碎片的质荷比(50-1000)、保留时间、和相应的峰强度(>10000)。将输出的三维数据导入SIMCA-P12.0软件进行中心化和Pareto均一化处理,然后以非监督的主成分分析(PCA),对大鼠血清进行模式识别分析[6]。血清样本PCA得分图2所示,1~6号为空白组,7~12号为人参皂苷Rg1给药组,两组区分明显,说明人参皂苷Rg1影响大鼠体内的代谢发生了明显变化。
采用偏最小二乘判别分析方法(PLS-DA),得出载荷图3来筛选潜在生物标记物。通过选取VIP(Variableimportancefortheprojection)值并结合载荷矩阵图来研究每一个变量的偏离程度,从而筛选目标物[7,8]。在载荷图中,共有280个变量,偏离程度越大并且VIP值>1.5的点为对分组有显著性贡献的变量。如图3,红色的框标记出对分组有显著性贡献的变量,因此,选择这些25个变量为生物标记物。

图2 空白组与给药组的PLS-DA得分图

图3 空白组与给药组的PLS-DA载荷图
2.3 生物标记物鉴定及生物效应分析
根据提取生物标记物的分子离子峰,得到精确的质荷比(m/z),代入到ChEBI与HMDB数据库中搜索可能的化合物,然后结合二级质谱碎片裂解规律及参考文献中的MS/MS标准谱图进行比对,最后鉴定出6种目标物结构,分别为吡哆醛m/z167.1、氨基葡萄糖m/a179.0、甲基尿酸m/z182.0、多巴醌m/z195.1,氟尿苷m/z246.2,卵磷脂m/z494.3。
采用KEGG网站及相关文献分析目标物的相关酶,代谢途径及相关疾病的生物效应,见表1。

表1 生物标志物及其代谢通路
3 讨论
人参皂苷Rg1是从三七中分离出的单体成分,具有活跃的生物活性,其对心血管系统[9]、免疫系统[10]、神经系统[11]的保护以及明显的抗肿瘤[12]、抗肝炎[13]作用已受到广泛关注。迄今为止,同时揭示人参皂苷Rg1的多种作用机制未见报道。本研究采用液质联用技术结合模式识别PLS-DA,对人参皂苷Rg1给药组和空白组大鼠的血清进行分析,研究两组大鼠的体内代谢差异。PLS-DA属于有监督模式的识别方法,并且具有较强的分类能力。结果显示,PLS-DA法能有效的将人参皂苷Rg1给药组和空白组区分开,根据VIP>1.5的为生物目标物,并通过生物分子网络鉴定了吡哆醛、甲基尿酸、多巴醌、氟尿苷、氨基葡萄糖、卵磷脂6个差异代谢物。KEGG数据库为代谢物从代谢途径的水平理解细胞或组织的生物学意义提供了生物信息资源。但由于数据库的信息还不是很完整,结合相关文献只阐述了2条代谢通路及作用机制,但其他内源性代谢物的变化也为后续的研究提供了依据。
分析嘧啶代谢通路可知,胸苷磷酸化酶(TP)在氟尿苷的参与下转化为胸苷激酶。TP是嘧啶代谢及DNA合成的关键酶 ,通过参与细胞信号传导来促进癌细胞生长同时抑制正常细胞凋亡[14]。研究表明,在肿瘤组织中,TP的表达明显高于正常组织,尤其在血浆中,高出20倍[15]。在此通路中,TP的异常表达引起直肠癌。根据其代谢过程可知,目标代谢物氟尿苷下调,而其上游物只为TP,说明给予人参皂苷Rg1后TP处于抑制状态,使其在血清中转化为氟尿苷的水平下调,而发挥选择性细胞抑制作用,TP含量降低可抑制肿瘤和细胞凋亡,以上结论反映出人参皂苷Rg1可作为TP的抑制剂,明确了人参皂苷Rg1预防和治疗肿瘤的作用机制。
在卵磷脂胆固醇酰基转移酶缺乏疾病通路中,卵磷脂通过血浆卵磷脂胆固醇酰基转移酶(LCAT)催化形成血浆胆固醇酯。LCAT由肝脏合成后释放入血,在血浆中由高密度脂蛋白中载脂蛋白A激活。在此酶催化下,血浆游离胆固醇转化为胆固醇酯和溶血卵磷脂。研究表明,肝脏疾病时由于肝细胞损伤使LCAT合成减少,导致血浆游离胆固醇转变为胆固醇减少。血浆LCAT活力高低在肝脏病变中具有重要临床意义[16]。在此通路中,LCAT与胆固醇酯缺乏症有关,进一步分析通路可知,卵磷脂下调直接导致LCAT的缺乏,由于药物对大鼠体内代谢有干预作用,使代谢物卵磷脂上调,可说明该药物是LCAT的激动剂,LCAT激活可使血浆胆固醇酯增高,从而抑制肝脏疾病。本研究工作证明,人参皂苷Rg1灌胃对正常大鼠机体代谢产生影响,更在生物分子网络调控的层面阐释了人参皂苷Rg1的作用机制,对于同时探讨药物的多种生物效应机制提供了新方法。
[1]黄海英. 人参皂苷Rg1药理作用研究进展[J]. 实用中医药杂志, 2012, 28(7): 608-609
[2]赵保胜, 刘洋. 人参皂苷Rg1对人胃癌BGC-823的抑制作用研究[J]. 中国临床药理学与治疗学, 2011, 16(4): 361-365
[3]胡霞敏, 严常开. 人参皂苷Rg1对大鼠脑缺血再灌注损伤细胞凋亡的影响[J]. 中国临床药理学与治疗学, 2006,11(2): 192-196
[4]夏菁,李静. 人参皂苷Rg1对人白血病TF-1细胞EPOR信号通路的影响[J]. 肿瘤, 2014, 34(2):113-120
[5]方舟,方芳,孙长海. 代谢组学技术在药物安全性研究中的应用[J]. 黑龙江医药科学, 2011, 34(3):78-79
[6]孙长海,陈百慧,王蒙. 酒精性肝病患者尿液代谢组学研究[J]. 黑龙江医药科学, 2013, 36(5):44-45
[7]阿基业. 代谢组学数据处理方法-主成分分析[J]. 中国临床药理学与治疗学, 2010, 15(5): 481-489
[8]李晶,吴晓健,刘昌孝, 元英进. 代谢组学研究中数据处理新方法的应用[J]. 药学学报, 2006, 41(1): 47-53
[9]杨敏,陈广玲,陈畅.人参皂苷Rg1对心肌梗死大鼠新址的促血管生成作用[J]. 中国中医急症,2009, 18(3):403-405
[10]王红宁,左国伟,李春莉. 人参皂苷单体Rb1及Rg1对白血病细胞K562增殖的影响[J]. 中国组织工程研究与临床康复, 2009, 13(40): 7829-7832
[11]邬伟, 杨景全, 刘宝华.人参皂苷Rg1对痴呆大鼠脑匀浆中BMSCs的神经性分化作用[J]. 中风与神经疾病杂志, 2011, 28(3): 204-207
[12]陈声武,王岩.人参皂苷Rg1和Rh1抗肿瘤作用的研究[J]. 吉林大学学报, 2003, 19(1): 25-28
[13]高明菊, 王强. 七丹胶囊对CCl4致小鼠急性肝损伤的保护作用[J]. 华西药学杂志,2010, 25(6): 668-690
[14]YaoL,ItohS.Thymidinephosphorylaseexpressioninoralsquamouscellcarcinoma[J].OralOncol, 2002, 38: 584-590
[15]YanoT,TakeoS.Thymidinephosphoryactivityinnon-smallcelllingcarcinomatissues[J].Cancer, 2001, 92: 2658-2661
[16]范东东, 孙铭娟. 酰基转移酶研究[J]. 生命的化学, 2008, 28(6): 701-703
佳木斯大学研究生创新项目,编号:XSYD2014-021。
那丽莎(1988~)女,黑龙江牡丹江人,在读硕士研究生。
孙长海(1974~)男,黑龙江佳木斯人,博士,副教授,硕士研究生导师。E-mail:schai1974@sohu.com。
R
A
1008-0104(2015)03-0030-03
2015-01-14)

