光动力疗法对子宫内膜癌Ishikawa细胞系细胞周期和凋亡的影响
宗丽菊,王 颉,刘洪丽,冯进波,张友忠
(山东大学齐鲁医院妇产科,山东济南250012)
子宫内膜癌是女性生殖系统常见的3 大恶性肿瘤之一。目前,早期子宫内膜癌患者保留生育功能的治疗方法主要有孕激素和子宫内膜去除术[1]。光动力疗法(photodynamic therapy,PDT)利用光敏剂和激发光源靶向治疗肿瘤,成为继手术、放化疗之后的新的微创疗法[2]。PDT 已用于治疗皮肤癌、肺癌、宫颈癌、早期食管癌等[3]。本研究以子宫内膜高分化腺癌Ishikawa 细胞为研究对象,观察以水溶性阳离子卟啉化合物四甲基吡啶卟啉[5,10,15,20-Tetrakis(1-methylpyridinium-4-yl)porphyrin,TMPyP]为光敏剂的PDT 对其细胞周期和凋亡的影响,以及对Bcl-2 蛋白和核因子-κB P65(nuclear factor kappa B,NF-κB P65)的影响,为早期子宫内膜癌患者的保守治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1 细胞系Ishikawa 细胞(ATCC 细胞库)。
1.1.2 主要试剂:光敏剂TMPyP(Sigma-Aldrich 公司),胎牛血清及DMEM 培养液(Gibco 公司),细胞活力、细胞周期和凋亡检测试剂盒(上海贝博生物),NF-κB P65、磷酸化NF-κB P65(phospho-NF-κB P65,p-NF-κB P65)、Bcl-2 单克隆抗体(CST 公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体、辣根过氧化物酶标记二抗(Abcam 公司)。
1.2 方法
1.2.1 细胞培养:在37 ℃、湿度饱和、5% CO2孵箱中用含10%胎牛血清的DMEM 培养基培养Ishikawa细胞,2~3 d 传代1 次,实验用对数增殖期的细胞。
1.2.2 PDT 处理细胞:将TMPyP 配置成60 μmol/L的储存液,使用前用DMEM 培养液稀释成工作液。弃去细胞原培养基,加入目的浓度的TMPyP 工作液,避光孵育4~6 h 后进行激光照射。光照条件:波长(470 ±10)nm,根据目的激光能量密度调整功率0.2~0.8 W,光照60 s。光照后加入完全培养液。对照组不加光敏剂,不进行光照,其他条件同实验组。
1.2.3 细胞形态学观察:倒置相差显微镜下观察PDT 组(TMPyP 浓度0.6 μmol/L,能量密度4.8 J/cm2)1 和12 h 细胞形态并拍照采集图像。
1.2.4 光敏剂的荧光检测:将Ishikawa 细胞接种于铺有盖玻片的24 孔板,制备细胞爬片,设置对照组和PDT 组(TMPyP 浓度0.6 μmol/L,能量密度4.8 J/cm2),处理4 h 后,漂洗,固定,在荧光显微镜紫外UV 模式(激发波长330~380 nm,发射波长460~520 nm)下观察。
1.2.5 细胞存活率的检测:制备Ishikawa 单细胞悬液接种于96 孔板中,24 h 后PDT 处理细胞。PDT 分为两大组:一组激光能量密度为4.8 J/cm2,TMPyP 浓度分别为0、0.2、0.4、0.6、1.2 和1.8 μmol/L;另一组TMPyP 浓度为0.6 μmol/L,激光能量密度分别为0、2.4、3.6、4.8、6.0 和7.2 J/cm2。PDT 处理24 h后,按CCK-8 试剂盒说明书操作,测定吸光度A 值。每组设3 个副孔,重复3 次。细胞存活率(100%)=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。
1.2.6 细胞周期的检测:将Ishikawa 细胞接种于6孔板中,汇合度为50%~80%时进行实验,分为对照组和PDT 组(TMPyP 浓度0.6 μmol/L,能量密度4.8 J/cm2)。PDT 处理细胞12 和24 h 后,按周期检测试剂盒说明书操作。实验重复3 次,用ModFit 软件分析结果。
1.2.7 细胞凋亡率的检测:将Ishikawa 细胞接种于6 孔板,汇合度为80%左右时进行实验,分组同细胞周期检测。PDT 处理细胞12 和24 h 后,按凋亡检测试剂盒说明书操作。实验重复3 次,用FlowJo_V10 分析结果。
1.2.8 Western blot 检测目的蛋白:提取对照组、PDT组(TMPyP 浓度0.6 μmol/L,能量密度4.8 J/cm2)处理12 和24 h 的细胞总蛋白,测定蛋白浓度。取50 μg蛋白进行电泳,转膜,封闭,用NF-κB P65、p-NF-κB P65、Bcl-2 和GAPDH 一抗(1 ∶500~1∶2 000稀释)孵育;二抗(1 ∶5 000 稀释)孵育,洗膜,曝光显影。Image-J 分析信号灰度。
1.3 统计学分析
应用SPSS20.0 软件分析,实验结果以均值±标准差(±s)表示,组间比较用单因素方差分析,多个样本均数间的两两比较采用q 检验。
2 结果
2.1 PDT 改变Ishikawa 细胞的形态
对照组的细胞分布均匀,贴壁紧密,成梭形或多边形,胞质均匀,边界清楚(图1A)。PDT 处理细胞4 h 后,细胞变圆、皱缩,间隙增大,胞质出现小泡,呈早期凋亡样改变(图1B)。处理12 h后,与对照组相比,细胞失去原有形态,胞质不均匀,细胞核固缩、明显 (图1C)。TMPyP 在488 nm 波长的激发下可以发出红光,在荧光显微镜UV 激发下,可见细胞发出红色荧光,主要分布于细胞核(图1D)。
2.2 PDT 降低Ishikawa 细胞的活力
激光能量密度为4.8 J/cm2时,细胞存活率较对照组显著降低(P<0.05),与光敏剂TMPyP 的浓度有关(图2A)。TMPyP 浓度为0.6 μmol/L 时,细胞存活率与激光能量有关,与对照组相比,细胞存活率显著下降(P<0.05)(图2B)。
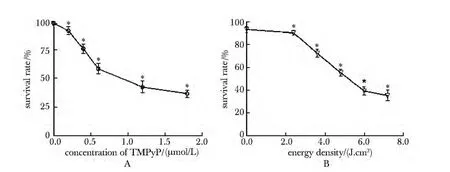
图2 不同TMPyP 浓度和激光能量下Ishikawa 细胞的存活率Fig 2 Survival rate of Ishikawa cell in different concentrations of TMPyP and energy(±s,n=3)
2.3 PDT 引起Ishikawa 细胞S 期阻滞
由于凋亡细胞产生DNA 片段,在G1峰前会出现亚G1峰(sub-G1),为凋亡峰(图3)。PDT 处理Ishikawa 细胞12 和24 h 后细胞周期分布发生改变,可以诱导细胞S 期比例增高,引起S 期阻滞,并出现凋亡峰。与对照组相比,PDT 组sub-G1和S 期比例升高(P<0.05)(表1)。
2.4 PDT 诱导Ishikawa 细胞凋亡
PDT 处理Ishikawa 细胞12 h 后主要引起细胞早期凋亡,24 h 后引起早期凋亡、晚期凋亡及坏死。PDT 后12 和24 h 的凋亡率分别为19.04% ±1.60%和39.09%±3.41%,显著高于对照组(P<0.05)(图4)。
2.5 PDT 降低Ishikawa 细胞p-NF-κB P65 和Bcl-2蛋白的表达
PDT 处理Ishikawa 细胞12 和24 h 后,p-NF-κB P65 蛋白的表达显著降低(P<0.05),Bcl-2 蛋白的表达在处理24 h 后显著降低(P<0.05)(图5,表2)。
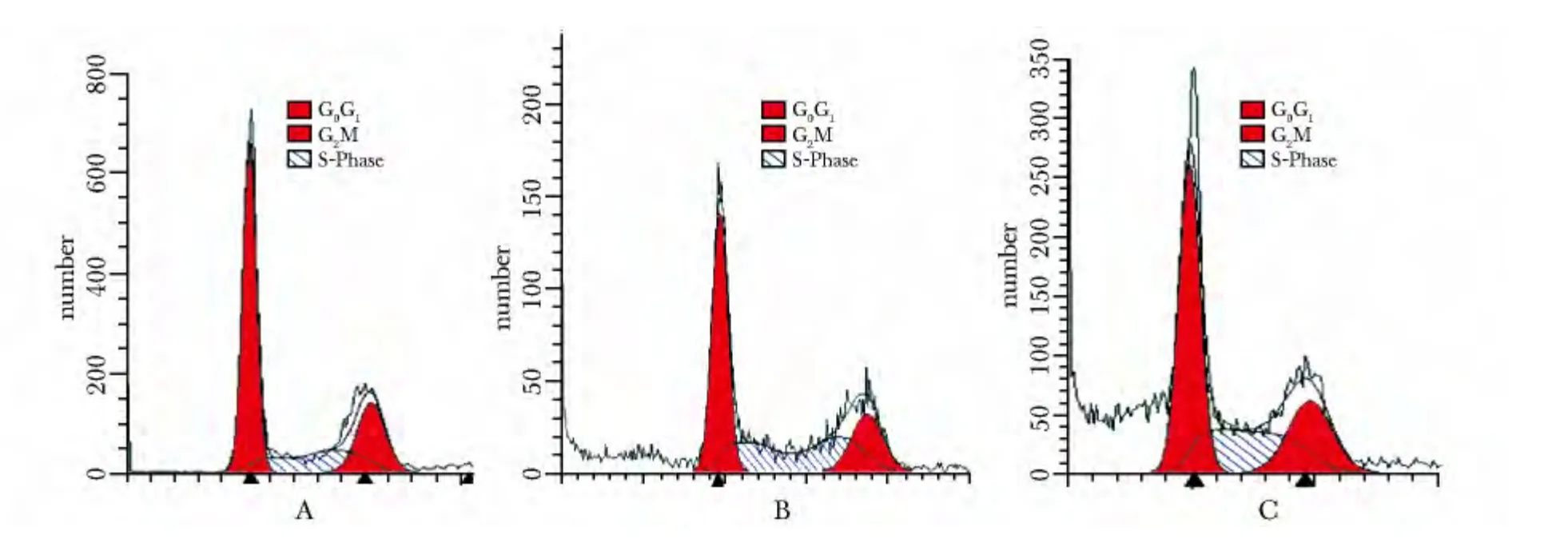
图3 PDT 处理Ishikawa 细胞后细胞周期分布直方图Fig 3 Histogram graphic of cell cycle analysis in Ishikawa cell treated by PDT
表1 PDT 处理Ishikawa 细胞12 和24 h 后细胞周期的分布比例Table 1 Cell cycle distribution of Ishikawa cell after treatment for 12 and 24 hours with PDT(±s,%,n=3)

表1 PDT 处理Ishikawa 细胞12 和24 h 后细胞周期的分布比例Table 1 Cell cycle distribution of Ishikawa cell after treatment for 12 and 24 hours with PDT(±s,%,n=3)
*P<0.05 compared with control group.
groupsub-G1G0/G1SG 2 control0.20 ±0.2356.70 ±0.9621.8 8 ±0.8021.42 ±1.77 PDT 12 hours24.08 ±2.37*49.41 ±0.71*27.38 ±0.92*23.21 ±0.74 PDT 24 hours45.32 ±8.43*43.04 ±1.59*36.00 ±1.28*20.96 ±1.72

图4 PDT 处理Ishikawa 细胞12 和24 h 后的凋亡分析Fig 4 Analysis of apoptosis in Ishikawa cells treaed by PDT after 12 and 24 hours
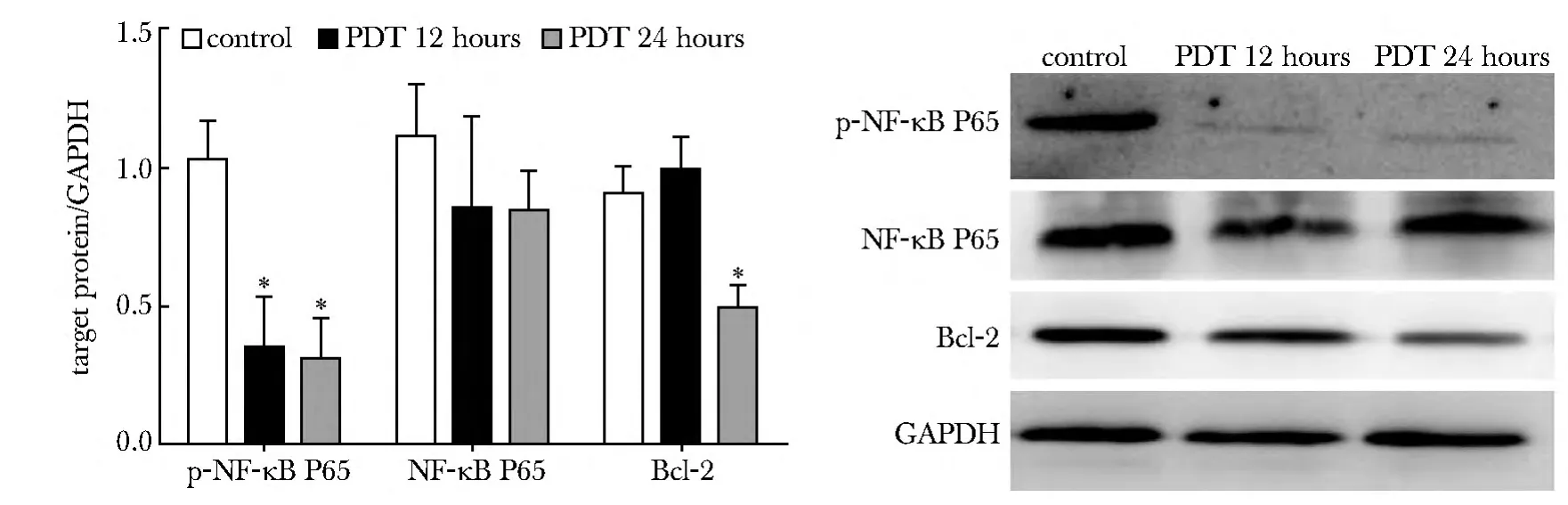
图5 PDT 处理Ishikawa 细胞12 和24 h 后NF-κB P65、p-NF-κB P65 及Bcl-2 蛋白的表达Fig 5 Expression of NF-κB P65,p-NF-κB P65 and Bcl-2 protein in Ishikawa cells treated by PDT after 12 and 24 hours
表2 PDT 处理Ishikawa 细胞12 和24 h 后NF-κB P65、p-NF-κB P65 及Bcl-2 蛋白的相对表达量Table 2 Relative expression of NF-κB P65,p-NF-κB P65 and Bcl-2 protein in Ishikawa cells treated by PDT after 12 and 24 hours(±s,%,n=3)

表2 PDT 处理Ishikawa 细胞12 和24 h 后NF-κB P65、p-NF-κB P65 及Bcl-2 蛋白的相对表达量Table 2 Relative expression of NF-κB P65,p-NF-κB P65 and Bcl-2 protein in Ishikawa cells treated by PDT after 12 and 24 hours(±s,%,n=3)
*P<0.05 compared with control group.
target protein target protein/GAPDH controlPDT 12 hoursPDT 24 hours NF-κ B P651.12 ±0.180.86 ±0.330.85 ±0.14 p-NF-κB P651.03 ±0.140.35 ±0.18*0.32 ±0.14*Bcl-20.91 ±0.090.99 ±0.120.50 ±0.08*
3 讨论
早期子宫内膜癌患者保留生育功能的治疗方法受到越来越多的关注。PDT 作为一种新的微创疗法,也逐渐成为人们关注的热点。本研究发现,水溶性阳离子卟啉TMPyP 为光敏剂的PDT 对子宫内膜癌Ishikawa 细胞有抗肿瘤的效应,可以抑制其增殖,诱导其凋亡并引起S 期阻滞。
NF-κB 是一种转录调控因子,调节细胞的周期、增殖与凋亡[4]。NF-κB P65 是NF-κB 最重要的功能性亚单位,其磷酸化水平决定着NF-κB 的活性[5]。通过NF-κB P65 亚单位磷酸化水平可判断NF-κB P65 的活性。而NF-κB 的活性在子宫内膜癌的发生过程中起中心作用[6]。本研究发现PDT 降低Ishikawa 细胞NF-κB P65 的磷酸化水平。Bcl-2是一种抗凋亡蛋白,可促进细胞存活、抑制死亡,抑制Bcl-2 可增强肿瘤对化疗药物的敏感性[7]。本研究发现PDT 处理Ishikawa 细胞24 h 后可以降低Bcl-2 的表达,促进细胞凋亡。而NF-κB 的活性在PDT 处理12 h 即可显著下降。在多种肿瘤细胞中NF-κB 与Bcl-2 相互调节[8],NF-κB 的失活可以下调Bcl-2[9]。在黑色素细胞瘤中PDT 可通过NF-κB信号通路发挥抗肿瘤效应[10]。PDT 可能通过降低Ishikawa 细胞NF-κB 的活性进而下调Bcl-2,影响细胞的周期和凋亡。临床上,PDT 治疗16 例有生育要求的年轻内膜癌患者,可达75%的有效率,57%的妊娠率[11]。1 例低度恶性子宫内膜间质肉瘤的患者经PDT 联合手术治疗成功受孕分娩[12]。
综上所述,PDT 可以通过降低NF-κB 和Bcl-2的活性诱导Ishikawa 细胞的S 期阻滞和凋亡,为子宫内膜癌患者保留生育功能的治疗提供了新思路。
[1]Kalogera E,Dowdy SC,Bakkum-Gamez JN.Preserving fertility in young patients with endometrial cancer:current perspectives[J].Int J Womens Health,2014,6:691-701.
[2]Agostinis P,Berg K,Cengel KA,et al.Photodynamic therapy of cancer:an update[J].CA Cancer J Clin,2011,61:250-281.
[3]杨欣艳,盛剑秋,王昕,等.早期和较早期食管癌的光动力治疗[J].基础医学与临床,2013,33:1176-1179.
[4]王丹阳,朱广瑾,徐成丽.NF-κB 在某些心血管疾病中的作用[J].基础医学与临床,2011,31:1070-1073.
[5]Perkins ND.The diverse and complex roles of NF-kappaB subunits in cancer[J].Nat Rev Cancer,2012,12:121-132.
[6]Mizumoto Y,Kyo S,Kiyono T,et al.Activation of NFkappaB is a novel target of KRAS-induced endometrial carcinogenesis[J].Clin Cancer Res,2011,17:1341-1350.
[7]Chen J,Jin S,Abraham V,et al.The Bcl-2/Bcl-X(L)/Bcl-w inhibitor,navitoclax,enhances the activity of chemotherapeutic agents in vitro and in vivo[J].Mol Cancer Ther,2011,10:2340-2349.
[8]Kim H,Chung H,Kim HJ,et al.Id-1 regulates Bcl-2 and Bax expression through p53 and NF-κB in MCF-7 breast cancer cells[J].Breast Cancer Res Treat,2008,112:287-296.
[9]Wei C,Li L,Gupta S.NF-κB-mediated miR-30b regulation in cardiomyocytes cell death by targeting Bcl-2[J].Mol Cell Biochem,2014,387:135-141.
[10]Rapozzi V,Zorzet S,Zacchigna M,et al.Anticancer activity of cationic porphyrins in melanoma tumour-bearing mice and mechanistic in vitro studies[J].Mol Cancer,2014,13:75.doi:10.1186/1476-4598-13-75.
[11]Choi MC,Jung SG,Park H,et al.Fertility preservation via photodynamic therapy in young patients with early-stage uterine endometrial cancer:a long-term follow-up study[J].Int J Gynecol Cancer,2013,23:698-704.
[12]Choi MC,Kim G,Hwang YY.Fertility-sparing management combined with photodynamic therapy for endometrial stromal sarcoma:A case report[J].Photodiagnosis Photodyn Ther,2014,11:533-536.

