卵巢移植对去势大鼠海马神经元和雌激素膜受体GPR30表达的影响
刘 芳,黑常春,孔 斌,常 青*,郑小敏,吴 凯,周文献,朱万平,赵承军,3*
(1.宁夏医科大学人体解剖与组织胚胎学系宁夏医科大学生育力保持教育部重点实验室宁夏生殖与遗传重点实验室,宁夏银川750004;2.陕西中医学院组织胚胎学教研室,陕西西安712046;3.宁夏医科大学医学科学技术研究中心,宁夏银川750004)
伴随生活节奏加快,工作压力增加以及女性对自身生活质量要求的提高,因卵巢因素而影响健康的问题已日益受到人们的重视。卵巢功能的突然减退导致严重的内分泌和代谢紊乱,造成衰老、老年痴呆和骨质疏松等,同时也给患者带来沉重的心理负担。雌激素是一种类固醇激素,在女性体内主要由卵巢分泌产生,研究发现雌激素不仅在女性生育能力、体内水钠代谢、心血管系统功能及骨代谢等方面发挥重要作用,而且能影响神经系统发育,并具有重要的神经保护作用[1]。虽然可以使用激素替代疗法提高体内雌性激素水平,但是存在效果不稳定和不良反应大等缺点。卵巢移植有望成为克服卵巢衰竭患者神经内分泌紊乱的有效方法。本实验通过去势大鼠模型行卵巢移植,观察内源性雌激素释放对去势大鼠卵巢移植后海马神经元形态、尼氏体数量和雌激素膜性受体(G protein-coupled receptor 30,GPR30)表达变化的影响,以进一步探讨雌激素对中枢神经系统的保护作用,为卵巢移植的临床应用提供实验依据。
1 材料与方法
1.1 材料
清洁级雌性SD 大鼠54 只,12 周龄,体质量300~350 g,新生3 d 内雌性乳鼠24 只,体质量20 g[宁夏医科大学动物中心提供,动物合格证号SCXK(宁)20050001)];GPR30 抗体(Abcam 公司,ab39742);二步法免疫组织化学检测试剂盒(北京中杉金桥公司);其他试剂均为进口或国产分析纯试剂。
1.2 方法
1.2.1 实验动物分组和处理:将大鼠随机分为对照组、卵巢去势组和卵巢移植组,其中对照组大鼠6只,去势组24 只,移植组24 只。24 只出生3 d 内的雌性SD 乳鼠作为卵巢移植供体。去势组大鼠按常规术式行卵巢切除。对照组大鼠行假手术,在卵巢旁进行卵巢大小的脂肪切除。卵巢移植组大鼠于去势7 d 后,在肾被膜下移植出生3日内乳鼠卵巢。对照组只行假手术。上述各组于移植后7、14、21 和28 d 处死,取大脑,4%多聚甲醛固定组织用于形态学研究,新鲜脑组织剥离海马,匀浆后提取总蛋白用于免疫印迹研究。
1.2.2 尼氏染色:固定后大脑,去除嗅球和后方的小脑,常规乙醇脱水石蜡包埋,连续切成5 μm 切片,间隔5 张取张切片,行10%甲苯胺蓝染色显示尼氏体。在高倍镜下,每张切片显微镜下选取5 个不同视野进行拍照。采用Image Pro Plus 6.0 图像分析软件,测量海马神经元内尼氏体面积,用每个高倍视野下尼氏体的面积代表尼氏体的数量。
1.2.3 免疫组织化学染色检测GPR30:石蜡切片常规脱蜡至水,滴加1 ∶500 PBS 稀释的山羊抗鼠GPR30 抗体,阴性对照用PBS 代替一抗,4 ℃孵育过夜。复温后,PBS 清洗后加入生物素标记的二抗,37 ℃孵育1 h,PBS 清洗后DAB 显色,脱水、透明、中性树胶封片。在高倍镜下,每张切片显微镜下选取5 个不同视野进行拍照。采用Image Pro Plus 6.0图像分析软件,测量阳性细胞累积吸光度(IA)。
1.2.4 Western blot 检测GPR30:每个蛋白样品上样约40 μg,进行SDS-聚丙烯酰胺凝胶电泳,半干转移法将蛋白条带转移到PVDF 膜上,5%脱脂奶粉封闭后,加入1∶500 稀释的GPR30 抗体,4 ℃孵育过夜。次日复温、洗膜,1∶1 000 相应二抗室温孵育1 h后ECL 显色。同一张膜上,相应方法显示内参β-actin的条带。Bio-Rad 显色系统照相。用Image-J图像分析软件测量目标条带和内参条带的吸光度,用目标条带和内参条带的吸光度比值代表蛋白表达的相对量。
1.3 统计学分析
使用SPSS 12.0 软件进行数据统计,实验数据用均数±标准差(±s)表示,各组间比较采用单因素方差分析。
2 结果
2.1 形态学改变
对照组海马形态正常,神经元尼氏体丰富。去势组随去势时间延长,海马神经元排列散乱,神经元层数减少,胞体有皱缩,细胞核可见固缩深染。神经元尼氏体数量减少,去势28 d 时,为对照组的6%;卵巢移植组元随着移植时间的延长,海马神经元形态逐渐好转并与正常形态接近,尼氏体数量逐渐增加,移植28 d 时,达到对照组的80%(图1)。
2.2 GPR30 免疫组织化学染色
与对照组比较,去势组GPR30 的表达随着去势时间延长在各区均有所下降,去势28 d 时,表达量下降到对照组的1.8%。卵巢移植组随着移植时间的延长,GPR30 的表达量有逐步回升的趋势,移植28 d 时,达到对照组的83%(图2)。
2.3 GPR30 免疫印迹结果
与对照组相比,去势组GPR30 蛋白表达随去势时间的延长逐渐减少,去势28 d 时,下降到对照组的42%;卵巢移植组GPR30 蛋白表达随移植时间的延长逐渐增多,移植28 d 时达到对照组的88%(图3)。
3 讨论
雌激素对中枢神经系统有重要作用[2],海马具有调节情绪、参与学习记忆和认知等功能,雌激素通过其受体,调节海马神经元的突触可塑性并影响认知行为[3]。
神经元内尼氏体参与合成影响神经元功能的神经递质和神经调质,尼氏体的变化可作为观察神经元受损的主要指标[4]。出生3 d 内的乳鼠,其卵巢为原始卵泡,抗原性低,对缺血缺氧不敏感,易成活,是移植的理想供体,肾脏因血供丰富并且是一个免疫缺陷区而有利于移植卵巢的存活和卵泡发育,因此采用在肾被膜下移植新生乳鼠卵巢的手术方式[5-6]。
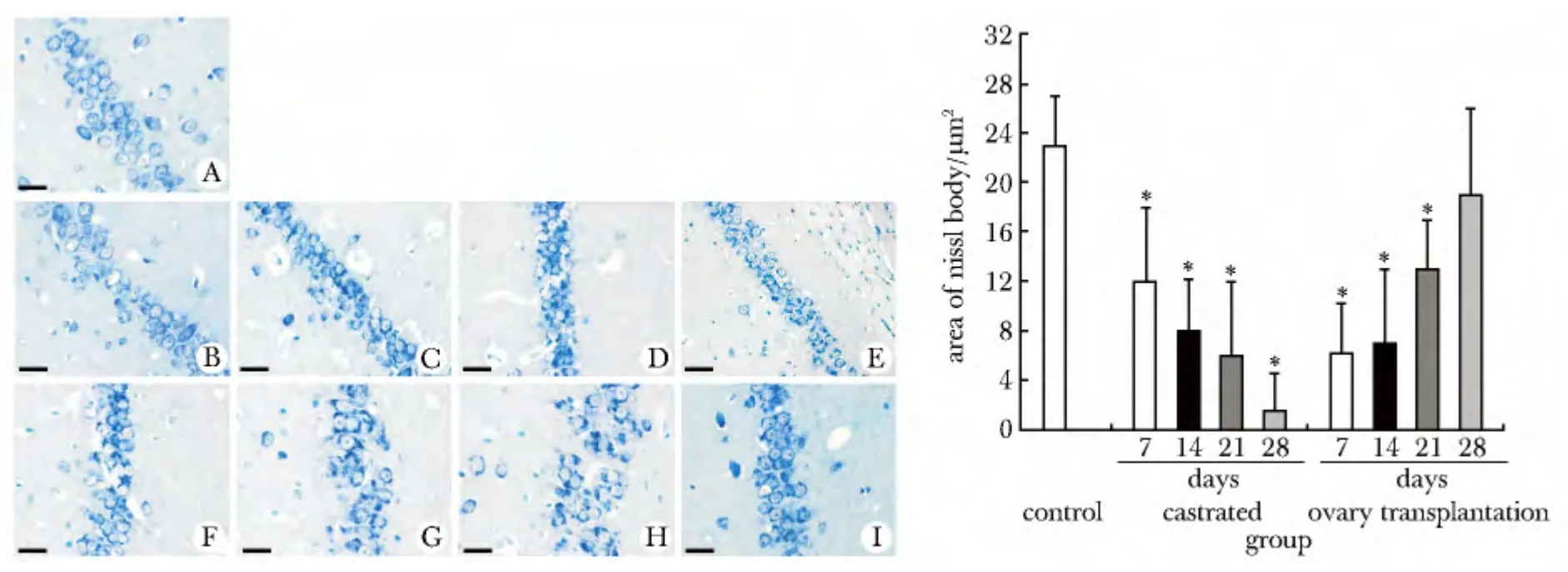
图1 各组海马神经元形态和尼氏体面积变化Fig 1 The changes of structures and area of Nissl bodies of hippocampus neurons in three groups(scale bar=50 μm)
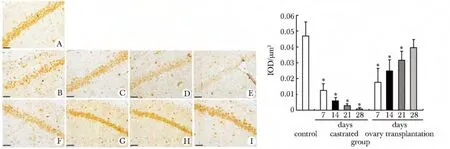
图2 各组海马神经元GPR30 免疫组织化学检测结果Fig 2 The results of immunohistochemistry of hippocampus GPR30 in three groups(scale bar=50 μm)
本研究发现,去势后海马神经元形态破坏,卵巢移植后得到一定恢复。但是移植7 d 组的神经元形态恢复不明显,与去势7 d 组相比无差异,这可能与移植物在移植7 d 后才能建立良好有效的血液循环有关[7]。本课题组前期实验[8-9]显示,卵巢去势后,雌激素水平迅速下降,7 d 为对照组的1/12 左右,28 d 雌激素水平接近0;卵巢移植后血清雌激素较孕酮水平升高更显著。提示卵巢移植后,雌激素在神经元的存活及功能维持中发挥了作用。
雌激素膜受体GPR30 是蛋白耦联受体超家族的一员,主要分布于下丘脑-垂体轴、海马和脑干等部位。对大鼠海马内GPR30 的原位杂交和免疫组化研究,发现海马内锥体细胞和齿状回颗粒细胞中有GPR30 的mRNA 和蛋白水平的表达[10-11]。生后雌性大鼠海马内GPR30 表达水平呈递增趋势并最终遍布整个海马,进而推测GPR30 可能参与了雌激素对海马锥体层神经元突触可塑性的调节并影响学习记忆等功能[12-13]。在本实验中,GPR30 随着去势时间的延长,表达量逐渐减少,移植组中则随着移植时间的逐渐延长而升高,并且两者都存在明显的雌激素水平依从性,至移植28 d 时与对照组无差异,随着移植时间的进一步延长,这种差异可能逐渐消失。
以上实验均提示,GPR30 参与雌激素对海马锥体层神经元突触可塑性的调节,从而发挥相应的神经保护作用。雌激素如何通过雌激素-膜受体GPR30 介导海马神经元保护的机制还需做进一步的研究。
[1]Vegeto E,Belcredito S,Ghisletti S,et al.The endogenous estrogen status regulates microglia reactivity in animal models of neuroinflammation[J].Endocrinology,2006,147:2263-2272.
[2]李正仪,李志伟,郭金涛.17-β 雌二醇对前脑缺血-再灌注大鼠大脑皮质神经元保护作用及BDNF 表达的影响[J].脑与神经疾病杂志,2011,19:24-27.
[3]崔翔,陶诗奇,徐海伟,等.ERβ 调节海马依赖性高级认知功能的研究进展[J].神经解剖学杂志,2012,28:105-108.
[4]潘琪,牛朝诗.蛋白酶体抑制剂诱导大鼠黑质变性伴包涵体形成[J].中华神经医学杂志,2009,8:455-458.
[5]Shimizu T,Jiang JY,Iijima K,et al.Induction of follicular development by direct single injection of vascular endothelial growth factor gene fragments into the ovary of miniature gilts[J].Biol Reprod,2003,69:1388-1393.
[6]Shimizu T,Iijima K,Miyabayashi K,et al.Effect of direct ovarian injection of vascular endothelial growthfactor gene fragments on follicular development in immature female rats[J].Reproduction,2007,134:677-682.
[7]Dissen GA,Lara HE,Fahrenbach WH,et al.Immature rat ovaries become revascularized rapidly after autotransplantation and show a gonadotropin-dependent increase in angiogenic factor gene expression[J].Endocrinology,1994,134:1146-1154.
[8]孔斌,刘芳,张文华,等.卵巢移植对去势大鼠海马神经元形态及BDNF 表达的影响[J].神经解剖学杂志,2012,28:273-277.
[9]孔斌,黑常春,刘芳,等.卵巢移植对去势大鼠海马神经元的抗凋亡作用[J].中国老年学杂志,2014,2:703-704.
[10]Matsuda K,Sakamoto H,Moil H,et al.Expression and intracellular distribution of the G protein-coupled receptor 30 in rat hippocampal formation[J].Neurosci Lett,2008,441:94-99.
[11]喻琳麟,岳利民.GPR 30/GPER 介导雌激素快速效应的研究进展[J].生理科学进展,2013,36:437-440.
[12]赵承军,邓其跃,张东梅,等.非基因型雌激素膜性受体GPR 30 在生后雌性大鼠海马内的发育学表达与亚细胞水平定位研究[J].生物化学与生物物理进展,2009,36:103-107.
[13]王颖,邬仪杰,刘艺昀,等.G 蛋白偶联的雌激素受体在体内的表达与功能[J].生命的化学,2010,30:860-865.

