海洋解淀粉芽孢杆菌(Bacillus amyloliquefacien)产抗生素Macrolactin A的碳源优化*
侯东园 吴祖芳 张 鑫
(宁波大学海洋学院 应用海洋生物技术教育部重点实验室 宁波 315211)
由于从陆地微生物中探查筛选天然药物及发现新的代谢产物的速率减缓(Tulpet al, 2004), 加之海洋环境的特殊性, 从海洋获取药物资源成为新世纪海洋生物技术的重要发展方向(Haefner, 2003; 王征等, 2006)。Macrolactin系列天然产物是美国 Scripps海洋研究所 Fenical教授课题组发现的一类具有抗菌、抗病毒和抗肿瘤等多种药理活性的24元环大环内酯类抗生素(Heet al, 2012b), 目前该家族共有19个成员(Gustafsonet al, 1989; Jaruchoktaweechaiet al,2000)其中Macrolatin A是由24元内酯环、吡喃型葡萄糖和一个开链的酸构成, 结构式如图 1所示。Macrolactin A不但有抗菌作用, 而且在体外有显著抑制B16-F10黑色素瘤细胞活性, 更为重要的是Macrolactin A能有效抑制哺乳动物Ⅰ型和Ⅱ型单纯疱疹病毒(Herpes simplex)的复制及HIV在T淋巴细胞内的复制(Kimet al, 1997; 董晓毅等, 2008)。然而, 由于Macrolactin A结构复杂、化学合成步骤多, 得率非常低, 通过天然生物材料直接提取, 分离步骤多, 样品易变性, 因此药源不足已成为制约该类化合物进一步研发的瓶颈。
为了实现Macrolatin A的大规模生产, 生物发酵是其理想途径, 本研究采用一株前期研究得到的可稳定产 Macrolactin类化合物的海洋细菌海洋解淀粉芽孢杆菌(Bacillus amyloliquefaciens) ESB-2 (Heet al,2012a), 能够高效合成 Macrolatin A, 由于发酵法生产受培养条件和环境等影响较大, 因此必须通过优化发酵工艺条件来提高Macrolatin A的产量。前期研究中通过发酵条件优化使其产量有所提高(Heet al,2012a), 鉴于目前国内外还未有对产 Macrolactin A微生物培养基成分优化的报道(Yanget al, 2009), 作为培养基重要组分的碳源是细胞生长最重要的营养和能量来源, 碳源种类对于细胞催化的次级代谢水平具有不同的抑制效应(Kimet al, 2005)。而Macrolactin A产生量的检测必需对发酵培养液进行分离纯化过程; 高速逆流色谱法(high speed countercurrent chromatography, HSCCC)作为一种能在一个流程中分离复杂样品中极性差异较大的各个组分制备纯品的分离技术(Ito, 1991), 其方法简捷和快速高效, 仪器及试剂成本明显低于高效液相色谱(Owenet al, 1997;Liet al, 2001), 已广泛应用于生物工程、中药成分分析和制备、天然产物化学等领域(孙媛媛等, 2003), 在微生物产物的分离纯化方面及多种结构类型抗生素的分离纯化方面也得到成功的运用(Dalhoffet al,2003; Nishivamaet al, 2000)。
为提高该菌生产 Macrolactin A的产量, 本研究采用大孔树脂静态吸附法对该菌株的次级代谢产物进行粗提取, 进一步采用高速逆流色谱法对该菌株的粗提物进行分离提纯, 得到高纯度的单体化合物,探究了不同碳源对 Macrolactin A产量的影响, 现将主要研究结果报道如下。

图1 Macrolactin A的化学结构Fig.1 The chemical structure of Macrolactin A
1 材料与方法
1.1 实验材料
1.1.1 菌株 海洋解淀粉芽孢杆菌(Bacillus amyloliquefaciens)ESB-2, 保藏于宁波大学海洋学院海洋生物实验室。
1.1.2 培养基 2216E基础培养基, 蛋白胨5.0g、酵母粉 1.0g、琼脂 15.0g、海水晶 35.0g、硫酸亚铁0.1g、1000mL蒸馏水, 用于ESB-2菌株平板培养; 液体培养基, 蛋白胨5.0g、酵母粉1.0g、海水晶35.0g、硫酸亚铁0.1g、1000mL蒸馏水, 用于ESB-2摇瓶液体发酵。所有培养基均在 121°C, 1×105Pa下灭菌20min备用。
1.1.3 主要仪器及试剂 高效逆流色谱系统:TAUTO HSCCC-TBE300B高速逆流色谱仪(螺旋管行星式串联三柱逆流色谱仪, 管径 2.6mm, 柱体积280mL, 进样体积20mL), SHP DC-0506低温恒温槽,AKTAprime plus泵, 上海同田生物技术有限公司;Waters e2695高效液相色谱仪, 色谱分析柱 YMCPack ODS-A(150 mm ×4.6 mm, 5 μm), 美国 Waters公司; SPX型智能生化培养箱, 宁波江南仪器厂; GL-21MC台式高速冷冻离心机, 湖南湘仪; UV-3300紫外可见光分光光度计; LDZX-50KBS 立式压力蒸汽灭菌器, 上海申安医疗器械厂; SW-CJ-2D型超净工作台; HGC-12D氮吹仪; PHS-3C pH计; RE-52C旋转蒸发器等。
甲醇、乙腈(色谱级, CNW公司), 正戊烷、乙酸乙酯、ADS-30大孔树脂、无水乙醇, 琼脂粉、氯化钠、蔗糖、葡萄糖、麦芽糖、糊精、可溶性淀粉、乳糖、甘油、油酸等(分析纯, 国药)。
1.2 实验方法
1.2.1 菌株活化及发酵培养 取菌株 ESB-2在基础培养基上活化24h, 接种于装有100mL基础发酵液的250mL三角瓶中, 置于控温摇床中, 30°C、150r/min活化24h, 作为种子液, 再以5%接种量, 接种到发酵培养液中, 30°C、150r/min发酵48h, 发酵液备用。
1.2.2 菌株发酵产物Macrolactin A的粗提取 发酵液用乙酸乙酯等体积萃取三次, 合并提取液, 45°C旋转蒸发至干, 加入1mL甲醇溶解, 12000r/min离心15min, 取上清液。
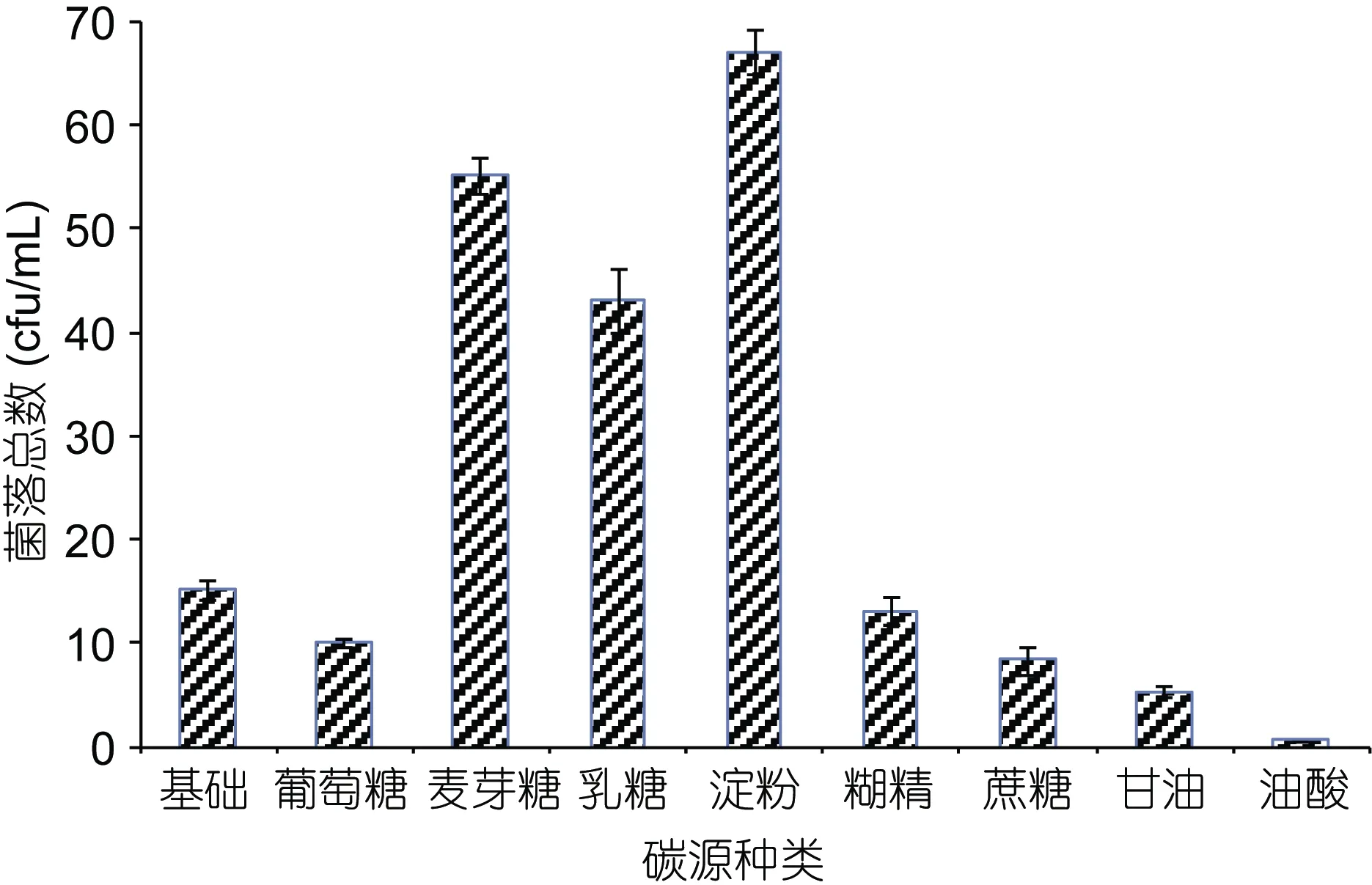
1.2.3 碳源筛选 选择葡萄糖、蔗糖、麦芽糖、乳糖、糊精、可溶性淀粉、甘油和油酸8种不同类型的碳源, 以 1%的添加量添加到基础平板培养基中, 观察其生长情况, 选择该菌株可利用的碳源。
1.2.4 碳源优化 可利用碳源添加量为 1%, 接种同批次种子菌悬液, 5%接种量, 40%装液量, 30°C, 摇瓶转速 150r/min, 发酵 48h, 乙酸乙酯等体积萃取三次, 旋转蒸干, 甲醇溶解离心处理得上清液, 经 0.45μm微孔滤膜过滤, HPLC法检测得到Macrolactin A的产量, 比较加入不同碳源的培养基得到的该菌株产物Macrolactin A的含量。
1.2.5 Macrolactin A纯品的制备 Macrolactin A粗品的制备: 分批次摇瓶共培养30L发酵液, 对发酵液进行菌体离心(8000 r/min, 10min)、利用ADS-30大孔树脂静态吸附上清液, 选择无水乙醇解吸附, 得到无水乙醇洗脱液, 旋转蒸发至干得到活性浸膏, 纯水悬浮, 采用乙酸乙酯萃取三次, 旋转蒸干用甲醇溶解,得到Macrolactin A的粗提取物, 氮气吹干备用。
逆流分离: 按照V(乙酸乙酯) :V(正己烷) :V(甲醇)︰V(水)为 4︰3︰4︰3溶剂体系将所有溶剂加入分液漏斗中, 充分振摇后静置待其分层分相; 取上相作为高速逆流色谱的固定相, 取下相为流动相, 上、下相超声脱气 20 min备用; 用流动相与固定相的混合溶液 [按照V(流动相) :V(固定相) = 1︰1的比例]配制样品液(章能胜等, 2010)。高速色谱系统开机预热, 将固定相以30mL/min的恒定速度泵满螺旋管柱,开启速度控制器, 使高速逆流色谱仪螺旋管柱按顺时针方向旋转转速为800 r/min, 再以流速为10mL/min泵入流动相, 检测波长 280nm, 根据色谱图手动收集色谱峰组分。
纯度分析: 利用HPLC法对制备得到的样品进行纯度分析, 所用色谱分析柱为 YMC-Pack ODS-A(150 mm × 4.6 mm, 5 μm), 检测波长 280nm, 柱温30°C, 流动相为甲醇和水; 梯度洗脱60min内甲醇由10%升至 90%, 然后用甲醇和水继续洗脱 10min, 流速0.8mL/min, 进样量10μL。
1.2.6 Macrolactin A含量的检测 标准曲线的制作, 准确称取高速逆流色谱法制备的纯品做对照品,用甲醇溶解并定容至浓度 1mg/mL, 用甲醇逐级稀释到 0.2、0.04和 0.008mg/L浓度的纯品溶液测定, 以各个浓度标准溶液测定出的峰面积对应的质量浓度作图, 得到标准曲线并求出回归方程。
含量检测: 利用高效液相色谱法测定Macrolactin A的含量, 测定条件为色谱柱YMC-Pack ODS-A (150 mm ×4.6 mm, 5 μm), 检测波长 280nm, 柱温 30°C, 流动相(A)甲醇: (B)水; 梯度洗脱60min内甲醇(A)由10%升至90%, 流速0.8mL/min, 进样量10μL。
1.2.7 菌株生长曲线、pH及总糖的测定 引用相关文献方法(杨云喜等, 2014), 将上述 ESB-2种子液以 5%的接种量接种于麦芽糖培养基中, 采用空白培养基对照, 三次平行, 每隔2h取5mL发酵液迅速测其OD值并记录; 采用pH计直接测发酵液pH; 采用蒽酮比色法测定总糖。
2 结果与分析
2.1 Macrolactin A纯品的制备
2.1.1 Macrolactin A的 HSCCC分离及纯度检测采用V(乙酸乙酯) :V(正己烷) :V(甲醇) :V(水)为4︰3︰4︰3的溶剂体系, 按照1.2.5的方法进行分离, 将样品溶于10mL等体积上相和下相混合溶液中, 进行HSCCC分离, 得到 HSCCC分离图(图 2), 测得固定相的保留率为48%。根据色谱图手动收集各色谱峰组分, 利用HPLC将每一试管收集的组分进行分析, 根据 HPLC色谱图上的保留时间及光谱图可以初步判断收集的馏分A为Macrolactin A, 同时采用HPLC峰面积归一化法, 计算分离得到的馏分纯度达 95.8%,其HPLC图谱与光谱图结果如图3所示。

图2 Macrolactin A粗提物的HSCCC色谱图Fig.2 HSCCC chromatogram of the crude extract of Macrolactin A

图3 HSCCC分离纯化得到的Macrolactin A高效液相色谱图(a)及紫外光谱图(b)Fig.3 HPLC and UV of Macrolactin A by HSCCC
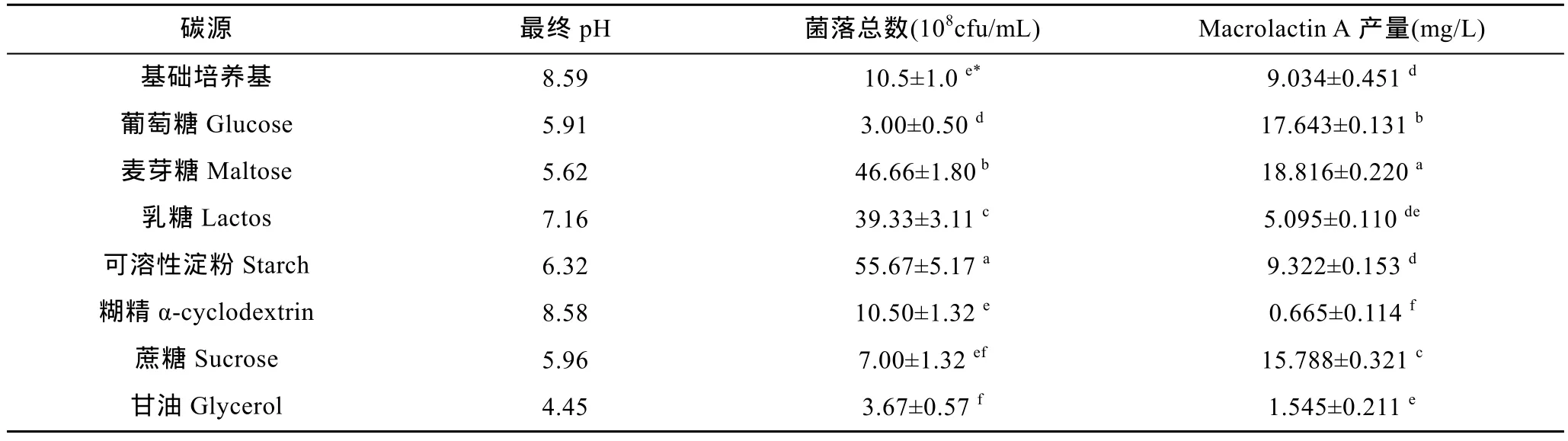
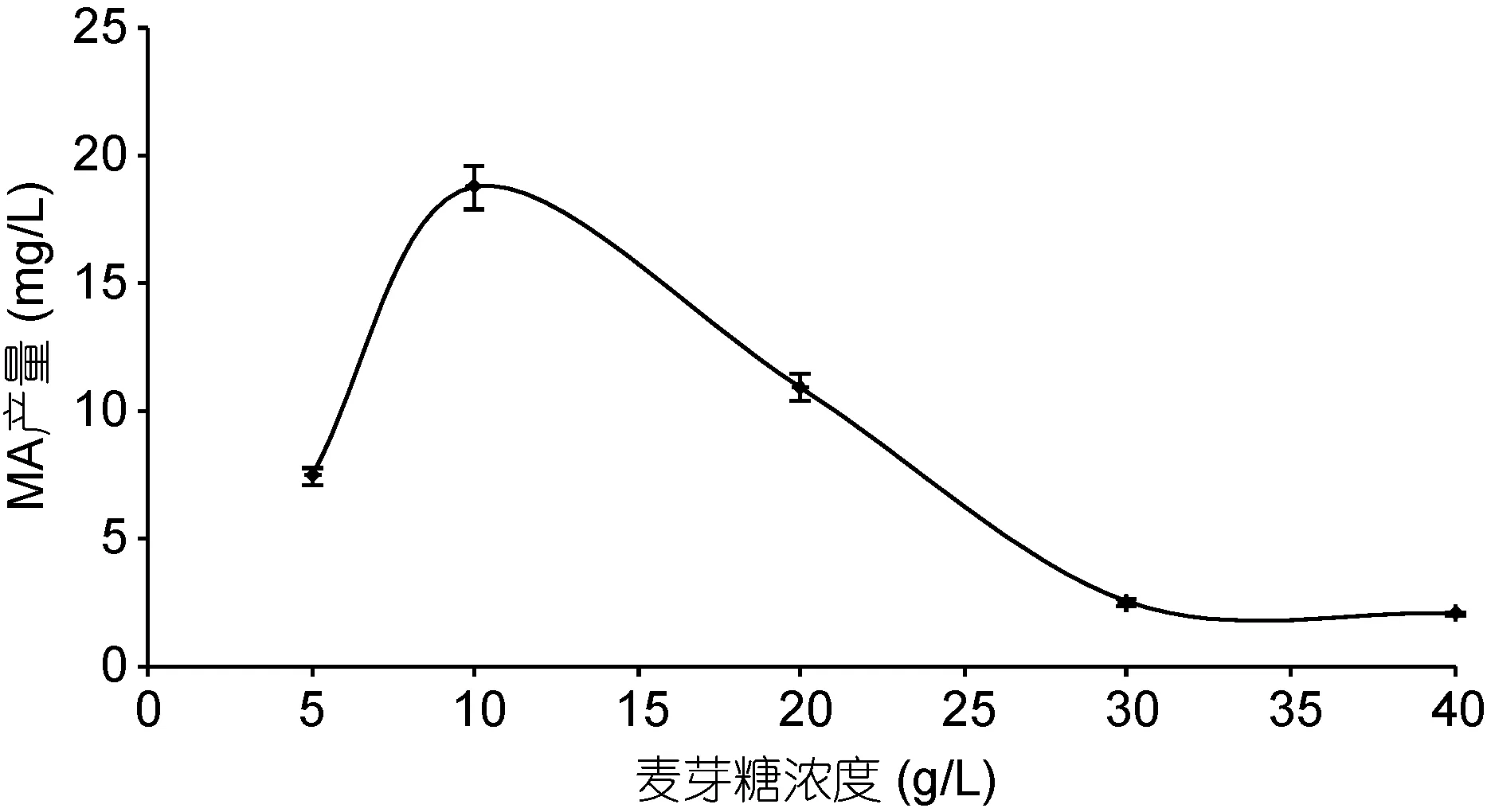
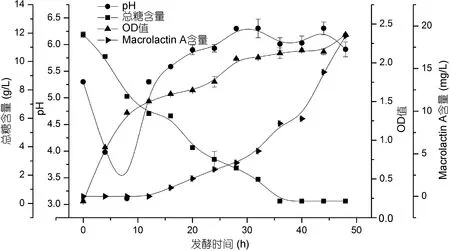
本研究首先采用ADS-30大孔树脂对发酵液进行初步纯化的处理, 取代乙酸乙酯萃取, 节约了有机溶剂的使用, 使用高效液相色谱测得其纯度达 23%以上。继而利用HSCCC对其进一步分离纯化, HSCCC分离中容积体系的选择对分离效果至关重要, HSCCC分离规律显示, 一个好的容积系统固定相要有较高的保留率, 两相系统分离时间小于 30s; 分配系数K尽量符合0.5 2.1.2 Macrolactin A标准曲线 用甲醇溶解以上制备的纯品并定容至浓度 1mg/mL, 用甲醇逐级稀释到0.2、0.04、0.008mg/L浓度的纯品溶液测定, 以各个浓度标准溶液测定出的峰面积对应的质量浓度作图, 测得 Macrolactin A色谱峰面积与其质量浓度的线性方程为Y=2.9E+6X–33234, 相关系数R2=0.998。 高效液相色谱法虽耗时比较长、成本较高, 但是目前测定抗生素效价最为准确的方法。试验采用外标法, 分别将对照品与待测物质进行液相色谱法测定,可根据相同保留时间对应的峰值的峰面积的比例来测定待测物的含量(王洪强等, 2013)。 2.2.1 碳源筛选 选择乳糖、葡萄糖、麦芽糖、蔗糖、半乳糖、甘油、糊精、可溶性淀粉和油酸对ESB-2进行不同碳源利用实验, 添加浓度均为 1%, 固定培养基其它成分, 培养条件30°C, 24h。通过平板培养计数观察发现(图4), 2216E基础培养基与添加了乳糖、葡萄糖、蔗糖、半乳糖、甘油、糊精和可溶性淀粉这几种碳源的培养基均可被该菌株利用, 油酸抑制该菌株生长。其中较好利用的分别为淀粉、麦芽糖和乳糖, 其它几种碳源利用情况相对较差。 图4 碳源对ESB-2的菌落总数的影响Fig.4 Effect of carbon sourceon thenumber of totalcolony of ESB-2 培养基的碳源是能够向微生物提供组成细胞物质或者代谢产物中碳骨架的营养物质, 是组成培养基的重要成分之一, 本研究选择了单糖, 双糖,多糖等多种类碳源对其进行碳源利用实验。由结果可以看出碳源对海洋解淀粉芽孢杆菌 ESB-2菌株的生物量具有重要的的影响, 从而选择出乳糖、葡萄糖、蔗糖、半乳糖、甘油、糊精、可溶性淀粉作为碳源, 进一步考察不同碳源对该菌株产Macrolactin A的影响。 2.2.2 碳源对 ESB-2菌株产 Macrolactin A的影响用基础培养基做对照, 选择乳糖、葡萄糖、蔗糖、半乳糖、甘油、糊精、可溶性淀粉7种不同的碳源,其质量浓度均为 1% (W/V), 培养基其它成分不变,进行发酵, 其对菌体的生物量和 Macrolactin A的产量影响如表 1所示。由表 1所知, 菌体生长和Macrolactin A的产生并无直接关系, 加入淀粉的培养基中菌体生物量最高, 其产物与基础培养基中持平,即较高的菌体生长不一定得到较高的Macrolactin A的积累量。 由Macrolactin A产量可以初步判断该菌株可以有效利用多种单糖、双糖碳源(刘俊, 2010), 与文献报道一致(贺娟, 2011); 添加乳糖、甘油和糊精的产量比较低, 其原因可能是海洋解淀粉芽孢杆菌降解多糖或者发酵乳糖的能力较差, 其中麦芽糖、葡萄糖和蔗糖均能够得到有效的利用, 其 Macrolactin A的产量均超出 2216E基础培养基, 通过数据软件SAS分析, 可得到麦芽糖是其最佳碳源, 鉴于蔗糖成本高于葡萄糖, 葡萄糖与麦芽糖成本相当, 综合考虑,故选择产量更高的麦芽糖作为最佳碳源更利于工业化生产。 表1 碳源对ESB-2菌株生物量及Macrolactin A产量的影响Tab.1 Effects of carbon source on biomass and Macrolactin A production by ESB-2 2.2.3 麦芽糖浓度对Macrolactin A产量的影响 通过添加不同浓度的麦芽糖(5、10、20、30和40 g/L), 其它培养条件一致, 测定其Macrolactin A的产量, 结果如图5所示。从图5中可以看出, Macrolactin A的产量随着麦芽糖的浓度的变化有显著变化, 麦芽糖过低, 不利于菌体的生长, 在麦芽糖浓度为10 g/L以下时, MA产量基本呈线性增加, 在10 g/L以上时, 随着麦芽糖浓度增加 Macrolactin A的产量迅速降低, 表明过高的麦芽糖浓度则会对菌体产次级代谢产物产生抑制作用。当麦芽糖浓度为10 g/L时, Macrolactin A含量最高, 为 18.816 g/L, 是基础培养基的 2.08倍,表明麦芽糖浓度对发酵活力有很大影响, 1%浓度为其最佳添加浓度。 图5 麦芽糖浓度对Macrolactin A产量的影响Fig.5 Effects of maltose concentration on Macrolactin A production 通过对麦芽糖浓度优化, 寻找到该菌株产Macrolactin A的最适浓度, 试验中发现, 麦芽糖浓度会对Macrolactin A的产量有非常显著的影响, 通过本次最佳碳源及其最佳浓度的发酵优化, 虽然大大提高了Macrolactin A的发酵产量, 但是该产量还不足以达到日后产业开发的需求, 更多的优化研究需要进一步的开展, 诱变、基因改造都可以进一步的尝试(李兴艳等, 2013)。 2.2.4 摇瓶发酵曲线 利用上述优化的发酵培养基, 进行摇瓶发酵得到 ESB-2的发酵过程曲线(0—48h), 其发酵曲线如图 6所示, 整个发酵过程中, pH先下降后上升, 总糖不断被消耗, 产物不断积累。发酵 0—12h, 菌体处于对数生长期, 基质快速消耗, 此时该菌株的次级代谢产物 Macrolactin A含量很低,pH下降其原因可能是菌株生长较快呼吸作用释放出二氧化碳与有机酸导致。发酵 12—24h, 菌体进入稳定期, pH略微上升, 基质快速消耗, 此时Macrolactin A的产量呈现上升趋势。发酵24—48h, pH逐步上升可能是菌株产物呈现碱性的缘故, 随着菌体浓度的上升, 次级代谢产物积累较多, 说明发酵产物和菌体的生长是部分偶联的(刘朝辉等, 2008)。基质还原糖浓度的消耗过程跟菌体的生长、发酵产物的合成呈现对应关系, 发酵 24h后, 基质消耗缓慢, 此时消耗的基质主要用于合成代谢产物。 摇瓶发酵曲线为其放大发酵提供必要的依据(刘超超, 2013), 通过对摇瓶发酵曲线的模拟, 可以发现该菌株产抗生素的周期较短, 通过对该菌株发酵条件的控制, 有望在发酵罐中的生产能力将比摇瓶发酵条件下有较好的提高。 图6 ESB-2摇瓶发酵过程曲线Fig 6 The fermentation curves of shaking flask culture 在科研和制药工业等药物质量控制中都需要大量的高纯度单体化合物, 然而应用传统的分离方法,例如通过薄层色谱、柱色谱或者高效液相制备色谱从植物、微生物中制备分离纯化单体活性化合物是比较困难和繁琐的。本研究利用ADS-30大孔树脂静态吸附结合高速逆流色谱法从海洋解淀粉芽孢杆菌体的发酵液分离出Macrolactin A纯品, 纯度达到95.8%,分离时间短且效率较高, 为进一步实验分析提供了依据。继而, 通过对ESB-2初步的碳源优化, 得到麦芽糖为最佳碳源, 最佳浓度1%, 且发酵2d产量可达到18.82 mg/L, 是其优化前的2倍多, 与国内现有产Macrolactin A菌株需要发酵 7d相比, 发酵周期短,其日产量是已报道的产Macrolactin A菌株的3.5倍。说明该菌株是一株具有极高应用价值的菌株, 也为下一步发酵培养基中氮源、无机盐、前体物质的优化及发酵扩大培养提供了可行的方法, 可为进一步的工业化生产打下基础。 王 征, 董平原, 张天民等, 2006. 海洋抗肿瘤药物研究开发中的主要问题. 食品与药品, 8(4): 1—4 王洪强, 何 山, 杨 锐等, 2013. 一株海洋解淀粉芽孢杆菌(Bacillus amyloliquefaciens)生产Macrolactin B 的发酵条件优化. 海洋与湖沼, 44(6): 1592—1596 刘 俊, 2010. 多粘类芽孢杆菌胞外多糖的发酵条件、结构、化学修饰及其抗氧化活性的研究. 南京: 南京农业大学博士学位论文 刘超超, 2013. 一株抗真菌抗生素菌株的鉴定及发酵工艺优化.杭州: 浙江大学硕士学位论文 刘朝辉, 陈 云, 齐 崴等, 2008. 中性 β-甘露聚糖酶分批发酵动力学研究. 化学工程, 36(10): 66—70 孙媛媛, 唐玉海, 2003. 高速逆流色谱技术在中草药有效成分分离中的应用. 西北药学杂志, 18(6): 282—283 李兴艳, 张丙云, 尚永彪, 2013. 正交试验优化酵母多糖锌配合物的制备及其对尿素的吸附性能. 食品科学, 34(14):57—62 杨云喜, 李 佩, 徐岳松等, 2014. 产抗菌肽乳酸菌的分离、鉴定及培养条件优化. 应用与环境生物学报, 20(5): 817—824 贺 娟, 2011. 一株产大环内酯类抗真菌抗生素菌株的鉴定及发酵工艺优化. 杭州: 浙江大学硕士学位论文 章能胜, 王金彬, 汪小艳等, 2010. 高速逆流色谱法从蝙蝠蛾拟青霉中快速分离制备麦角甾醇纯品. 色谱, 28(1):68—72 董晓毅, 王梁华, 孙铭娟等, 2008. 产Macrolactins的海洋细菌X-2中Ⅰ型PKS基因簇的筛选鉴定与功能分析. 微生物学通报, 35(9): 1367—1372 Cao X L, Wang Q E, Li Yet al, 2011. Isolation and purification of series bioactive components fromHypericum perforatumL. by counter-current chromatography. Journal of Chromatography B, 879(7—8): 480—488 Dalhoff A, Nasu T, Okamoto K, 2003. Beta-lactamase stability of faropenem. Chemotherapy, 49(5): 229—236 Gustafson K, Roman M, Fenical W, 1989. The macrolactins, a novel class of antiviral and cytotoxic macrolides from a deep-sea marine bacterium. Journal of the American Chemical Society, 111(19): 7519—7524 Haefner B, 2003. Drugs from the deep: marine natural products as drug candidates. Drug Discovery Today, 8(12): 536—544 He S, Wang H Q, Wu Bet al, 2012a. Response surface methodology optimization of fermentation conditions for rapid and efficient accumulation of macrolactin a by marineBacillus amyloliquefaciensESB-2. Molecules, 18(1):408—417 He S, Wang H Q, Yan X Jet al, 2012b. Preparative isolation and purification of macrolactin antibiotics from marine bacteriumBacillus amyloliquefaciensusing high-speed counter-current chromatography in stepwise elution mode.Journal of Chromatography A, 1272: 15—19 Ito Y, 1991. Recent advances in counter-current chromatography.Journal of Chromatography A, 538(1): 3—25 Jaruchoktaweechai C, Suwanborirux K, Tanasupawatt Set al,2000. New macrolactins from a marineBacillussp. Sc026.Journal of Natural Products, 63(7): 984—986 Kim H-H, Hwang S-Y, Kim W-Get al, 1997. Neuronal cell protection activity of macrolactin A produced byActinomadurasp.. Journal of Microbiology and Biotechnology,7(6): 429—434 Kim H O, Lim J M, Joo J Het al, 2005. Optimization of submerged culture condition for the production of mycelial biomass and exopolysaccharides byAgrocybe cylindracea.Bioresource Technology, 96(10): 1175—1182 Li H B, Chen F, 2001. Preparative isolation and purification of six diterpenoids from the Chinese medicinal plantSalvia miltiorrhizaby high-speed counter-current chromatography.Journal of Chromatography A, 925(1—2): 109—114 Nishivama T, Matsuzaki K, Kovama Het al, 2000. In vitro activity of faropenem against beta-lactamase producing clinical isolates. The Japanese Journal of Antibiotics, 53(3):179—183 Owen R O, McCreath G E, Chase H A, 1997. A new approach to continuous counter-current protein chromatography: Direct purification of malate dehydrogenase from aSaccharomyces cerevisiaehomogenate as a model system. Biotechnology and Bioengineering, 53(4): 427—441 Tulp M, Bohlin L, 2004. Unconventional natural sources for future drug discovery. Drug Discovery Today, 9(10):450—458 Yang Q, Han W J, Zhang W Jet al, 2009.Identification of a macrolactina antibiotic-producing marineBacillus amyloliquefaciensJY-863 strain and optimization of its fermentation conditions. Pharmaceutical Biotechnology,16(4): 311—315, 3462.2 碳源筛选优化分析
3 结论

