山羊卵巢维持基因FOXL2启动子活性及调控区域分析
耿立英,张 宇,李祥龙*,周荣艳,李兰会,王志刚
(1.河北科技师范学院,秦皇岛 066600; 2.河北农业大学动物科技学院,保定 071000)
山羊卵巢维持基因FOXL2启动子活性及调控区域分析
耿立英1,2,张 宇1,2,李祥龙1,2*,周荣艳2,李兰会2,王志刚2
(1.河北科技师范学院,秦皇岛 066600; 2.河北农业大学动物科技学院,保定 071000)
旨在研究山羊卵巢维持基因FOXL2启动子活性以及探究该基因的调控机理。从NCBI数据库调取FOXL2基因启动子序列,用生物信息学软件对其核心启动子和转录因子进行预测分析。使用 PCR技术克隆FOXL2基因启动子序列,并构建一系列缺失载体,瞬时转染293T和A375细胞,利用双荧光素酶基因检测仪测定相对荧光素酶活性值。结果表明,该基因启动子区域存在两个典型的CpG岛,分别位于(-920/+51(972 bp))和(+125/+555(430 bp))区域;经KpnⅠ和Hind Ⅲ双酶切鉴定表明,重组载体质粒构建正确;在细胞中插入不同长度的FOXL2基因启动子片段,随着启动子5′端截短,荧光素酶转录活性先升高再逐渐降低。(-934/+324)区域存在转录活性,(-32/+324)区段包含了转录的基本元件;(-934/-456)区域在转录过程中对FOXL2基因起负调控作用,(-456/-192)区域为正调控区域。
山羊;FOXL2基因;启动子;活性
FOXL2(Forkhead box L2)属于FOX叉头框转录因子家族,在体细胞中广泛表达。该基因在人类、鼠和山羊等物种中高度保守,人同源序列缺失则导致眼裂狭小综合症(BPES)[1],突变后FOXL2生物学结构与功能的改变,可能是小睑裂综合征的致病原因[2]。FOXL2被认为在性别分化中起到重要作用[3-5],是雌性的性别决定基因[6-7],对卵巢发育调控起关键作用[8-11],在小鼠和山羊的早期卵巢分化中,均发现了FOXL2基因的表达[12],其功能缺失会导致性别反转[13-14]。FOXL2基因从正常山羊胚胎发育的初期开始表达,并且36 dpc表达呈上升趋势,成年后表达消失[15]。山羊FOXL2基因受无角间性综合症(Polled intersex syndrome,PIS)区域调控表达,并与山羊间性形成具有紧密联系[16]。山羊FOXL2基因上游长度为1 055 bp的启动子区域曾被作为PIS区域调控重要元件被首度克隆,并插入到荧光素酶Luc报告基因载体,细胞转染试验验证了该启动子活性[17]。据报道FOXL2基因启动子为典型的GC-rich启动子,并且包含Sp1结合位点[17]。通常来说,这种类型的启动子应该含有多个转录起始位点,且转录起始元件分布在100 bp范围内[18]。除受启动子元件的转录调控外,山羊基因接受位于1q23无角综合症(PIS)区域的调控。到目前为止,虽然已验证了山羊FOXL2基因的启动子区域,但对于山羊FOXL2基因的转录调控的正负调控区域尚不明确。
本试验克隆了山羊FOXL2基因启动子序列,并通过生物信息学分析构建了启动子系列缺失报告基因载体,分析并探讨该基因的转录活性区域,为进一步研究FOXL2基因表达调控奠定基础。
1 材料与方法
1.1 样品及试剂
健康、体况良好的唐山奶山羊血液样品(正常64个,间性34个);DH5α菌种和绿色荧光蛋白质粒由实验室保存;pMD®19-T载体为宝生物工程有限公司产品;pGL3-Basic、pGL3-Control和PRL-TK载体均由北京原平皓生物技术有限公司赠送。TransStartTaqDNA Polymerase、dNTPs和T4 DNA连接酶为全式金(北京)生物技术有限公司产品;限制性内切酶KpnⅠ和Hind Ⅲ购自Thermo公司;质粒DNA小量提取试剂盒和琼脂糖凝胶回收试剂盒为上海生工生物工程有限公司产品;双荧光素酶Luc报告基因检测试剂盒为北京原平皓生物技术有限公司产品;脂质体转染试剂Lipofectamine 2000为Invitrogen公司产品;1640固体培养基、0.25%胰蛋白酶和小牛血清购自GIBCO公司。
1.2 启动子序列分析
利用NCBI数据库调取山羊FOXL2基因启动子序列(AY112725.2),使用软件Primer 5.0设计引物扩增该区域序列并送至测序公司测序。利用在线Methprimer程序对山羊FOXL2基因启动子序列进行CpG岛预测(http://www.urogene.org/methprimer/);使用在线程序Neural Network Promoter Prediction(NNPP)(http://promotor.biosino.org/)和Promoter Scan(http://www-bimas.cit.nih.gov/molbio/proscan/)进行核心启动子预测及转录因子分析[19]。
1.3 引物设计及载体构建
根据生物信息学分析结果,以FOXL2基因-1 000~+350区域(AY112725.2)为模板,对其5′端进行不同长度的缺失,并命名为P1(-934/+324)、P2(-456/+324)、P3(-192/+324)、P4(-104/+324)和P5(-32/+324)(图1),引物序列设计了KpnⅠ和Hind Ⅲ两种酶切位点(表1)。PCR扩增5个启动子缺失片段并切胶纯化回收,连接到pMD®19-T载体,利用引物两端酶切位点,再将目的片段从克隆载体上切割下来,并连接到表达载体pGL3-Basic上。酶切鉴定筛选的阳性克隆送至测序公司测序。
1.4 山羊FOXL2基因启动子转录活性的检测
293T和A375细胞均使用添加10%小牛血清的1640培养基培养。转染前1 d以1.5×105个·孔-1的密度接种于24孔培养板过夜培养,用于转染。293T和A375细胞脂质体与质粒总量比分别为1∶0.5和1∶0.25。设计阳性对照组为pGL3-promoter质粒与pRL-TK质粒共转染,阴性对照组为pGL3-Basic质粒与pRL-TK质粒共转染,试验组为pGL3-Basic/Px质粒与pRL-TK质粒共转染,具体转染与双荧光素酶检测荧光值步骤参照荧光素酶检测试剂盒操作说明进行。试验重复3次,每次3个平行。
1.5 数据处理
将所测得萤火虫荧光素酶蛋白表达量检测值F除以内参海参荧光素酶蛋白表达量检测值R,所得即为萤火虫荧光素表达量的相对值F/R,再除以阴性对照pGL3-Basic的相对荧光素酶检测的背景值,以消除不同转染批次的系统误差。试验数据使用SPSS17.0进行统计学分析。

图1 山羊FOXL2基因启动子不同长度片段扩增示意图Fig.1 Amplifying schematic diagram of different length fragments in goat FOXL2 promoter region
表1 山羊FOXL2 基因启动子扩增引物
Table 1 Primers for promoter amplification of goatFOXL2 gene
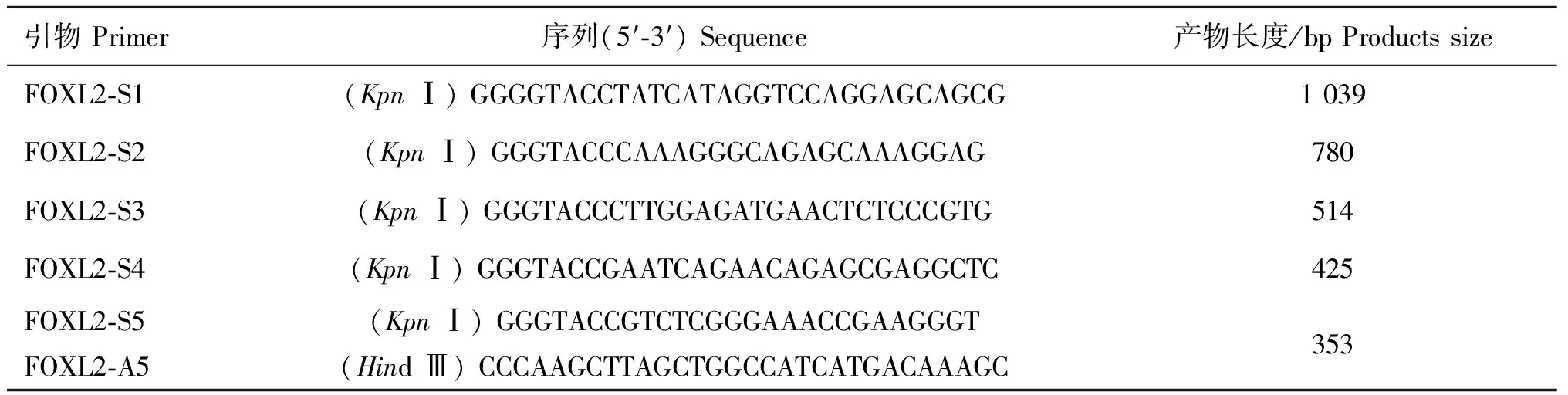
引物Primer序列(5′⁃3′)Sequence产物长度/bpProductssizeFOXL2⁃S1(KpnⅠ)GGGGTACCTATCATAGGTCCAGGAGCAGCG1039FOXL2⁃S2(KpnⅠ)GGGTACCCAAAGGGCAGAGCAAAGGAG780FOXL2⁃S3(KpnⅠ)GGGTACCCTTGGAGATGAACTCTCCCGTG514FOXL2⁃S4(KpnⅠ)GGGTACCGAATCAGAACAGAGCGAGGCTC425FOXL2⁃S5FOXL2⁃A5(KpnⅠ)GGGTACCGTCTCGGGAAACCGAAGGGT(HindⅢ)CCCAAGCTTAGCTGGCCATCATGACAAAGC353
2 结 果
2.1FOXL2基因启动子全长片段的获得
以正常唐山奶山羊基因组为模板,进行PCR扩增测序后,克隆得到的目的片段与NCBI提交的山羊FOXL2基因序列(AY112725.2)相似性为99%(图2),说明扩增片段来源正确,可用于后续试验。
2.2FOXL2基因启动子生物信息学分析
将测序得到的FOXL2-SA序列2 149 bp(-1 537/+612)提交到Methprimer程序进行预测分析(图3)。该区段存在两个典型的大小分别为972和430 bp的CpG岛,分别位于616~1 588 bp(-920、+51)区段和1 662~2 092 bp(+125、+555)区段。因此可以确定,FOXL2基因启动区域通过CpG岛招募重要转录因子发挥启动转录作用,而高甲基化状态的CpG岛反过来影响其对转录因子的招募,从而降低下游基因转录活性,即影响基因表达。
NNPP启动子程序的预测结果显示了3个阈值超过0.85的候选核心启动子区段,分别为-978~-929 bp、+257~+307 bp、+294~+444 bp,预测得分分别为0.85、0.86和0.86(表2)。

图2 FOXL2基因在NCBI中的比对结果Fig.2 Result of blast in NCBI of FOXL2 gene

图3 FOXL2基因CpG岛预测结果Fig.3 Result of predicting for CpG island of FOXL2 gene
表2 Neural Network Promoter Prediction启动子预测结果
Table 2 The promoter prediction result by neural network promoter prediction

起始位置Startingposition终止位置Endposition得分Score启动子序列Promotersequence560(-978)610(-929)0.85TTACCCCATAAATATAAATCTCACATCTTATATCTGTGCATACCTGTTTC1794(+257)1844(+307)0.86CGGCGCCAGCGGAAAAGAGCAGGGACTGCCCGGCCGCGGCGCGCCGGCTT1931(+294)1981(+444)0.86GGCGCCGGCGCCGCCCAGCCCGGGCAAGGGCGGCGGCGGCGGTGCGGGGG
使用Promoter Scan程序预测FOXL2-SA启动子结合位点,结果显示,+43~+293 bp区段的启动子分值最高达到了61.71(预测阈值为53.0),并且在此区域预测出Sp1、EARLY-SEQ1、T-Ag、AP-2、UCE.2、KROX24、EGR-1、UCE.1、MT-I.6和GCF转录因子,其中Sp1和AP-2出现频数最高,分别为7和4次。-276~-526 bp区段预测分值为54.06,也超出了阈值53.0分。此段区域中包括了GCF、UCE.2、AP-2、Sp1、T-Ag、H4TF1、JCV、EARLY-SEQ1、PuF和SIF转录因子,其中Sp1出现6次,AP-2出现5次(表3)。这些转录因子分布集中的区域,预示着对FOXL2基因表达起着重要调控作用,+43~+293 bp区域可能为FOXL2基因核心启动子区。
2.3 缺失启动子基因载体的构建
依据上述生物信息学分析结果,选取-934/+324区间作为最长克隆片段,其他片段分别为对其5′端进行不同长度的缺失,构建命名如下质粒:pGL3-Basic/P1(-934/+324)、pGL3-Basic/P2(-456/+324)、pGL3-Basic/P3(-192/+324)、pGL3-Basic/P4(-104/+324)和pGL3-Basic/P5(-32/+324)。最长片段pGL3-Basic/P1覆盖了两个CpG岛和所有转录因子富集区域;pGL3-Basic/P2为第一个CpG岛部分缺失片段,但包含Promoter Scan程序预测的两个核心启动子区域;pGL3-Basic/P3(-192/+324)缺失了Promoter Scan程序预测的一个核心启动子区域;pGL3-Basic/P4(-104/+324)保留了转录起始位点前100 bp区域;pGL3-Basic/P5(-32/+324)缺失了转录起始位点前所有片段。
将构建完成的Luc报告基因载体使用限制性内切酶KpnI和Hind III进行双酶切鉴定,如图4所示,所有正常长度的目的基因片段均被切割下来,因此所构建的重组载体质粒含有所克隆目的片段。
2.4 细胞转染及活性分析
使用Luc报告基因载体瞬时转染293T和A375细胞,转染48 h后裂解并收获细胞,细胞裂解液用于测定双荧光素酶活性并且计算Luc报告基因相对活性值。经过数据校正后,综合多次测定结果,用SPSS17.0软件分析缺失启动子片段启动子活性。试验结果表明,本试验所构建的各个缺失启动子片段的载体与pGL3-Basic空载体相比都具有明显的启动活性(P<0.01)。
表3 Promoter Scan预测启动子结果
Table 3 Promoter prediction by Promoter Scan

转录因子Transcriptionfactor正/反义链Sense/Antisensestrand位置/bpPosition权重Weight转录因子Transcriptionfactor正/反义链Sense/Antisensestrand位置/bpPosition权重WeightSp1+433.013GCF+-2762.284Sp1-483.061UCE.2--3151.278EARLY⁃SEQ1-505.795AP⁃2--3341.108Sp1-506.819Sp1--3503.292T⁃Ag+521.086AP⁃2--3501.355AP⁃2+901.355Sp1+-3553.361AP⁃2+921.108UCE.2+-3611.216Sp1+1182.755GCF+-3642.284Sp1-1232.772T⁃Ag--4701.086UCE.2+1241.278H4TF1--4921.679UCE.2-1271.216JCV--4941.427AP⁃2-1381.091AP⁃2+-4951.091AP⁃2-1401.672AP⁃2+-4951.064KROX24+1832.151AP⁃2+-4971.672Sp1+1873.013Sp1--4986.661EGR⁃1-1912.294Sp1--49810.681Sp1-1923.061Sp1--4993.013UCE.2+2231.278Sp1+-5043.061UCE.2-2261.216EARLY⁃SEQ1+-5065.795UCE.1-2361.700UCE.2--5161.278MT⁃I.6+2408.606PuF--5261.082GCF+2562.361SIF+-5261.161GCF-2622.284
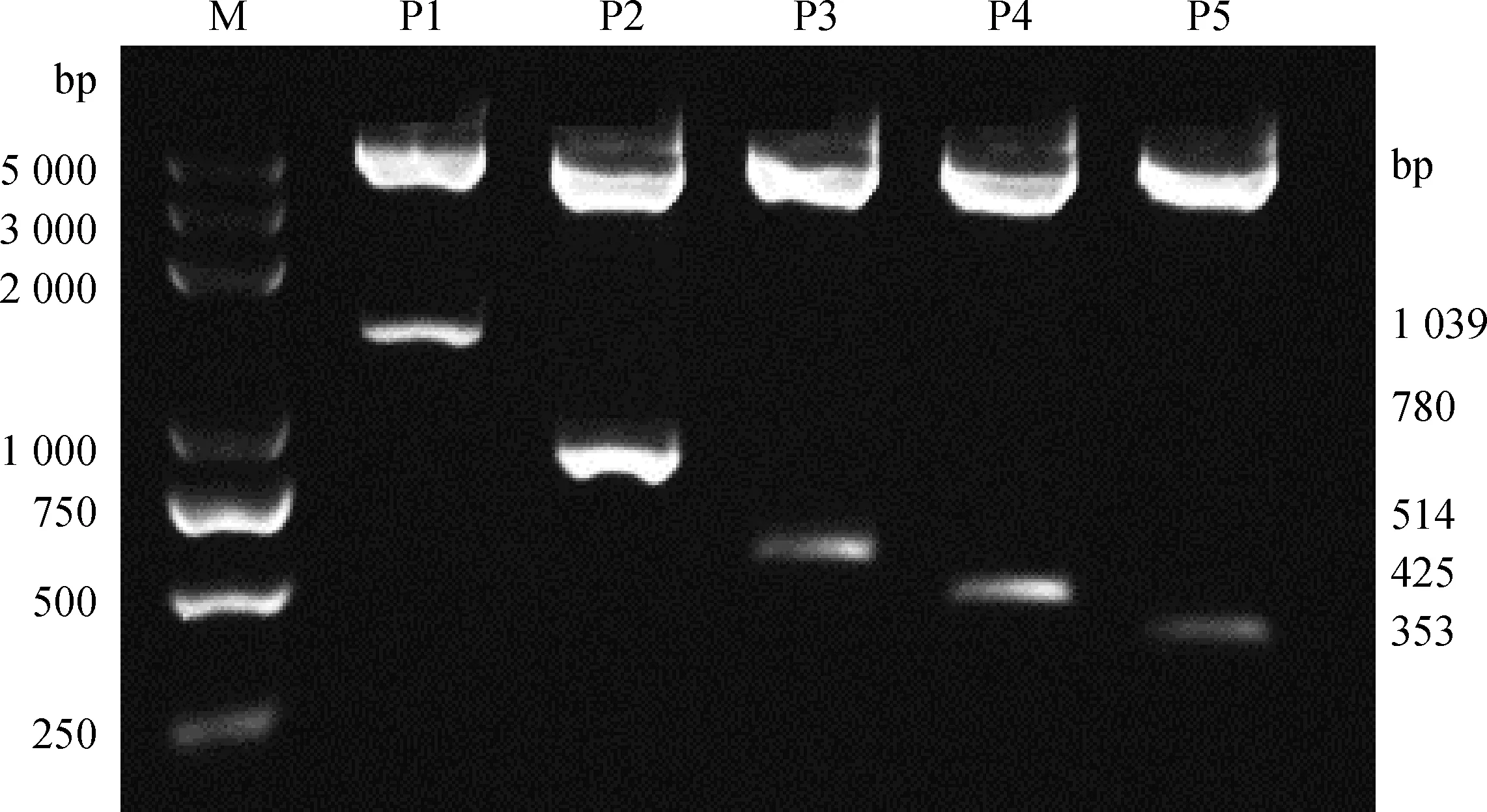
P1~P5.Luc报告基因载体双酶切产物;M.DNA相对分子质量标准DL5000P1-P5.Luc reporter gene vector double enzyme products;M.DL5000 DNA marker图4 重组质粒酶切检测结果Fig.4 Result of recombinant plasmid by digestion
由图5可以看出,FOXL2基因启动子随5′端截短,荧光素酶转录活性先升高再逐渐降低,并且在293T和A375细胞中的变化趋势几乎相同,说明试验结果具有可信度。缺失启动子片段在两种细胞中表达的共同特点是:pGL3-Basic/P5区段的启动子活性均为5个区段中活性最低的片段,但是这个缺失片段在两种细胞中与阴性对照相比仍然具有启动子活性,且统计学差异极显著(P<0.01);同时pGL3-Basic/P2与pGL3-Basic/P1片段相比,启动子活性极显著升高(P<0.01),其余缺失片段与pGL3-Basic/P2片段相比,启动子活性极显著降低(P<0.01)。结果表明,pGL3-Basic/P5缺失片段具备转录的基本元件;pGL3-Basic/P1片段中的(-934/-456)区域在转录过程中可能起了负调控的作用;pGL3-Basic/P2片段中的(-456/-192)区域为山羊FOXL2基因正调控区域。在A375细胞中各个缺失启动子片段荧光素酶的表达量均相应高于293T细胞,因此与293T细胞相比,A375细胞的内环境更适合于FOXL2基因启动子的转录。

**.P<0.01图5 FOXL2启动子缺失片段在293T和A375细胞中的活性比较Fig.5 Comparative activity of different promoters of FOXL2 in 293T and A375 cells
3 讨 论
本试验通过 5′RACE从 1 个月的山羊卵巢中成功克隆了FOXL2基因启动子序列,并确定翻译起始密码子。对所得序列进行生物信息学分析发现,该基因启动子区域存在两个典型的大小分别为972和430 bp的CpG岛,分别位于(-920/+51)区段和(+125/+555)区段。该启动子为典型的GC-rich启动子,并且包含 Sp1 结合位点,与M.Pannetier等人研究结果一致[17]。FOXL2基因启动子是通过CpG岛招募重要转录因子发挥启动转录作用[20]。CpG岛通常存在于基因启动子区域,基因末端常存在一些富含“CG”双核苷酸区域。CpG岛不仅是基因的一种标志,可通过CpG岛甲基化来参与基因表达调控和影响染色质结构[21]。FOXL2基因CpG岛的范围几乎包含了转录起始位点上游1 000 bp和下游500 bp,暗示该区域存在较为广泛的调控作用。
使用Promoter Scan程序预测FOXL2-SA启动子结合位点,结果给出了2个候选核心启动子区域,并且(+43/+293)区段预测分值高于(-276/-526)区段。其中两个区段中Sp1和AP-2转录因子出现频率最高,预示着这两种转录因子对FOXL2基因表达起着重要调控作用。+43~+293区域可能成为FOXL2基因核心启动子区。
综合对核心启动子及转录因子预测结果,推测出3个候选核心启动子区域分别是(+40/+300)区段、(-500/-200)区段和(-950/-900)区段。依据CpG岛位置、核心启动子预测位置和转录因子预测位置设计不同的启动子缺失片段,并连接至荧光素酶Luc报告基因载体,所构建的Luc报告基因载体分别为pGL3-Basic/P1(-934/+324)、pGL3-Basic/P2(-456/+324)、pGL3-Basic/P3(-192/+324)、pGL3-Basic/P4(-104/+324)和pGL3-Basic/P5(-32/+324),利用绿色荧光蛋白报告基因载体分别瞬时转染293T和A375细胞,发现所构建的缺失启动子片段均具备启动子活性,该结论与CpG岛存在范围相一致。其中在细胞中插入FOXL2基因不同长度的启动子片段,荧光素酶的转录活性有显著差异:随着5′端的截短,荧光素酶的转录活性先升高再逐渐降低。pGL3-Basic/P2片段与其他片段相比,启动子活性极显著升高,说明pGL3-Basic/P2片段中的(-456/-192)区域为山羊FOXL2基因正调控区域;pGL3-Basic/P5区段的启动子活性为5个区段中活性最低的片段,说明缺失了转录起始位点前所有片段的pGL3-Basic/P5片段为仍具备转录活性的基本元件,并且该结果与Promoter Scan程序的预测结果相一致。(-934/-456)区域的缺失使启动子转录活性显著上升,在转录过程中起了负调控的作用,(-456/-192)区域的缺失使启动子活性显著下降,可知该区域为FOXL2基因正调控区域[22]。
本研究克隆了山羊FOXL2基因的启动子片段,并通过生物信息学分析构建了启动子缺失报告基因载体,通过瞬时转染293T和A375细胞的体外尝试分析并探讨了该基因的转录活性区域,为进一步研究FOXL2基因表达调控奠定基础。有关FOXL2基因启动子的活性功能验证还有待于在更多种类细胞中进行试验。
4 结 论
山羊FOXL2基因(-934/+324)区域存在转录活性,(-934/-456)区域缺失使启动子转录活性显著上升,在转录过程中起负调控作用,(-456/-192)区域缺失使启动子活性显著下降,为FOXL2基因正调控区域。
[1] BEYSEN D,RAES J,LEROY B P,et al.Deletions involving long-range conserved nongenic sequences upstream and downstream ofFOXL2 as a novel disease-causing mechanism in blepharophimosis syndrome[J].AmJHumGenet,2005,77(2):205-218.
[2] 朱建莹,李艳艳,孙 岩,等.突变前后FOXL2 基因的生物信息学分析研究[J].中华临床医师杂志(电子版),2013,7(8):3351-3356. ZHU J Y,LI Y Y,SUN Y,et al.The bioinformatics study of normal and mutational humanFOXL2 gene[J].ChineseJournalofClinicians(ElectronicEdition),2013,7(8):3351-3356.(in Chinese)
[3] LI M H,YANG H H,LI M R,et al.Antagonistic roles of Dmrt1 andFoxl2 in sex differentiation via estrogen production in tilapia as demonstrated by TALENs[J].Endocrinology,2013,154(12):4814-4825.
[4] GENNOTTE V,MÉLARD C,D′COTTA H,et al.The sensitive period for male-to-female sex reversal begins at the embryonic stage in the Nile tilapia and is associated with the sexual genotype[J].MolReprodDev,2014,81(12):1146-1158.
[5] BAHAMONDE P A,MCMASTER M E,SERVOS M R,et al.Molecular pathways associated with the intersex condition in rainbow darter(Etheostomacaeruleum) following exposures to municipal wastewater in the Grand River basin,ON,Canada.Part B[J].AquatToxicol,2015,159:302-316.
[6] PISARSKA M D,BARLOW G,KUO F T.Minireview:roles of the forkhead transcription factorFOXL2 in granulosa cell biology and pathology[J].Endocrinology,2011,152(4):1199-1208.
[7] BOULANGER L,PANNETIER M,GALL L,et al.FOXL2 is a female sex-determining gene in the goat[J].CurrBiol,2014,24(4):404-408.
[8] GEORGES A,L′HTE D,TODESCHINI A L,et al.The transcription factorFOXL2 mobilizes estrogen signaling to maintain the identity of ovarian granulosa cells[J].Elife,2014,3:e04207.doi:10.7554/eLife.04207.
[9] GEORGES A,AUGUSTE A,BESSIÉRE L,et al.FOXL2:a central transcription factor of the ovary[J].JMolEndocrinol,2014,52(1):R17-R33.
[10] LI G L,ZHANG M Z,DENG S P,et al.Effects of temperature and fish oil supplementation on ovarian development and foxl2 mRNA expression in spotted scat Scatophagus argus[J].JFishBiol,2015,86(1):248-260.
[11] QIN N,LIU Q,ZHANG Y Y,et al.Association of novel polymorphisms of forkhead box L2 and growth differentiation factor-9 genes with egg production traits in local Chinese Dagu hens[J].PoultSci,2015,94(1):88-95.
[12] ELZAIAT M,JOUNEAU L,THÉPOT D,et al.High-throughput sequencing analyses of XX genital ridges lacking FOXL2 reveal DMRT1 up-regulation before SOX9 expression during the sex-reversal process in goats[J].BiolReprod,2014,91(6):1-14,153.[13] AUGUSTE A,CHASSOT A A,GRÉGOIRE E P,et al.Loss of R-spondin1 and Foxl2 amplifies female-to-male sex reversal in XX mice[J].SexDev,2011,5(6):304-317.
[14] PANNETIER M,ELZAIAT M,THÉPOT D,et al.Telling the story of XX sex reversal in the goat:highlighting the sex-crossroad in domestic mammals[J].SexDev,2012,6(1-3):33-45.
[15] PAILHOUX E,VIGIER B,CHAFFAUX S,et al.A 11.7-kb deletion triggers intersexuality and polledness in goats[J].NatGenet,2001,29(4):453-458.
[16] 张晶晶.无角间性奶山羊FOXL2基因及PIS区域变异研究[D].保定:河北农业大学,2010. ZHANG J J.Variation of PIS region andFOXL2 gene in the polled intersex dairy goat[D].Baoding:Agricultural University of Hebei,2010.(in Chinese)
[17] PANNETIER M,RENAULT L,JOLIVET G,et al.Ovarian-specific expression of a new gene regulated by the goat PIS region and transcribed by aFOXL2 bidirectional promoter[J].Genomics,2005,85(6):715-726.
[18] 夏江东,程在全,吴渝生,等.高等植物启动子功能和结构研究进展[J].云南农业大学学报,2006,21(1):7-14. XIA J D,CHENG Z Q,WU Y S,et al.Advances of the studles on function and composition of plant promoter[J].JournalofYunnanAgriculturalUniversity,2006,21(1):7-14.(in Chinese)
[19] ZHONG S,HE X,BAR-JOSEPH Z.Predicting tissue specific transcription factor binding sites[J].BMCGenomics,2013,14:796.doi:10.1186/1471-2164-14-796.
[20] TRAN S,WANG Y,LAMBA P,et al.The CpG island in the murine foxl2 proximal promoter is differentially methylated in primary and immortalized cells[J].PLoSOne,2013,8(10):e76642.
[21] ZHOU X Y,SUN J F,HE Y H,et al.Correlation of the methylation status of CpG islands in the promoter region of 10 genes with the 5-Fu chemosensitivity in 3 breast cancer cell lines[J].ChineseJournalofOncology,2010,32(5):328-333.
[22] MCLNTOSH A L,ATSHAVES B P,HOSTETLER H A,et al.Liver type fatty acid binding protein(L-FABP) gene ablation reduces nuclear ligand distribution and peroxisome proliferator-activated receptor-alpha activity in cultured primary hepatocytes[J].ArchBiochemBiophys,2009,485(2):160-173.
(编辑 郭云雁)
Activity and Regulation Region Analysis of Promoter of GoatFOXL2 Gene
GENG Li-ying1,2,ZHANG Yu1,2,LI Xiang-long1,2*,ZHOU Rong-yan2,LI Lan-hui2,WANG Zhi-gang2
(1.HebeiNormalUniversityofScience&Technology,Qinhuangdao066600,China;2.CollegeofAnimalScienceandTechnology,AgriculturalUniversityofHebei,Baoding071000,China)
The research was designed to study the activity of goat ovarian maintenance geneFOXL2 promoter and explore the gene’s regulation mechanism.FOXL2 promoter sequence was retrieved from the NCBI database,bioinformatics software was adopted to predict its core promoter and transcription factors.PCR technology was used to cloneFOXL2 gene promoter sequence and construct a series of deletion vectors,293T and A375 cells were transiently transfected,dual luciferase gene detector was used to measure the relative luciferase activity value.The results indicated that there were 2 typical CpG islands in the gene promoter region,which were located at (-920/+51(972 bp)) and (+125/+555(430 bp)) regions;the result ofKpnI andHind Ⅲ dual enzyme digestion test suggested that the recombinant plasmid was constructed correctly;FOXL2 gene promoter fragments with different lengths were inserted into the cells.When the promoter 5′was truncated,luciferase transcriptional activity firstly increased and then decreased.The result indicate that (-934/+324) region has transcriptional activity,(-32/+324) region contain the basic elements of transcription;(-934/-456) region negatively regulatesFOXL2 gene during the transcription process,(-456/-192) region is a positive regulatory region.
goat;FOXL2 gene;promoter;activity
10.11843/j.issn.0366-6964.2015.12.005
2015-01-06
河北省高校创新团队领军人才培育计划(LJRC004)
耿立英(1974-),女,山东平原人,副教授,博士生,主要从事动物遗传育种研究,E-mail:rosegengly@126.com
*通信作者:李祥龙,教授,博士,博士生导师,主要从事动物遗传育种研究,E-mail:lixianglongcn@yahoo.com
S827;S813.3
A
0366-6964(2015)12-2153-08

