拟青霉WPG-1的鉴定及固体发酵产β-1,3-1,4-葡聚糖酶条件的优化
唐艳斌,胡婉峰*
(1.华中农业大学 食品科学与技术学院,湖北 武汉 430070;2.中国疾病预防控制中心 营养与健康所,北京 100050;3.国家卫生计生委 微量元素重点实验室,北京 100050)
β-葡聚糖(glucan)是以β-葡萄糖残基通过β-1,3和β-1,4糖苷键以一定的比例连接而成的线性分子,在大麦、燕麦、高粱、大米和小麦等谷物的胚乳细胞壁中的含量尤其丰富[1]。β-葡聚糖通常以高分子形式溶于水,造成溶液黏度较高,给工业生产带来诸多问题[2]。例如,在啤酒行业中,大麦作为主要生产原料,其β-葡聚糖含量(4%~8%)较高,造成麦汁和啤酒黏度增加,致使麦汁过滤困难、得率降低,并引起啤酒的非生物性浑浊,影响啤酒的稳定性和质量[3]。在饲料行业中,以大麦等谷物作为饲料,高分子质量的β-葡聚糖引起畜禽胃液黏度增加,阻碍单胃动物对养分的吸收,谷物饲用价值降低。β-1,3-1,4-葡聚糖酶(EC 3.1.2.73)是啤酒行业和饲料工业中一种重要工业酶制剂,它主要水解β-葡聚糖中β-1,4糖苷键连接的3-O-替代的葡萄糖残基成为较小的聚合物,从而降低β-葡聚糖对啤酒和饲料行业所造成的问题[3-5]。
β-1,3-1,4-葡聚糖酶的获得主要由微生物发酵生产,发酵方法主要有液体发酵[6-9]。相比于液体发酵而言,固体发酵具有生产成本低,工艺简单,对机械设备和耗能等要求不高,环境污染小,适宜真菌生长等优势,近年来越来越受到关注[10]。国内外关于真菌产β-1,3-1,4-葡聚糖酶的研究还不是很多,到目前为止主要以中温菌木霉(Trichoderma)和黑曲霉(Aspergillus niger)为主[11],而关于耐热真菌发酵产β-1,3-1,4-葡聚糖酶的固体发酵的研究报道较少[12-13]。
本研究前期分离筛选得到一株拟青霉WPG-1,发现该菌能够产β-1,3-1,4-葡聚糖酶,拟进一步采用固体发酵的方式,通过单因素试验优化拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的发酵工艺,为其工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 培养基
菌种的初筛和复筛以及菌种保藏培养基都采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20.0 g,琼脂15.0 g,蒸馏水1 000 mL。
种子液培养基:在250 mL三角瓶中加入1 g麸皮和50 mL营养盐溶液,121 ℃灭菌30 min,冷却后接种1 cm2大小左右菌丝体,置于空气浴振荡摇床中50 ℃、200 r/min振荡培养24 h。
固态发酵培养基:碳源,氮源(氮素含量均为0.2%),20 mL营养盐溶液(CaCl20.3 g/L,MgSO4·7H2O 0.3 g/L,KH2PO45 g/L),调节pH值为5.0。
1.1.2 试剂
大麦葡聚糖、葡萄糖:美国Sigma公司;蛋白质低分子质量标准品、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP):大连TaKaRa公司;酵母提取物、胰蛋白胨:英国Oxoid公司;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS):美国Amresco公司;TaqPlus DNA聚合酶、PCR引物:上海生工生物工程股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LRH-恒温恒湿培养箱:广东省医疗器械厂;TU-1800PC紫外分光光度计:北京普析通用仪器设备有限责任公司;Power Pac Basic TM 型电泳仪:美国BIO-RAD 公司;GL-20B高速冷冻离心机:上海安亭科技仪器厂。
1.3 试验方法
1.3.1 菌种的筛选
将来自新疆、青海、西藏、宁夏等地的200多个土样分批用无菌水稀释100倍,吸取0.1 mL涂布于马铃薯葡萄糖琼脂培养基平板上,然后将平板置于45 ℃培养箱中静置培养4 d,观察平板菌落生长情况,挑选平板上不同的耐热真菌划线纯化。将初筛出的菌株进行进一步划线分离,再在PDA培养基上培养,直至得到单一菌株;再将得到的单一菌株在PDA培养基上保存于4 ℃条件下,每隔4~5周转接一次。
1.3.2 菌种的鉴定
菌种鉴定分为两个步骤:(1)肉眼观察其单一菌落形态、颜色、气味等;(2)采用分子生物学鉴定:DNA的提取与扩增:DNA的提取方法参照WANG L等的方法[14]。18S rDNA的扩增采用通用的引物NS1-NS24[15]。
聚合酶链反应(polymerse chin rection,PCR)体系:在50 μL的混合液中进行,混合液中含有2.3 μL 基因组DNA,5 μL PCR缓冲液,1 μL dNTP(1 mmol/L),2 μL引物(10 pmol/μL),0.7 μLTaq聚合酶(2 U/μL)和37 μL超纯无菌水。
PCR条件:94 ℃4 min;94 ℃1 min,55 ℃1 min,72 ℃1.5 min,35个循环;最后延伸7 min。
DNA序列测定、序列比对和种系发育分析:PCR的扩增产物通过琼脂糖凝胶电泳纯化后,由上海Genecore生物技术有限公司进行测序通过Clustal X进行序列比对。对比对结果进行了校正和调整。选择毛缘毛杯菌(Cookeina tricholoma)作为外群。用PAUP 4.0b10进行DNA分析。最后通过Bootstrap分析的1 000次重复和TBR交换技术对发育树分支进行了验证。
1.3.3 固体发酵产β-1,3-1,4-葡聚糖酶
在250 mL三角瓶中加入烘干后的各种碳源和19 mL营养盐溶液,搅拌均匀,121 ℃灭菌30 min,冷却后接种1 mL种子液,混匀后置于45 ℃培养箱中静止培养4 d。
粗酶液的提取:每克固体发酵物加入10 mL 50 mmol/L,pH 6.0柠檬酸缓冲液,37 ℃下200 r/min振荡提取2 h,10 000×g冷冻离心10 min,吸取上清液即为β-1,3-1,4-葡聚糖酶的粗酶液。
1.3.4 固体发酵产酶条件的优化
采用单因素试验法优化拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的条件。选用不同的碳源考察对该菌株产酶的影响。在优化碳源基础上通过改变水分含量(从60%~90%)、氮源种类(氮素含量均为0.2%)、培养基初始pH值和培养温度。在最佳培养基和培养条件下,每天取样后测β-1,3-1,4-葡聚糖酶活性和蛋白含量,了解产酶历程。
1.3.5 酶活力及蛋白含量的测定
酶活力的测定方法[12]:取0.1 mL适当稀释的酶液,加入0.9 mL(用50 mmol/L pH 6.0柠檬酸缓冲液配制)0.5%大麦葡聚糖底物中,60 ℃反应10 min,以葡萄糖作为标准采用DNS法测定所产生的还原糖量。β-1,3-1,4-葡聚糖酶的活力单位定义为:在上述反应条件下,每分钟生成1 μmol葡萄糖所需要的酶量(U/g)。
蛋白含量的测定参照LOWRY O H等[17]的方法,以牛血清白蛋白作为标准蛋白。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳及酶谱
十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳检测按照LAEMMLI U K等[18]的方法。考马斯亮蓝R-250染色。β-1,3-1,4-葡聚糖酶酶谱分析为正常的SDS-PAGE后(电泳胶中含有0.2%的大麦葡聚糖),将电泳胶取出用25%的异丙醇溶液浸泡3次(10 min/次),使蛋白复性,然后用缓冲液浸泡3次(10 min/次)洗去异丙醇溶液,最后将电泳胶置于45 ℃条件下保温30 min,加入0.5 g/L的刚果红溶液染色30 min,用1 mol/L NaCl溶液脱色直至显现透明带。
1.3.7 数据处理
每组试验设置3个重复,试验数据采用Excel软件处理。
2 结果与分析
2.1 产酶菌株筛选
利用PDA培养基筛选平板,共筛选得到产葡聚糖酶真菌菌株25株,经摇瓶发酵(1 g麸皮,1 g蛋白胨和50 mL营养盐溶液,接种1 cm2大小左右菌丝体,置于空气浴振荡摇床中50 ℃、200 r/min振荡培养4 d)和酶活力测定,筛选出一株真菌产葡聚糖酶较高,为79.61 U/mL,该菌株在30~55 ℃范围内生长良好,最适生长温度45 ℃,当温度>55 ℃基本不生长。PDA培养基45 ℃培养5 d的单菌落结果见图1。由图1可知,菌落正面颜色呈灰粉色,从毛状菌落,无特殊气味;显微镜下孢子呈卵圆形,分生孢子梗类似扫帚分枝。
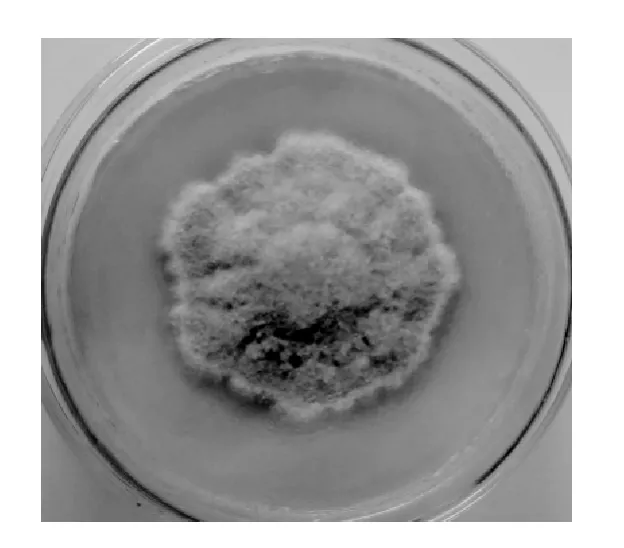
图1 菌株WPG-1菌落形态特征Fig.1 Colony morphology of strain WPG-1
2.2 菌株的分子生物学鉴定
以提取的WPG-1菌株DNA作为模板,以通用PCR引物进行扩增,引物序列为SR1R:5-TACCTGGTTGATCCT GCCAGT-3;SR6R:5-CCTTGTTACGACTTTTACTT-3。PCR产物进行琼脂糖电泳分析,结果见图2。

图2 菌株WPG-1的18S rDNA PCR扩增电泳图Fig.2 Electrophresis of PCR amplified 18S rDNA of strain WPG-1
将图2中第1泳道的PCR扩增产物进行测序后,全长为1 711 bp。在18S rDNA基因序列同源性基础上构建系统发育树,结果见图3,结合形态学观察,通过分子生物学提取DNA测序比对后,初步鉴定该菌株为拟青霉属(Paecilomycessp.),菌株命名为WPG-1。

图3 菌株WPG-1的18S rDNA序列系统发育树Fig.3 Phylogenetic tree of strain WPG-1 based on 18S rDNA sequences
2.3 不同碳源对菌株WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响
分别采用燕麦粉、大麦粉、玉米芯、白酒酒糟、高粱秆、麸皮、稻草粉作为单一碳源进行固体发酵产酶试验,结果如表1所示。

表1 不同碳源对拟青霉WPG-1产酶的影响Table 1 Effect of carbon sources on β-1,3-1,4-glucanase production by Paecilomyces sp.WPG-1
由表1可知,燕麦粉作为碳源时菌株WPG-1产酶量最高为589.64 U/g,麸皮次之(518.02 U/g),其他几种碳源如玉米秆、高粱杆、稻草等用作碳源时,所产β-1,3-1,4-葡聚糖酶活力均较低。这可能是由于燕麦粉中含有一定量的β-葡聚糖,而β-1,3-1,4-葡聚糖酶是诱导酶,可充分利用燕麦粉作为唯一碳源充分发酵产酶。因此,选择燕麦粉作为固体发酵最佳碳源。
2.4 初始水分含量对菌株WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响
固体发酵过程中,培养基初始水分含量是关键性因素之一。不同含水量对产β-1,3-1,4-葡聚糖酶的影响如图4所示。由图4可知,当培养基的初始水分含量为70%时,β-1,3-1,4-葡聚糖酶的产量最高(723.31 U/g)。许多研究表明固体发酵条件下,初始水分含量高适合大多数真菌生长和产酶[19]。这可能是因为含水量过低时,孢子萌发迟滞期延长,影响菌丝体的生长周期,同时降低了固态底物中营养物质的溶解性和微生物生长所需要的水分活度,从而导致产酶量较低,而当含水量过高时,培养及表面黏连,造成培养基溶氧量不足,而发酵不彻底[20]。因此调节适当的初始水分含量对菌株生长至关重要,该试验选择70%的初始水分含量固体发酵结果最适合。

图4 初始水分含量对拟青霉WPG-1产β-1,3-1,4-葡聚糖酶的影响Fig.4 Effect of initial moisture content on β-1,3-1,4-glucanase productionby Paecilomyces sp.WPG-1
2.5 不同氮源对菌株WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响
β-1,3-1,4-葡聚糖酶属于诱导酶,其产酶量的高低受到酶诱导物及酶蛋白质前体的调控,而酶蛋白质的前体主要来自氮源。因此氮源的类型及性质都会影响酶的合成和分泌。不同氮源(氮素含量均为0.2%)对产酶的影响结果如表2所示。

表2 不同氮源对拟青霉WPG-1产酶的影响Table 2 Effect of nitrogen sources on β-1,3-1,4-glucanase production by Paecilomyces sp.WPG-1
由表2可知,国产蛋白胨作为氮源时,产β-1,3-1,4-葡聚糖酶活最高为1 167.56 U/g。因此,选择国产蛋白胨作为最佳氮源,进行下一步实验优化。
2.6 培养基初始pH对菌株WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响

图5 初始pH值对拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响Fig.5 Effect of initial pH on β-1,3-1,4-glucanase production by Paecilomyces sp.WPG-1
由图5可知,偏酸性环境下有利于β-1,3-1,4-葡聚糖酶的合成。当初始pH自然(pH 5.4)时,拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的量达到最大(1 187.30 U/g)。这与李孝辉等[16]报道的黑曲霉G-415菌株固体发酵产β-葡聚糖酶的情况一致。因此,选择当营养盐初始pH为自然时为最佳发酵pH。
2.7 培养温度对菌株WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响

图6 培养温度对拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的影响Fig.6 Effect of culture temperature on β-1,3-1,4-glucanase production by Paecilomyces sp.WPG-1
由图6可知,当发酵温度为45 ℃时菌株产酶量最高,达到1 204.11 U/g。当培养温度继续上升至55 ℃时,酶活力急剧下降,为最高酶活力的30%左右。这是因为该菌株最适生长温度为45 ℃,当温度超过或低于45 ℃时,菌株都不能很好的生长,那么不能很好的利用培养基中的营养物质进行发酵产酶,因此导致产酶量下降。本实验选择发酵温度为45 ℃为最佳固体发酵温度。
2.8 菌株WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的产酶历程
确定各发酵条件的最优参数后,在最佳发酵条件的基础上考察β-1,3-1,4-葡聚糖酶的产酶历程,结果如图7所示,所产胞外蛋白的SDS-PAGE电泳图及相应的酶谱图如图8所示。
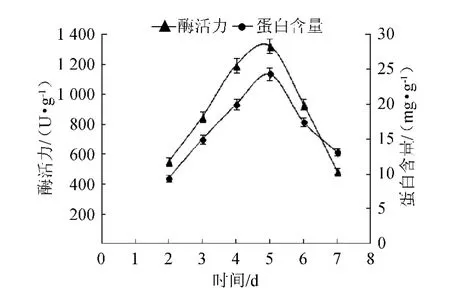
图7 拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖酶的历程Fig.7 The time course of β-1,3-1,4-glucanase production by Paecilomyces sp.WPG-1
由图7可知,菌株拟青霉WPG-1在优化后的发酵条件下,从第3天开始产酶速度加快,到第5天时酶活力达到最高值1 324.49 U/g,然后随着发酵时间的增加,酶活力开始下降。因此,发酵时间5 d为宜。

图8 不同发酵时间拟青霉WPG-1发酵液SDS-PAGE电泳图及酶谱图Fig.8 SDS-PAGE electrophoresis and enzyme spectrum diagram of the fermentation broth produced by Paecilomyces sp.WPG-1 with different time
由图8可知,拟青霉WPG-1所产胞外蛋白仅有1条β-1,3-1,4-葡聚糖酶带,分子质量为35 ku左右。
3 结论
从全国来源不同的土样中筛选得到一株产β-1,3-1,4-葡聚糖酶的真菌菌株,经过菌落形态及分子生物学检测,初步鉴定为拟青霉(Paecilomycessp.)WPG-1。该菌株的最适生长温度为45 ℃,通过单因素优化试验结果表明,当以燕麦粉为碳源,蛋白胨(氮素含量0.2%)为氮源,初始水分含量70%,初始pH为自然,培养温度45 ℃时,培养发酵5 d,拟青霉WPG-1固体发酵产β-1,3-1,4-葡聚糖1 324.49 U/g,可较好地运用于饲料及啤酒工业。
[1]WOODWARD J R,PHILLIPS D R,FINCHERir G B.Water-soluble(1→3),(1→4)-β-D-glucans from barley (Hordeum vulgare) endospermⅡfine structure[J].Carbohyd Polym,1983,3(3):207-225.
[2]PLANAS A.Bacterial β-1,3-1,4-glucanase:structure,function and protein engineering[J].Biochim Biophys Acta,2000,1543(2):361-382.
[3]韩 晶,李宝坤,李开雄.嗜热β-葡聚糖酶产生菌的筛选及其培养基优化研究[J].中国酿造,2008,27(21):33-36.
[4]BAMFORTH C W.β-glucan and β-glucanases in malting and brewing:practical aspects[J].Brew Dig,1994,69(5):12-16.
[5]BECKMANN L,SIMON O,VAHJEN W.Isolation and identification of mixed linked β-glucan degrading bacteria in the intestine of broiler chickens and partial characterization of respective 1,3-1,4-β-glucanase activities[J].J Basic Microbiol,2006,46(3):175-185.
[6]郝秋娟,李永仙,李 琦,等.淀粉液化芽孢杆菌5582 产β-葡聚糖酶的发酵条件和酶学性质研究[J].食品工业科技,2006,27(8):149-153.
[7]郑元平,袁康培,冯光明.啤酒用β-葡聚糖酶高产菌株的选育及发酵条件优化[J].农业生物技术学报,2004,3(12):316-321.
[8]李永仙,郑云飞,李 崎,等.RSM 法优化产β-葡聚糖酶的发酵培养基[J].食品工业科技,2009,30(8):137-139.
[9]TANG X J,HE G Q,CHEN Q H,et al.Medium optimization for the production of thermal stable β-glucanase byBacillus subtilisZJF-1A5 using response surface methodology[J].Bioresource Technol,2004,93(2):175-181.
[10]DOS SANTOS M M,DA ROSA A S,DALl'BOIT S,et al.Thermal denaturation:is solid state fermentation really a good technology for the production of enzymes[J].Bioresource Technol,2004,93(3):261-268.
[11]孙建义.木霉GXC 产β-葡聚糖酶条件和酶学性质[J].微生物学报,2001,41(4):42-45.
[12]TANG Y B,YANG S Q,YAN Q J,et al.Purification and characterization of a novel β-1,3-1,4-glucanase (lichenase) from thermophilicRhizomucor mieheiwith high specific activity and its gene sequence[J].J Agr Food Chem,2012,60(9):2354-2361.
[13]YANG S Q,YAN Q J,JIANG Z Q,et al.Biochemical characterization of a novel thermostable β-1,3-1,4-glucanase (lichenase) fromPaecilomyces thermophila[J].J Agr Food Chem,2008,56(13):5345-5351.
[14]WANG L,ZHUANG W Y.Designing primer sets for amplification of partial calmodulin genes fromPenicillia[J].Mycosystema,2004,23(4):466-473.
[15]GARGAS A,TAYLOR J W.Polymerase chain reaction (PCR) primers for amplifying and sequencing nuclear 18S rDNA forLichenized funge[J].Mycologia,1992,84:589-892.
[16]崔云前,王如如,刘常姝,等.重组大肠杆菌高效表达细胞外β-葡聚糖酶研究进展[J].中国酿造,2013,32(4):16-18.
[17]LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[18]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[19]HALTTICH D,NIDETZKY B,KULLBE K D,et al.Celluloytic and hemicellulolytic enzymes ofSclerotium rolfsii:Optimization of the culture medium and enzymatic hydrolysis of lignocellulosic material[J].Bioresource Technol,1994,58(1):43-50.
[20]李秀婷,杨绍青,江正强,等.利用农业废弃物生产嗜热真菌(T.lanuginosus)耐热木聚糖酶的固体发酵研究[J].工业微生物,2004,34(4):13-18.

